高效凝胶色谱法同时测定普鲁兰多糖生物合成过程中分子量和含量
2018-04-12安超薛文娇马赛箭丁浩
安超,薛文娇,马赛箭,丁浩
(陕西省微生物研究所,陕西西安710043)
普鲁兰多糖是由出芽短梗霉(Aureobacidium pullulans)发酵产生的细胞外纯天然高分子多糖,是一种新型可降解生物材料。该多糖是以α-1,6-糖苷键连接的聚麦芽三糖,一般没有分支结构,是直链多糖,具有良好的生物相容性。近年来,普鲁兰多糖在药物载体、药物控释、生物材料(如水凝胶、人工骨)等方面被广泛研究及应用。这些领域的开发将直接提升普鲁兰多糖的价值,但同时也对普鲁兰多糖分子量大小和分布提出了更高的要求。商品化的普鲁兰多糖重均分子量只有两种规格,分别为200 kDa和300 kDa,这在很大程度上限制了普鲁兰多糖在生物医药中应用。
普鲁兰多糖分子量的范围在1.5×104Da~1.0×107Da之间,其主要受生产菌种和发酵条件影响[1]。研究发现,普鲁兰多糖发酵培养基组成和发酵周期是影响普鲁兰多糖分子量大小的主要因素[2-4],特别是在发酵过程中,普鲁兰多糖分子量是一个动态的变化。一般而言,聚合物分子量的测定可以通过黏度法、小角激光光散射法和凝胶色谱法[5-6]。在出芽短梗霉发酵生产普鲁兰多糖的过程中,传统的普鲁兰多糖分子量和含量检测方法需要首先获得普鲁兰多糖干燥固体,进而通过称重法和高效凝胶色谱法分别测定发酵过程中普鲁兰多糖产量和分子量[7],其中,干燥的过程需要1天时间,这种方法不能实时监控发酵过程中普鲁兰多糖的分子量和含量。为了实现在发酵过程中同步检测普鲁兰多糖的含量和分子量大小,在本研究中,通过建立一种快速的检测方法,直接利用发酵液通过高效凝胶色谱法同时检测出芽短梗霉发酵液中普鲁兰多糖的含量和分子量大小,这为精准控制普鲁兰多糖发酵过程中普鲁兰多糖分子量及含量提供可靠技术手段。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
低色素分泌的出芽短梗霉(Aureobasidium pullulans)CGMCC No.11602,由陕西省微生物研究所代谢产物研究中心选育获得,目前,以专利菌株形式保藏于中国普通微生物保藏中心。
1.1.2 培养基
种子培养基(g/L):葡萄糖 50 g,酵母粉 2.5 g,(NH4)2SO40.6 g,NaCl 1.0 g,K2HPO45.0 g,MgSO4·7H2O 0.2 g,蒸馏水 1 L,初始 pH 6.5。
发酵培养基(g/L):蔗糖50 g,酵母粉2.5 g,(NH4)2SO40.6 g,NaCl 1.0 g,K2HPO45.0 g,MgSO4·7H2O 0.2 g,蒸馏水 1 L,初始 pH 6.5。
1.1.3 标准物质
不同分子量普鲁兰多糖的标准物:Sigma公司,具体如表1所示。
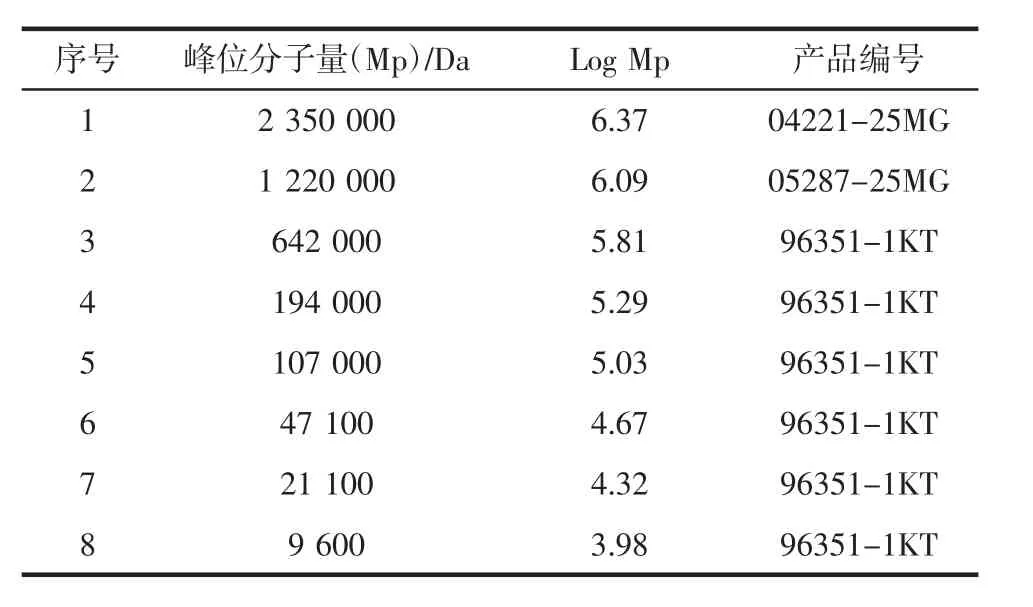
表1 不同分子量普鲁兰多糖标准品Table 1 The pullulan standard with different molecular weight
1.1.4 试剂
无水乙醇(分析纯):天津天力化学试剂有限公司,硝酸钠(分析纯):上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
生化培养箱SPX-250:北京科伟永兴仪器有限公司;恒温摇床ZWY-2102:上海智城分析仪器制造有限公司;冷冻离心机 5804R:Eppendorf co.,LTD;万分之一天平 BSA 2245(Sartorius co.,LTD),4×5L 发酵罐:上海宝兴生物仪器有限责任公司;高效凝胶色谱仪1515-2424、保护柱(UltrahyfrogelTM6×40 mm)和凝胶柱(UltrahydrogelTMLinear 7.8×300 mm):Waters Chromatography,Inc。
1.3 方法
1.3.1 普鲁兰多糖发酵
平板活化:将4℃斜面保藏的出芽短梗霉SWP35接种于PDA平板上,28℃培养5 d。
种子培养:将活化好的菌种接种于种子培养液,28℃,1 230 r/min摇床培养2 d。
发酵罐培养:按照5%的接种量,将培养好的种子液接种于装有3 L发酵培养液的5 L玻璃发酵罐中,培养温度28℃,转速400 r/min,通气量1vvm,尾压0.05 Mpa。
1.3.2 普鲁兰多糖产量及分子量测定
在发酵过程中,每24h取样一次,每次取样30mL,装入50mL离心管中,通过转速10000r/min,离心6min去除菌体,然后取上清液15 mL加入30 mL预冷的无水乙醇沉淀,4℃维持12 h,最后通过转速8 000r/min,离心6 min,获得酒精沉淀物,最后通过80℃烘干,通过称重法计算发酵液中普鲁兰多糖含量[8]。
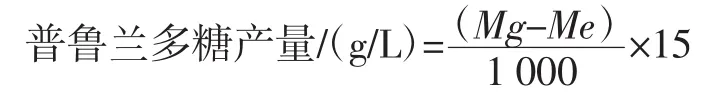
式中:Mg为总重,g;Me为离心管空重,g。
根据传统的分子量测定方法,通过烘干获得的粗多糖被研磨成粉,并且用水配制成1mg/mL的溶液,然后通过高效凝胶色谱法进行测定。在本研究中,通过对发酵过程中发酵液上清液进行合理稀释,然后通过高效凝胶色谱法同时测定普鲁兰多糖的含量和分子量。
1.3.3 高效凝胶色谱测定普鲁兰多糖的方法
流动相 0.1 mol/L NaNO3,流速 0.5 mL/min,柱温30℃,示差折光检测器检测(Waters 2424),进样量20 μL,所有的测试结果通过Breeze软件(Waters Chromatography,Inc)积分处理[9]。
1.3.4 普鲁兰多糖标准曲线测定
根据文献报道[10],使用6个1mg/mL水溶液的普鲁兰多糖分子量标准品(Mw范围:9600Da~2350000Da),依据上述测试方法进行分子量的测定,通过仪器自带的Breeze软件进行标准曲线绘制。普鲁兰多糖含量的标准曲线则采用3个已知分子量(Mp:6 100 Da,47 100 Da,642 000 Da),且已知浓度(0.2mg/mL~1.0mg/mL)的普鲁兰多糖标准品进行测定,通过对其峰面积积分进行标准曲线绘制。
1.3.5 准确性和重复性
准确性:根据上述测试方法,分别对已知浓度、已知分子量的两个不同分子量普鲁兰多糖标准品的水溶液进行6次测试。错误率被用来描述实际测试样品的分子量(Mwo)与原始样品的分子量(Mw)之间的误差关系,具体计算方法为:
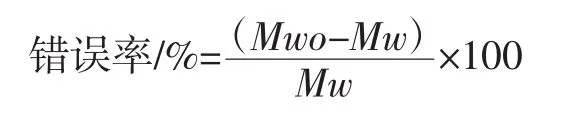
回收率被用来评估方法的准确性,通过比较测试样品含量(Co)和原始样品含量(Cn)之间的比值来计算。具体的计算方法如下:
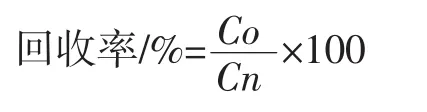
重复性:通过对两组普鲁兰多糖标准液进行6个平行样本的测试数据,计算出RSD%(相对标准偏差)。
1.3.6 分析方法
所有的检测都设置3个重复试验,数据通过Origin Pro 8(OriginLab Corporation,Northampton,USA)软件进行方差分析,使用Tukey法进行不同样本在95%置信水平平均值之间的统计学差异比较。
2 结果与讨论
2.1 普鲁兰多糖分子量标准曲线的测定
根据分子量大小差异,6个不同分子量普鲁兰多糖标准品被分为2组,配制成混合水溶液进行高效凝胶色谱检测,结果如图1所示。

图1 6个普鲁兰多糖分子量标准品的高效凝胶色谱图Fig.1 The high gel chromatography of six pullulan polysaccharides molecular weight standard
由图1可以看出,每组混合样品中,不同分子量普鲁兰多糖都能得到较好分离。按照Waters自带的Breeze软件进行标准曲线制作,如图2所示,结果表明:普鲁兰多糖流出体积(mL)与log Mp线性关系很好,相关系数R2为99.83%。6个样本积分计算结果如表2所示。
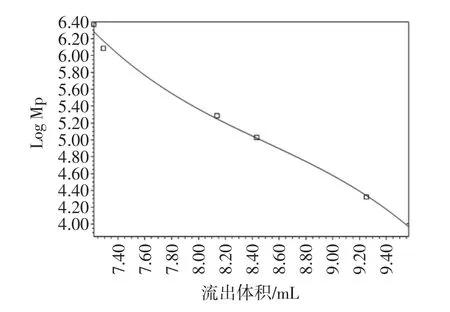
图2 普鲁兰多糖分子量标准曲线Fig.2 The standard curve of pullulan molecular weight
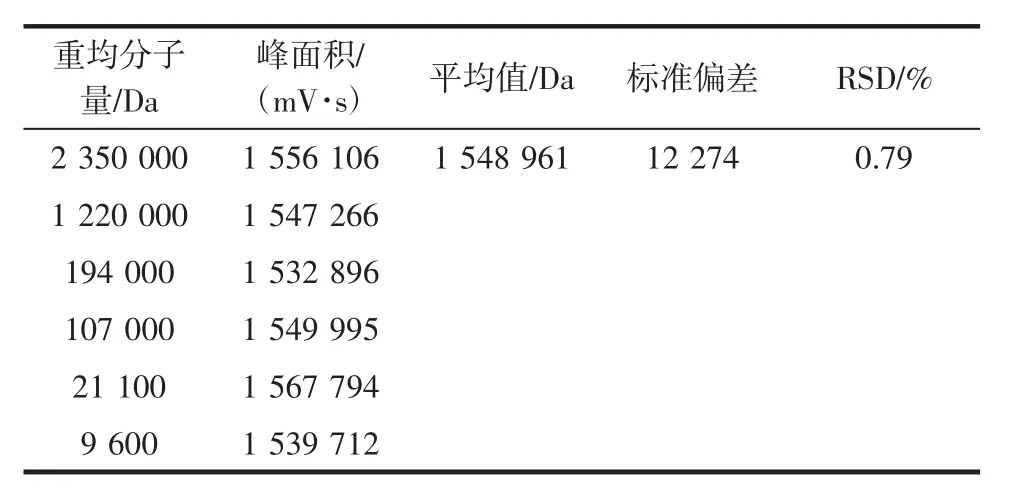
表2 6个普鲁兰多糖标准品积分计算Table 2 The results of six samples integral calculation
结果表明:当不同分子量的普鲁兰多糖具有相同浓度时,积分面积的相对标准偏差为0.79%。因此,可以推断峰面积只与普鲁兰多糖浓度有关,可能不受分子量的影响。
2.2 普鲁兰多糖含量标准曲线测定
5个不同浓度的普鲁兰多糖标准品混合溶液的色谱分离结果如图3所示。
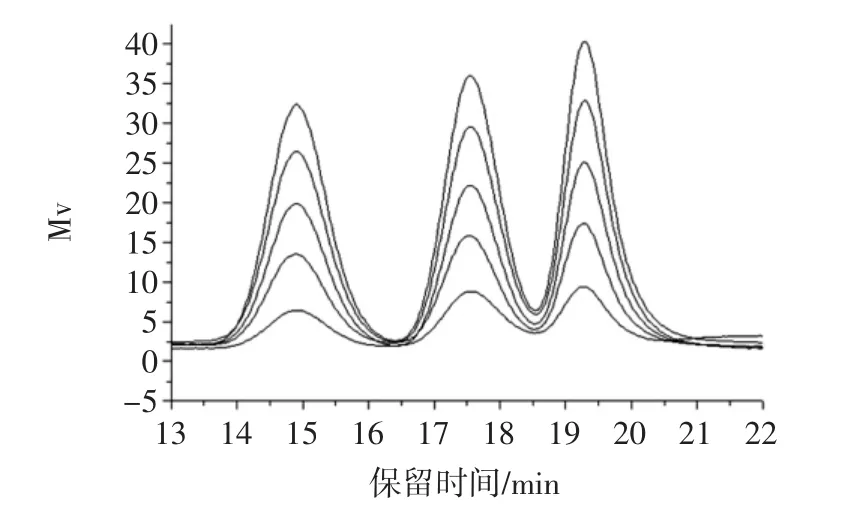
图3 凝胶色谱标准曲线测定Fig.3 The standard curve of the gel permeation chromatogram
由图3可以看出,峰面积大小与普鲁兰多糖含量存在一定的线性关系,通过Breeze软件积分,结果如表3所示。
在0.2mg/mL~1.0mg/mL浓度范围内,在同一浓度的条件下,普鲁兰多糖峰面积的相对标准偏差RSD%的范围为0.64%~0.95%,远远小于1%,重复性好。将峰面积与含量进行线性拟合,结果如图4所示。
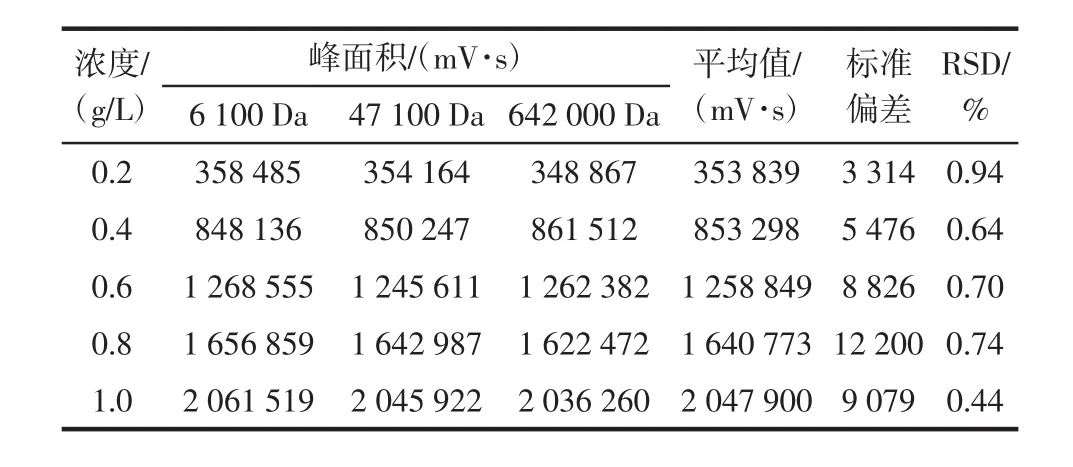
表3 峰面积的统计结果从五浓度的pullulan标准Table 3 The statistical results of peak area from five concentrations of the pullulan standards
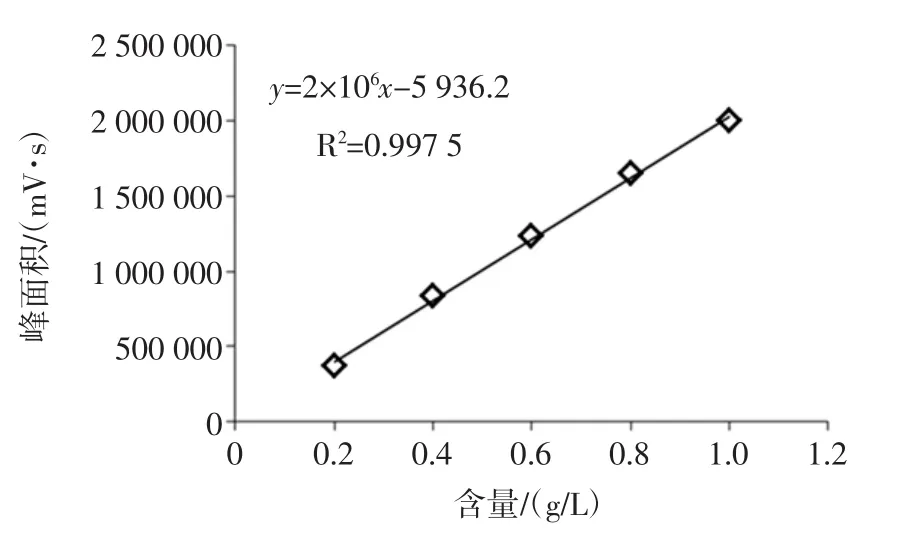
图4 普鲁兰多糖含量的标准曲线Fig.4 The standard curve between peak areas and concentrations of pullulan
由图4可以看出:峰面积与普鲁兰多糖含量之间符合正相关关系,相关系数R2为0.997 5。
2.3 稳定性、重复性和准确性的评估
使用2个已知浓度的普鲁兰多糖标准品进行方法稳定性和回收率试验,按照上述试验步骤进行处理,平行测定6次,计算回收率和相对标准偏差(RSD%),测试结果见表4。
由表4可以看出,通过该方法,2个样品分子量测试中,相对标准偏差(RSD%)分别为0.14%和0.13%,误差率分别为0.04%和0.02%;而在含量的测试中,相对标准偏差(RSD%)分别为0.02%和0.01%,产品回收率分别达到99.7%和99.6%。
2.4 出芽短梗霉CGMCC No.11602发酵生产普鲁兰多糖过程中含量及分子量两种测定比较
为了验证新方法的可靠性,在本文中,同时采用了新方法和传统方法,在出芽短梗霉CGMCC No.11602发酵生产普鲁兰多糖同时测定普鲁兰多糖含量和分子量。单因素方法分析被用来评价新方法和传统方法测试结果的显著性,结果如表5所示。
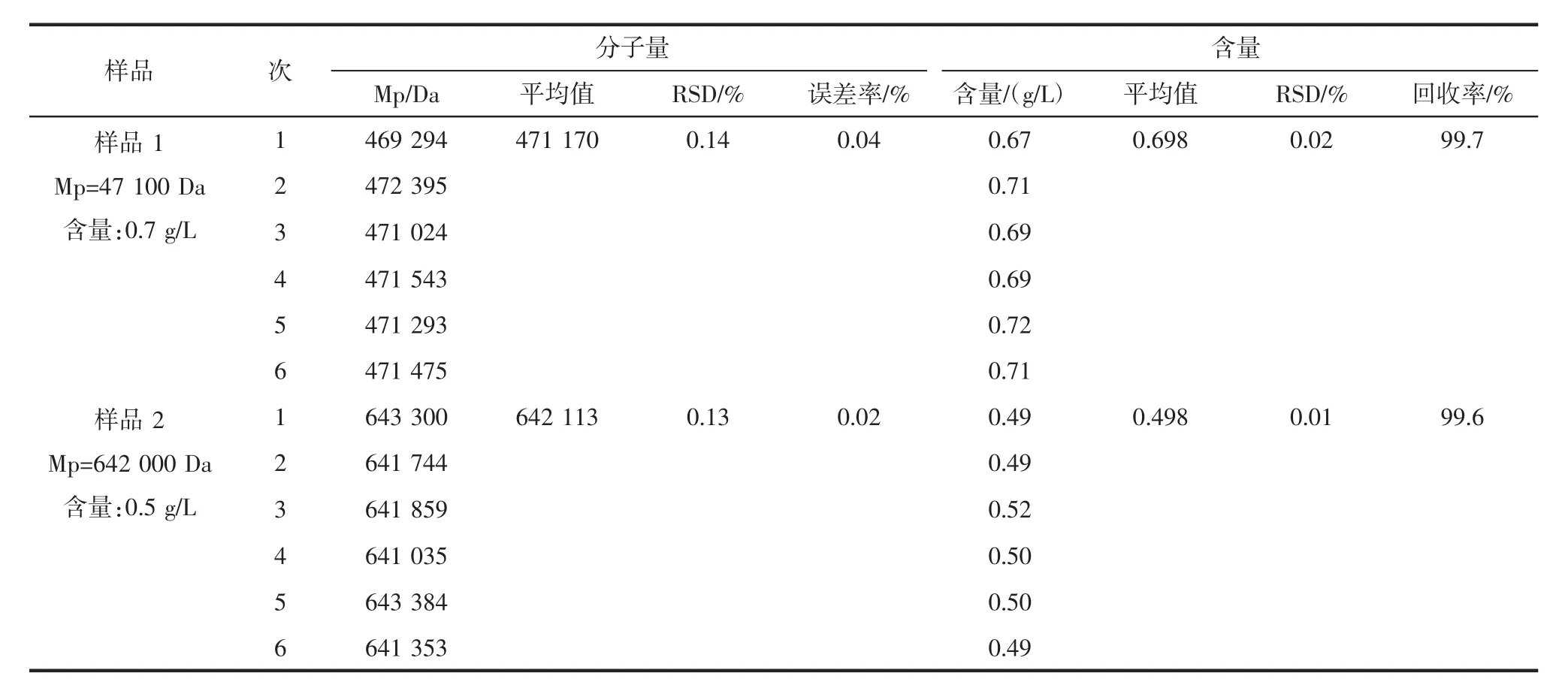
表4 目标物分子量和含量测试过程中相对标准偏差和回收率Table 4 The relative standard deviation and recovery rate of molecular weight and content
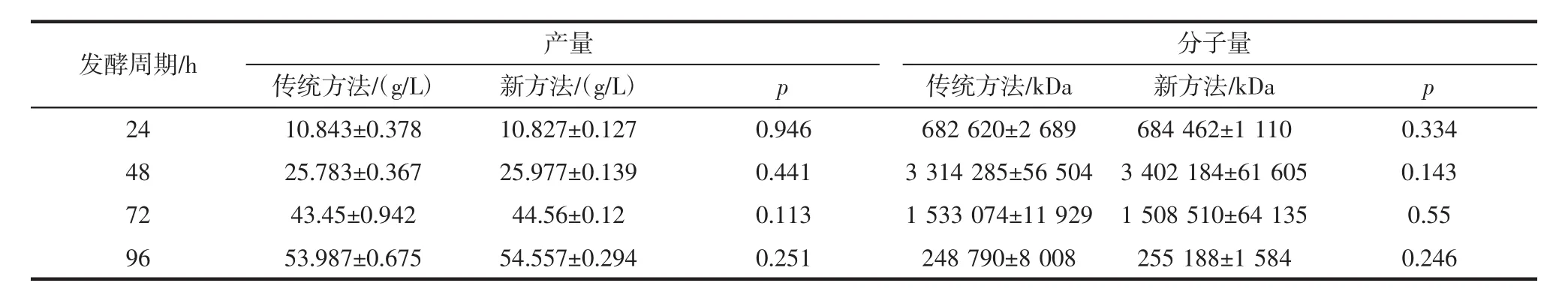
表5 出芽短梗霉CGMCC No.11602发酵生产普鲁兰多糖过程中发酵液中普鲁兰多糖含量及分子量Table 5 The pullulan content and molecular weight during the fermentation process of A.pullulans CGMCC No.11602
由表5可知:在发酵过程中4次测试中,新方法与传统方法测试分子量的数据之间p值在0.143~0.334之间;新方法与传统方法测试含量的数据之间p值在0.143~0.946之间,p值均大于0.05。因此,新方法和传统方法测定结果之间无显著性差异。
3 结论
普鲁兰多糖具有良好的生物相容性,具有特殊的聚合方式和线性连接结构。近年来,普鲁兰多糖在生物材料和生物医学领域得到了广泛的研究和应用,大大提高了普鲁兰多糖的附加值,但也对普鲁兰多糖的特性提出了更高的要求,特别是分子量和分子量分布。从理论上讲,获得不同分子量微生物多糖的方法包括有机溶剂沉淀分级、超滤、纳米过滤、凝胶层析过滤级发酵调控等手段。
在发酵过程中,特别是后期发酵过程中,普鲁兰多糖的含量和分子量是不断变化的。本文采用保护柱(UltrahyfrogelTM6×40 mm) 和凝胶柱(UltrahydrogelTMLinear 7.8×300 mm,Waters Chromatography,Inc),流动相 0.1mol/L NaNO3,流速 0.5 mL/min,柱温 30 ℃,示差折光检测器(Waters 2424),利用分子量在9.6 kDa~2 350 kDa范围内普鲁兰多糖标准品建立标准曲线,普鲁兰多糖流出体积(mL)与log Mp线性关系很好,相关系数R2为99.83%,在发酵过程中,将取样离心去除菌体获得的发酵液按照标准曲线测定的方法进行分子量测定,并与传统的普鲁兰多糖分子量测定方法相比较(先获得普鲁兰多糖粗品,然后再测定获得分子量),新方法与传统方法测试分子量的数据之间p值在0.143~0.334之间,新方法与传统方法测试含量的数据之间p值在0.143~0.946之间,p值均大于0.05。因此,新方法和传统方法测定结果之间无显著性差异。
新方法几乎实现了同步检测发酵液中普鲁兰多糖的含量和分子量(检测时间<1 h),与此同时,该方法具有较好的准确性、精密度、重复性和稳定性。因此,本研究可以通过调节发酵过程,指导规模化发酵生产不同分子量的普鲁兰多糖,降低生产成本,拓展了普鲁兰多糖的应用范围。
参考文献:
[1]Kim JH,Kim MR,Lee JH,et al.Production of high molecular weight pullulan by Aureobasidium pullulans using glucosamine[J].Biotechnol Lett,2000,22(12):987-990
[2]Badle SS,Jayaraman G,Ramachandran KB.Ratio of intracellular precursors concentration and their flux influences hyaluronic acid molecular weight in Streptococcus zooepidemicus and recombinant Lactococcus lactis[J].Bioresource Technol,2014,163(7):222-227
[3]Liu L,Du GC,Chen J,et al.Microbial production of low molecular weight hyaluronic acid by adding hydrogen peroxide and ascorbate in batch culture of Streptococcus zooepidemicus[J].Bioresource Technol,2009,100(1):362-368
[4]Yu X,Wang Y,Wei G,et al.Media optimization for elevated molecular weight and mass production of pigment-free pullulan[J].Carbohydr Polym,2012,89(3):928-935
[5]Burkus Z,Temelli F.Determination of the molecular weight of barley β-glucan using intrinsic viscosity measurements[J].Carbohydr Polym,2003,54(1):51-57
[6]Li YF,Shen HW,Lyons JW,et al.Size-exclusion chromatography of ultrahigh molecular weight methylcellulose ethers and hydroxypropyl methylcellulose ethers for reliable molecular weight distribution characterization[J].Carbohydr Polym,2015,13(8):290-296
[7]Wu SJ,Kim JM,Chao Z,et al.Estimation of pullulan by hydrolysis with pullulanase[J].Biotechnol Lett,2010,32(8):1143-1145
[8]Wang DH,Yu XL,Wei GH.Pullulan production and physiological characteristics of Aureobasidium pullulans under acid stress[J].Appl Microbiol Biotechnol,2013,97(18):8069-8077
[9]Sugumaran KR,Sindhu RV,Sukanya S,et al.Statistical studies on high molecular weight pullulan production in solid state fermentation using jack fruit seed[J].Carbohydr Polym,2013,98(1):854-867
[10]Seo HP,Son CW,Chung CH,et al.Production of high molecular weight pullulan by Aureobasidium pullulans HP-2001 with soybean pomace as a nitrogen source[J].Bioresource Technol,2004,95:293-299
