婴幼儿奶粉中阪崎肠杆菌双重荧光PCR快速检测方法的建立
2018-04-12黄建飞刘小青陈泽峰兰全学
黄建飞,刘小青,刘 斌,陈泽峰,兰全学,陈 晶
(深圳市计量质量检测研究院,食品检测所,广东深圳 518131)
阪崎肠杆菌(Enterobactersakazakii)是一种革兰氏阴性、依靠周生鞭毛运动、无芽孢兼性厌氧菌[1],曾用名为产黄色素阴沟肠杆菌(Enterobacteraloacae),1980年更名为阪崎肠杆菌[2],2008年Iversen等[3]将阪崎肠杆菌定义为肠杆菌的一个新属克罗诺杆菌属(Cronobactergen.nov)。该菌可导致新生婴儿脑膜炎、小肠结肠炎和菌血症。虽然发病率较低,但感染该菌的新生儿病死亡率高达40%~80%[4]。婴幼儿食品中由阪崎肠杆菌污染所引起的婴儿感染已经引起全球的广泛关注,阪崎肠杆菌具有较强的繁殖能力,婴儿配方食品中极微量的污染(<3 CFU/100 g)就可能大量繁殖[5]。因此需要建立婴幼儿食品中阪崎肠杆菌的快速、灵敏和特异的检测方法。
目前,食品中阪崎肠杆菌的检测方法主要采用食品安全国家标准GB4789.402010 《食品微生物学检验 阪崎肠杆菌检验》,该方法以生化鉴定为主,检测周期长,而且检测结果受检测人员的主观因素影响,特异性和灵敏度均不高。PCR技术为阪崎肠杆菌的检测提供了一种快速的方法,出入境检验检疫行业标准SN/T18702016《出口食品中食源性致病菌检测方法实时荧光PCR法》和SN/T 1632.3-2013《出口奶粉中阪崎肠肝菌(克罗诺杆菌属)检验方法 荧光PCR方法》规定了阪崎肠杆菌(克罗诺杆菌属)的单重荧光PCR检测方法。单重荧光PCR检测方法容易产生假阳性和假阴性问题,特异性多重荧光PCR检测体系可以大大降低假阳性和假阴性机率。孟双等[6]采用阪崎肠杆菌的16S rRNA与23S rRNA之间的内部转录间隔区(ITS)以及ompA基因作为检测的靶标,建立了阪崎肠杆菌高灵敏、高特异的实时荧光双重PCR快速检测体系。Hu等[7]采用cgcA和内参基因建立双重荧光PCR体系检测阪崎肠杆菌。王金凤等[8]以阪崎肠杆菌ompA为靶基因,以BHK21细胞的Nmi基因为扩增内标,建立阪崎肠杆菌实时荧光PCR快速检测体系。Kaclikova等[9]采用阪崎肠杆菌基因MMS、Mfla1165和内参pUC19 DNA建立三重荧光PCR检测体系。
目前国内外针对阪崎肠杆菌的荧光PCR检测方法常见的靶基因主要有16S rRNA[10]、ITS序列[11]、ompA基因[12]、MMS基因[13]、cgcA[7]和ropB[14]等。本研究采用双重荧光PCR体系,同时扩增阪崎肠杆菌的MMS和ompA基因,建立阪崎肠杆菌高灵敏、高特异性的实时双重荧光PCR快速检测体系。
1 材料与方法
1.1 材料与仪器
15株阪崎肠杆菌和24株非阪崎肠杆菌作为参照菌株见表1,所有菌株采用营养肉汤培养基37 ℃培养;实验中所用引物见表2,引物和探针序列 均由上海生工技术公司合成;培养基营养肉汤、缓冲蛋白胨水(BPW) 北京路桥技术有限责任公司;Premix ExTaq聚合酶 Takara公司;婴幼儿奶粉 市售。

表1 实验菌株及特异性结果Table 1 Bacterial species used and RTPCR analysis
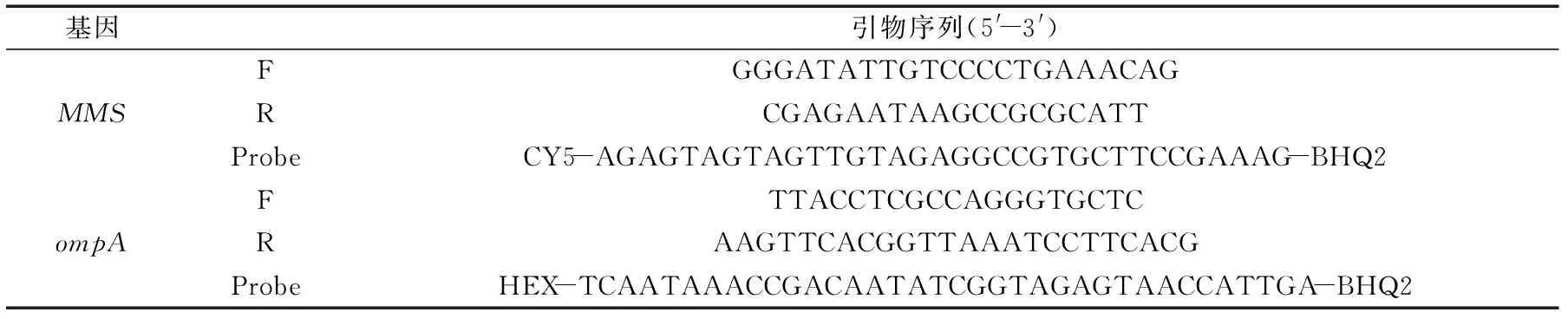
表2 实验中常用引物Table 2 Primers used in this study
Agilent Mx3005P荧光PCR仪 Agilent公司;330K离心机 德国Sigma公司;SHP250生化培养箱 上海精宏。
1.2 实验方法
1.2.1 基因组DNA提取 采用水煮法提取细菌全基因组DNA。取过夜培养的营养肉汤菌液1.5 mL于无菌EP管中,13000 r/min常温下离心30 s,弃去上清,将菌体悬浮于200 μL无菌水中,100 ℃水浴加热15 min,13000 r/min常温下离心30 s,取上清即可作为模板[15]。
1.2.2 双重荧光PCR体系的建立 对MMS和ompA引物浓度和探针浓度采用L16(44)正交优化(重复三次实验),各因素水平参照Hyeon等[16]和Ward等[17]多重荧光PCR反应体系并做出微小调整,各因素的四水平采用1、2、3和4进行编码,如表3,其中2×Premix Ex Taq 12.5 μL,DNA模板1 μL,加无菌水至25 μL。反应条件:95 ℃预变性5 min,95 ℃变性20 s,57 ℃退火30 s,72 ℃延伸20 s,共40个循环,扩增曲线Ct>35为阴性结果。
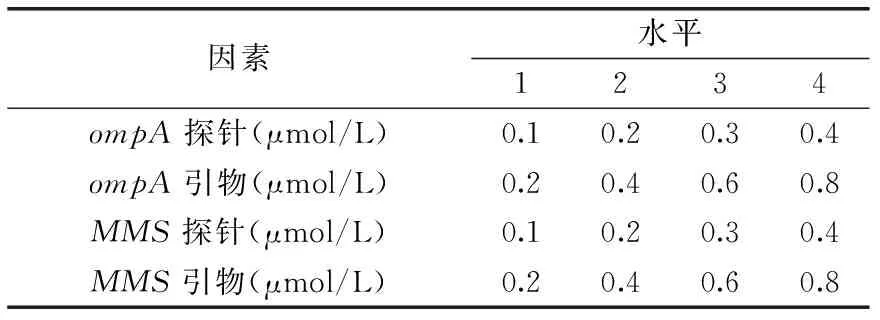
表3 正交实验因素和水平Table 3 Factors and levels of orthogonal tests
1.2.3 双重荧光PCR体系特异性分析 用水煮法提取39株菌的基因组DNA并以此为模板分别进行双重荧光PCR扩增,观察双重荧光PCR体系的扩增效果,分析双重荧光PCR体系检测阪崎肠杆菌的特异性。
1.2.4 灵敏度实验 将过夜培养的阪崎肠杆菌(ATCC 29544)培养液进行10倍梯度稀释(10-1~10-8),取每个稀释的梯度分别进行平板计数和煮沸法提取基因组DNA,采用双重荧光PCR体系进行阪崎肠杆菌纯培养物的灵敏度检测。
1.2.5 抗干扰能力 取1 mL不同浓度的阪崎肠杆菌菌液(10倍梯度稀释)分别和1 mL混合菌(24株非阪崎肠杆菌)等体积混合,直接煮沸法提取基因组DNA作为模板进行双重荧光PCR,观察该体系的抗干扰能力,同时对不同稀释梯度的阪崎肠杆菌菌液进行平板计数。
1.2.6 人工污染奶粉的检测 将过夜培养的阪崎肠杆菌进行10倍稀释,取1 mL 10-5~10-8四个梯度加入到100 g奶粉中,同时进行平板计数。将上述人工污染的100 g奶粉加入到900 mL BPW培养液中培养24 h进行增菌,取1 mL增菌液收集菌体后采用水煮法提取DNA作为模板进行双重荧光PCR检测。
2 结果与分析
2.1 双重荧光PCR体系建立
L16(44)正交实验结果见表4,从表中可以看出,各因素水平主要影响MMS扩增效果,扩增曲线最优条件为MMS引物浓度0.6 μmol/L,探针浓度0.2 μmol/L,ompA引物浓度0.2 μmol/L,探针浓度0.2 μmol/L,对应ompA和MMS曲线的Ct值分别为18.51和19.23。

表4 正交实验结果 Table 4 Results of orthogonal tests
2.2 双重荧光PCR反应体系特异性
根据双重荧光PCR体系对15株阪崎肠杆菌和24株非阪崎肠杆菌进行特异性分析,结果显示15株阪崎肠杆菌的ompA和MMS基因都出现典型的扩增曲线,24株非阪崎肠杆菌ompA和MMS基因都无扩增曲线,结果见表1,说明本研究建立的体系对阪崎肠杆菌检测具有较高的特异性。
2.3 灵敏度
双重荧光PCR体系灵敏度检测结果见图1,当阪崎肠杆菌浓度为4.3×103CFU/mL时,ompA和MMS扩增曲线的Ct<35,当阪崎肠杆菌浓度为4.3×102CFU/mL时ompA和MMS扩增曲线的Ct>35,结果为阴性,该双重荧光PCR体系下阪崎肠杆菌的灵敏度为4.3×103CFU/mL。
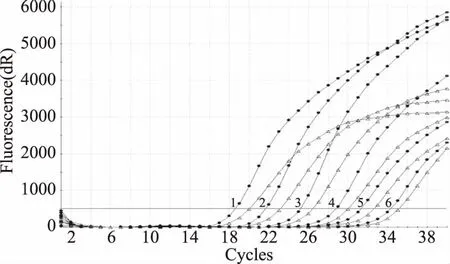
图1 双重荧光PCR检测阪崎肠杆菌的灵敏度Fig.1 Sensitivity of Enterobacter sakazakii by duplex realtime PCR注:1~6对应的阪崎肠杆菌浓度为4.3×108~4.3×103 CFU/mL,图中未标出Ct>35的阴性结果,●代表基因MMS扩增曲线,△代表基因ompA扩增曲线。
2.4 抗干扰能力
人工接种混合菌进行抗干扰实验结果见图2,结果表明在108CFU/mL其他混合菌存在的条件下,该PCR反应体系对阪崎肠杆菌的检出限为103CFU/mL,灵敏度未受显著影响。
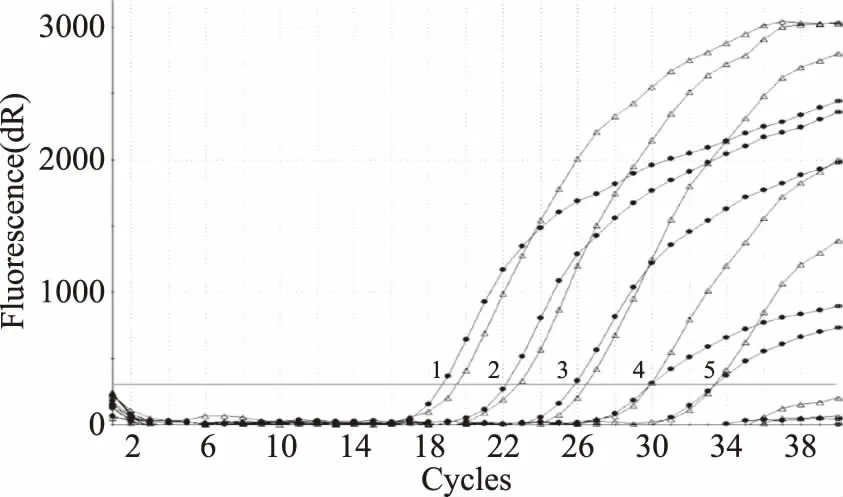
图2 双重荧光PCR检测阪崎肠杆菌的抗干扰能力Fig.2 Detection of Enterobacter sakazakii in the presence of mixed bacteriaby duplex realtime PCR注:在其他混合菌浓度为108 CFU/mL下,1~5对应的阪崎肠杆菌浓度为107~103 CFU/mL,●代表基因MMS扩增曲线,△代表基因ompA扩增曲线。
2.5 人工污染奶粉的检测
取100 g经验证后无阪崎肠杆菌污染的奶粉,溶于900 mL BPW中,每个瓶中分别加入1 mL含2×103、2×102、20和2 CFU/mL阪崎肠杆菌。结果见图3,由图3可知人工污染的奶粉都有典型的扩增曲线,能成功检测出阪崎肠杆菌,而阴性未接菌样品扩增后则没有扩增曲线,奶粉中阪崎肠杆菌的检出限为2 CFU/100 g。

图3 双重荧光PCR检测奶粉中阪崎肠杆菌的灵敏度Fig.3 Sensitivity of realtime PCR for Enterobacter sakazakii detection in infant formula注:1~4对应的奶粉中阪崎肠杆菌浓度为2×103~2 CFU/100 g,●代表基因MMS扩增曲线,△代表基因ompA扩增曲线。
3 讨论
外膜蛋白A是阪崎肠杆菌的主要毒力因子,在其致病过程中发挥了重要作用。Singamsetty等[18]人研究发现未携带外膜蛋白A的阪崎肠杆菌对宿主细胞的侵入力和黏附作用比正常菌株低7倍。Dong等[19]人通过ompA建立单重荧光PCR体系进行阪崎肠杆菌检测,该体系特异性强,灵敏度为2.8×102CFU/mL。人工污染奶粉经过24 h增菌检出限为1.1 CFU/mL。局部大分子合成操纵子序列是一段比较保守序列,可用于阪崎肠杆菌检测,Wang等[20]人通过MMS序列建立荧光PCR体系进行阪崎肠杆菌检测,该体系灵敏度为1.2×103CFU/mL。人工污染奶粉经过24 h增菌检出限为100CFU/100 g。本实验针对ompA和MMS基因建立的双重荧光PCR检测体系对阪崎肠杆菌纯培养物的检测灵敏度为4.3×103CFU/mL,抗干扰能力优异,在高浓度混合菌(108CFU/mL)的存在下阪崎肠杆菌的检出限仍为103CFU/mL,灵敏度未受显著影响。人工污染奶粉样品的模拟实验显示,增菌后双重荧光PCR反应体系可以检测阪崎肠杆菌浓度为2 CFU/100 g。
4 结论
本研究建立了食品中阪崎肠杆菌的双重荧光PCR体系,具有灵敏高、特异性和抗干扰能力强特点,经24 h增菌后能够检测出奶粉中较低含量的阪崎肠杆菌,为日常食品样品中阪崎肠杆菌快速检测提供有效分析手段。
[1]Healy B,Cooney S,Iversen S,et al. Cronobacter(Enternobactersakazakii):An opportunistic foodborne pathogen[J]. Foodborne Pathogens and Disease,2010,7(4):339350.
[2]Farmer R J J,Asbury M A,Hickman F W,et al.Enterobactersakazakii:A new species of“Enterobacteriaceae”isolated from clinical specimens[J]. International Journal of Systematic and Evolutionary Microbiology,1980,30(3):569584.
[3]Inversen C,Mullane N,Mccardell B,et al.Cronobactergen. nov.,a new genus to accommodate the biogroups ofEnterobactersakazakii,and proposal ofCronobactersakazakiigen. nov.,comb. nov.,Cronobactermalonaticussp. nov.,Cronobacterturicensissp. nov.,Cronobactermuytjensiisp. nov.,Cronobacterdublinensissp. nov.,Cronobactergenomospecies1,and of three subspecies,Cronobacterdublinensissubsp.dublinensissubsp. nov.,Cronobacterdublinensissubsp.lausannensissubsp. nov. andCronobacterdublinensissubsp.lactaridisubsp. nov[J]. International Journal of Systematic and Evolutionary Microbiology,2008,58(6):14421447.
[4]Bowen A,Braden C R. InvasiveEnterobactersakazakiidisease in infant[J].Emerging Infectious Diseases,2006,12(8):11851189.
[5]FAO,WHO. Jiont FAO/WHO workshop onEnternobactersakazakiiand other microorganisms in powdered infant formula[R]. Geneva:WHO,2004.
[6]孟双,李娟,王艳,等.阪崎肠杆菌实时荧光双重TaqMan PCR快速检测体系的建立[J].中国人兽共患病学报,2011,27(10):857860.
[7]Hu S F,Yu Y F,Li R,et al. Rapid detection ofCronobactersakazakiiby realtime PCR based on the cgcA gene and TaqMan probe with internal amplification control[J]. Canadin Journal of Microbiology,2016,62(3):191200.
[8]王金凤,王建昌,胡连霞,等. 基于内参系统的阪崎肠杆菌实时荧光定量PCR检测方法的建立[J]. 食品与机械,2016,32(6):6872.
[9]Kaclikova E,Oravcova K. Identification of thermotolerantCronobacterstrains using multiplex realtime polymerase chain reaction[J]. Journal of Food and Nutrition Research,2016,55(3):278281.
[10]Malorny B,Wagner M. Detection ofEnterobactersakazakiistrains by realtime PCR[J]. Journal of Food Protection,2005,68(8):16231627.
[11]Li Y,Cai X N,Zhang X,et al. Real time PCR using Taqman and SYBR Green for detection ofEnterobactersakazakiiin infant formula[J].Journal of Microbiological Methods,2006,65(1):2131.
[12]Kandhai M C,Heuvelink A E,Reij M W,et al. A study into the occurrence ofCronobacterspp. in the Netherlands between 2001 and 2005[J]. Food Control,2010,21(8):11271136.
[13]Seo K H,Brackett R E. Rapid,specific detection ofEnterobactersakazakiiin infant formula using a real time PCR assay[J]. Journal of Food Protection,2005,68(1):5963.
[14]Li Y H,Chen Q M,Jiang H,et al. Novel development of a qPCR assay based in the ropB gene for rapid detection of Cronobacter spp[J].Current Microbiology,2016,72(4):436443.
[15]黎明,阮佳,李永新. 食源性阪崎肠杆菌的双重PCR检测方法的研究[J].中国卫生检验杂志,2013,23(6):14731476.
[16]Hyeon J Y,Park C,Choi I S,et al. Development of multiplex realtime PCR with internal amplification control for simultaneous detection ofSalmonellaandCronobacterin powdered infant formula[J].International Journal of Food Microbiology,2010,144(1):177181.
[17]Ward L N,Bej A K. Detection ofVibrioparahaemolyticus in shellfish by use of multiplexed realtime PCR with TaqMan fluorescent probes[J].Applied and Environment Microbiology,2006,72(3):20312042
[18]Singamsetty V K,Wang Y,Shimada H,et al. Outer membrane protein a expression inEnterobactersakazakiiis required to induce microtubule condensation in human brain microvascular endothelial cells for invasion[J]. Microbial Pathogenesis,2008,45(3):181191.
[19]Dong X H,Wu Q P,Wu K,et al. Real time PCR targeting ompA gene for detection ofCronobacterspp in powdered infant formula[J].Food Science and Biotechnology,2013,22(2):309313.
[20]Wang X,Zhu C Q,Xu X L,et al. Real time PCR with internal amplication control for the detection ofCronobacterspp.(Enterobactersakazakii)in food samples[J].Food Control,2012,25(1):144149.
欢迎订阅《食品工业科技》
