高效液相色谱法检测乳中β-内酰胺酶抑制剂他唑巴坦
2018-04-12于国萍范美婧郭佩佩董良伟
于国萍,范美婧,郭佩佩,陈 媛,刘 鹏,董良伟
(东北农业大学食品学院,黑龙江哈尔滨 150030)
他唑巴坦(Tazobactam)属半合成青霉烷砜类衍生物,是以舒巴坦为原料化学合成的,抑酶作用更强,是一种应用广泛的β内酰胺酶抑制剂[12],具有广谱的β内酰胺酶抑制作用[3]。
抗生素常用来治疗牛乳房炎,避免不了残留在牛乳中,而不法商贩通过添加β内酰胺酶进行掩盖[45];随着β内酰胺酶检测方法的出现,有些人利用β内酰胺酶抑制剂不可逆地与β内酰胺酶结合的性质,在乳中添加β内酰胺酶抑制剂,使该酶失去活性,导致含有β内酰胺酶的奶不能被检测出来[68];所谓不可逆竞争性抑制剂,是因为它们进行正常的水解反应时,产生一些中间产物导致的。有研究表明,他唑巴坦会导致一些过敏反应,例如皮疹、药热等,严重危害消费者身体健康[910]。
国内外关于β内酰胺酶抑制剂的检测方法多集中于生物样品[1113]、临床医疗[1416]等方面,而关于β内酰胺酶抑制剂的检测方法又主要集中在分光光度法[17]、微生物法[18]、毛细管电泳法[19]、高效液相色谱质谱[9]、高效液相色谱法[20]等。在乳制品中关于β内酰胺酶抑制剂的检测还没有现行的标准发布,因此建立具有推广性的检测方法已经迫在眉睫。
本文利用高效液相色谱法建立了乳中β内酰胺酶抑制剂他唑巴坦的检测方法,该方法实用性及推广性较强、操作简便,这对于保证乳制品的质量,维护消费者健康权益具有十分重要的现实意义和指导作用。
1 材料与方法
1.1 材料与仪器
他唑巴坦标准品 美国sigma公司;乙腈、甲醇、正己烷 均为色谱纯,瑞典欧森巴克化学公司;四丁基氢氧化铵、磷酸氢二钾 天津市天力化学试剂有限公司;超纯水 娃哈哈纯净水;原料乳 哈尔滨周边奶牛场。
Hypersil ODS2 C18色谱柱 美国Thermo Fisher公司;Waters 2487高效液相色谱仪、Waters 2487紫外吸收检测器 美国Waters公司;FE28型pH计、AL204电子天平 梅特勒仪器有限公司;MTN-2800D氮吹浓缩装置 天津奥特赛恩斯仪器有限公司;LD42A型台式低速离心机 北京众益中和生物技术有限公司。
1.2 实验方法
1.2.1 液相色谱条件 色谱柱:Hypersil ODS2 C18(4.6 mm×250 mm,5 μm);流动相:流动相A:乙腈;流动相B:取5 mL 5 mmol/L的四丁基氢氧化铵与995 mL 0.03 mol/L磷酸二氢钾混合,调整pH为5;A∶B为(10∶90);检测波长:213 nm;流速:1 mL/min;进样量:10 μL;
1.2.2 样品前处理方法 用移液器取1 mL牛奶与4 mL乙腈于10 mL离心管中进行混合,60 s振荡混匀后,4000 r/min离心15 min,取2 mL上清液与3 mL正己烷于另一10 mL离心管中进行混合,60 s振荡混匀后,4000 r/min离心8 min,弃去上面的正己烷层,剩余液体用40 ℃氮气吹干后定容至1 mL,过0.45 μm有机系微孔滤膜后,按照上述最佳色谱条件进行上机实验进行分析测定。
1.2.3 加标样品前处理方法 分别取5、50、100 μL 浓度为1 mg/mL的他唑巴坦标准溶液加入到1 mL牛奶样品中,然后进行样品前处理(同1.2.2)。
1.2.4 色谱条件的优化 依据前期实验结果,确定乙腈为沉淀蛋白溶剂,正己烷为脱脂溶剂。在此基础上进行流动相的优选。
1.2.4.1 流动相选择及配比的优化 流动相的选择,对比了甲醇水(10∶90)和乙腈水(10∶90)两种不同流动相体系在同等条件下对他唑巴坦分离的效果,通过上机实验选择合适的有机相;根据所选择的有机相,优化配比,分别选择有机相与水的比例为10∶90、20∶80、30∶70、40∶60、50∶50,上机实验进行测定。
1.2.4.2 缓冲溶液的选择及浓度的优化 在色谱分析中,缓冲溶液的添加,可以起到防止样品解离、峰型拖尾、增加方法的可靠性等作用。缓冲溶液的种类较多,比如酸类:醋酸,磷酸等缓冲液;碱类:三乙胺,二乙胺;盐类的:磷酸二氢钾,酸酸氢二钾等[2123]。本实验在水相中添加浓度为0、5、10、15、20 mmol/L 四丁基氢氧化铵和浓度为0、0.015、0.03、0.06、0.12 mol/L的磷酸氢二钾两种缓冲溶液,考察了缓冲溶液及浓度对他唑巴坦分离效果的影响。
1.2.4.3 缓冲溶液pH的优化 缓冲溶液的pH会影响样品的分析效果,若pH的选择不恰当会导致分裂峰、不对称峰、肩峰或宽峰等;本实验利用0.05 moL/L的磷酸调节pH为3、4、5、6、7,考察他唑巴坦保留时间及分离效果受缓冲溶液pH的影响。
1.2.5 标准曲线与检测限 本实验采用流动相稀释标准溶液作标准曲线,分别用流动相逐步稀释浓度为1 mg/mL的他唑巴坦标准溶液,将其变成浓度为5、10、50、100、150、200 (g/mL标准溶液后,按上述最佳色谱条件上机实验进行测定。
1.2.6 回收率与精密度 实验采用空白加标的方法进行回收率和精密度测定。在空白牛奶样品中分别添加浓度为5、50、100 μg/mL的他唑巴坦标准溶液后,在最佳色谱条件下进行上机加标回收实验,并依据公式:回收率(%)=样品测定值/标准加入量×100进行计算,每个浓度平行测定6次。
1.2.7 实际样品的测定 本实验通过采用β内酰胺酶商品化试剂盒,测定抑制β内酰胺酶的最低的他唑巴坦的添加量。
1.3 数据处理
本论文采用Origin绘图工具,SPSS Statistics 19.0数据统计分析。其中单因素方差分析(ANOVA)中采用Duncan检验,图表中的字母表示差异显著性分析的结果。
2 结果与分析
2.1 色谱条件的优化
2.1.1 流动相选择及配比的优化 首先对比了甲醇水(10∶90)和乙腈水(10∶90)两种不同流动相体系在同等条件下对他唑巴坦分离的效果,结果如图1所示,以甲醇水体系(图1a)为流动相时,色谱峰峰形较差,他唑巴坦得不到理想的分离效果,而用乙腈代替甲醇(图1b)作为流动相后,则峰形较好,改善了分离效果。因此,本实验选择流动相为乙腈水体系,并进一步考察乙腈与水不同配比时,对待测物质分离效果的影响,实验结果如图2所示。

图1 两种流动相的色谱图Fig.1 The chromatogram of two mobile phase注:a、b分别为甲醇水、乙腈水为流动相的色谱图。

图2 不同乙腈含量的色谱图Fig.2 The chromatogram of different acetonitrile content注:a~e表示乙腈与水的比例分别为10∶90、20∶80、30∶70、40∶60、50∶50。
由图2可知,乙腈含量升高,可提高检测的灵敏度,但随着乙腈含量升高,保留时间减小,使他唑巴坦的分离效果较差,而乙腈含量降低,可增大他唑巴坦的保留时间,并得到很好的分离结果。通过前期的预实验发现,当乙腈浓度低于10%时,分离效果没有达到最佳状态,他唑巴坦和杂质没有完全分开,这可能是二者比例的改变,导致流动相极性的改变,不利于他唑巴坦和杂质的分开。因此选择乙腈∶水=10∶90比例时较为适宜。
2.1.2 缓冲溶液的选择及浓度的优化 由图3可知,他唑巴坦的保留时间随着添加四丁基氢氧化铵溶液浓度的增加而延长,虽然增加的效果不显著,但色谱分离效果明显改善,表明加入四丁基氢氧化铵后能够增加其在色谱柱上的保留能力,所以在保证他唑巴坦与相邻组分有效分离的条件下,本实验采用添加四丁基氢氧化铵溶液的浓度为5 mmol/L。

图3 优化四丁基氢氧化铵浓度的色谱图Fig.3 Optimize the tetrabutylammonium hydroxide of concentration of potassium dihydrogen phosphate注:a~e表示四丁基氢氧化铵的浓度分别为0、5、10、15、20 mmol/L。
添加磷酸二氢钾对他唑巴坦保留时间的影响见图4,可以看出,随着添加磷酸二氢钾溶液浓度的增大,色谱图中的保留时间也增大,但考虑色谱柱对有机盐浓度的限制,应选择盐浓度相对较低的缓冲溶液添加到流动相中,但是必须保证能够有效分离。因此,本实验确定添加磷酸二氢钾的浓度为0.03 mol/L。
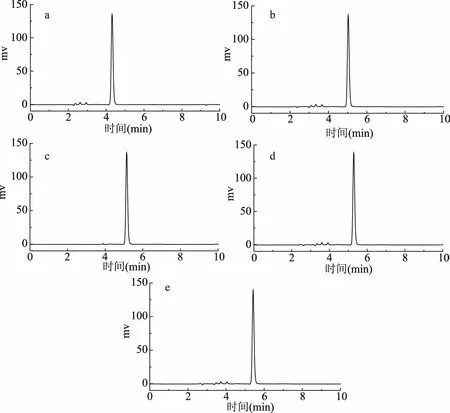
图4 优化磷酸二氢钾浓度的色谱图Fig.4 Optimize the chromatogram of concentration of potassium dihydrogen phosphate注:a~b表示磷酸二氢钾的浓度分别为0、0.0125、0.03、0.06、0.12 mol/L。
2.1.3 缓冲溶液pH的优化 实验结果如表1所示,他唑巴坦的保留时间随着缓冲溶液pH的减小而逐渐增加,且pH越低,分离效果越好。当pH为5时,色谱峰峰形窄且对称,无拖尾现象,分离效果也好。因此,本实验选择pH为5。

表1 pH与保留时间的关系Table 1 The relationship between pH and retention time
2.2 方法学的验证
2.2.1 系统适用性 在上述最佳色谱条件下,他唑巴坦标准溶液和原料乳中添加他唑巴坦溶液的色谱图,分别如图5和图6所示。

图5 最佳色谱条件下他唑巴坦标准溶液的色谱图Fig.5 The chromatogram of tazobactam standard solution under the best chromatographic condition

图6 最佳色谱条件下原料乳中添加他唑巴坦的色谱图Fig.6 The chromatogram of tazobactam spiked in milk under the best chromatographic condition
从图5和图6可以看出,最佳色谱条件下,他唑巴坦标准溶液的保留时间为5.287 min,原料乳中添加他唑巴坦的保留时间为5.284 min,他唑巴坦标准溶液和样品中他唑巴坦峰的主峰保留时间基本一致,且在原料乳中,他唑巴坦与杂质得到很好的分离效果,表明最佳色谱条件,即色谱柱为Hypersil ODS2 C18(4.6 mm×250 mm,5 μm),流动相A为乙腈;流动相B为取5 mL 5 mmol/L的四丁基氢氧化铵与995 mL 0.03 mol/L磷酸二氢钾混合,调整pH为 5;A∶B为(10∶90);检测波长为213 nm;流速为1 mL/min;进样量为10 μL;此条件适用于乳中他唑巴坦的检测。
2.2.2 标准曲线与检测限 本实验是采用流动相稀释标准溶液作标准曲线,结果如图7所示,可以看出,标准溶液回归方程为:y=17429x4330,相关系数为0.9993,表明在0.5~200 g/mL的浓度范围内他唑巴坦与其峰面积呈正相关,线性关系良好;按照最小检出限的定义,在信噪比3∶1时,确定他唑巴坦的最小检出限为0.07 g/mL,达到日常分析要求。
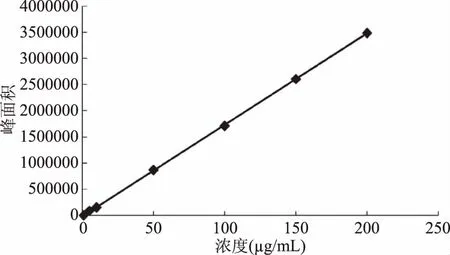
图7 他唑巴坦的标准曲线Fig.7 The standard curve of tazobactam
2.2.3 回收率与精密度 结果如表2所示,该方法的回收率在88.40%~94.18%之间,满足加标回收实验要求;而相对标准偏差小于等于1.57%,表明本法的精密度良好。

表2 乳中他唑巴坦的加标回收率及精密度(n=6)Table 2 Recoveries and relative standard deviations of tazobactam spiked in milk(n=6)
2.2.4 实际样品的测定 本实验室通过利用β内酰胺酶商品化试剂盒,确定了抑制β内酰胺酶所需的最低添加量为15 μg/mL,落在本研究所建立的HPLC方法的检测范围内。按照此法对目前市场上的原料乳进行测定,并对样品添加15 μg/mL他唑巴坦标准溶液进行对比分析,结果如表3所示。从表中可以看出,样品均未检出β内酰胺酶抑制剂他唑巴坦,15 μg/mL他唑巴坦加标回收率的平均值为89.96%±0.48%。

表3 用当前的方法分析不同牛奶样品中他唑巴坦的含量Table 3 Analysis of tazobactam in different milk samples using the proposed method
3 结论
本实验建立并验证了测定乳中β内酰胺酶抑制剂他唑巴坦的高效液相色谱的检测方法。样品采用乙腈作为沉淀蛋白溶剂,正己烷作为脱脂溶剂,确定了最佳色谱条件。结果表明他唑巴坦在0.5~200 μg/mL的浓度范围内具有良好的线性关系,最小检出限为0.07 μg/mL,采用空白基质匹配标准溶液的方法进行标准校正,显示他唑巴坦的平均回收率在88.40%~94.18%之间,相对标准偏差小于1.57%。表明该方法适用于乳中β内酰胺酶抑制剂他唑巴坦的检测,测定结果准确可靠并具有一定的推广价值,还可为监管部门管理乳制品市场提供有力依据。
[1]蔡文辉,张文莉,付英梅,等.β内酰胺酶抑制剂研究进展[J]. 中国抗生素杂志,2013,38(11):805809.
[2]王春,魏伟.β内酰胺酶及其抑制剂研究进展[J]. 安徽医学,2013,34(10):14291441.
[3]张润平.β内酰胺酶抑制剂他唑巴坦的研究[J]. 药学研究,2001,20(6):2223.
[4]Li N,Feng F,Yang B,et al. Simultaneous determination ofβlactam antibiotics andβlactamase inhibitors in bovine milk by ultra performance liquid chromatographytandem mass spectrometry[J]. Journal of Chromatography B,2014s 945946:110114.
[5]王乃健,孙树杰,王丽娇,等. 原料乳质量安全关键控制因素分析[J]. 中国食物与营养,2014,20(2):1922.
[6]张立,李娜思,冯峰,等. 超高压液相色谱串联质谱法测定牛奶中的β内酰胺类抗生素及其酶抑制剂[J].食品安全质量检测学报,2013(6):18211827.
[7]秦婧,张莉,舒静,等. 陕西省生鲜乳中β内酰胺酶的检测与结果分析[J]. 中国乳品工业,2016,44(9):6164.
[8]施春煜. 牛奶中β内酰胺酶半定量快速检测试纸的研究[J]. 农产品加工月刊,2016(12):1113.
[9]马晓斐,张敬轩,李挥,等. 超高效液相色谱串联质谱法同时测定液态奶中克拉维酸和舒巴坦[J]. 食品科学,2013,34(16):257260.
[10]李勇湧,黄文祥,朱卫民.β内酰胺酶抑制剂抑酶动力学研究[J]. 重庆医科大学学报,2010,35(7):10401042.
[11]Peyrin E,Guillaume Y,Guinchard C. Highperformance liquid chromatographic determination of tazobactam by precolumn derivatization.[J]. Journal of Chromatography B:Biomedical Sciences and Applications,1995,672(1):160164.
[12]Augey V,Grosse P Y,Albert G,et al. Highperformance liquid chromatographic determination of tazobactam and piperacillin in human plasma and urine[J]. Journal of Chromatography B Biomedical Applications,1996,682(1):125136.
[13]Vni P R K,Sharmila N,Narayana K J P,et al. Simultaneous determination of piperacillin and tazobactam in pharmaceutical formulations by RPHPLC method[J]. Journal of Pharmacy Research,2013,7(1):127131.
[14]Marselos S C,Archontaki H A. Development and optimization of a reversedphase highperformance liquid chromatographic method for the determination of piperacillin and tazobactam in tazocin injectable powder[J]. Journal of Pharmaceutical & Biomedical Analysis,2002,29(5):787793.
[15]Di G G,Ferrannini M,Testore G P,et al. High performance liquid chromatographic determination of plasma free and total tazobactam and piperacillin[J]. Journal of Chromatography B,2009,877(12):8688.
[16]任立玲,王源园,孙鲁宁,等. LCMS/MS法测定人尿液中他唑巴坦钠浓度及其尿药排泄动力学研究[J].中国药房,2016,27(32):45014504.
[17]全红,白小红,杜江. 分光光度法测定注射用头孢哌酮钠/舒巴坦钠药物含量[J]. 山西医科大学学报,2003,34(6):573574.
[18]王立平,蔡雪凤,侯翠艳. 微生物抑制法检测乳中舒巴坦含量的研究[J]. 食品科技,2010(6):304306.
[19]姜文清,马捷,李金娥. 胶束电动毛细管色谱法测定含β内酰胺酶抑制剂的青霉素类药物[J]. 中国医院药学杂志,2003,23(4):199200.
[20]Shrestha B,Bhuyan N R,Sinha B N. Simultaneous determination of ceftriaxone and tazobactam in injectables by UHPLC method[J]. Pharmaceutical Methods,2013,4(2):4651.
[21]昝川南,叶梁银. 浅析高效液相色谱分析法在各领域的应用及发展前景[J].化学工程与备,2013(2):6060.
[22]袁苇航. 色谱分析法在食品添加剂检测中的应用研究[J]. 食品安全导刊,2015(18):9192.
[23]于世林. 高效液相色谱方法及应用[J]. 核化学与放射化学,2009(3):163163.
