奥沙利铂联合替吉奥对晚期结肠癌患者血清相关标志物影响
2018-04-12王子红鲍云华
王子红, 鲍云华
1.北京市石景山医院 肿瘤科,北京 100043;2.解放军第三〇七医院 放疗科,北京 100071
结肠癌是临床常见的消化道恶性肿瘤,多发于直肠与乙状结肠交接位置,发病率和病死率均较高,全球结肠癌患者发病率在恶性肿瘤中排名第四,病死率排名第二[1-2]。随着生活环境和饮食结构的变化,我国结肠癌患者数量逐年升高[3],同时,由于结肠癌早期症状不典型,容易被误诊为消化不良、痔疮或便秘,导致延误治疗。晚期结肠癌患者由于发生转移而丧失手术机会,多采用化疗为主的治疗方案,控制肿瘤生长速度,延长患者生存时间[4]。《美国国立综合癌症网络结直肠癌筛查指南》中建议,晚期结肠癌患者服用奥沙利铂、氟尿嘧啶类化合物及伊立替康等进行姑息治疗,取得一定临床效果,但诱导产生的不良反应多,影响预后效果,患者满意度低[5]。替吉奥是氟尿嘧啶衍生物,血药浓度高,给药方便,治疗晚期结肠癌疗效确切[6]。本研究通过探讨奥沙利铂联合替吉奥治疗晚期结肠癌患者的临床应用价值及其对血清相关标志物的影响,旨在为临床用药提供理论依据,提高患者生存质量。现报道如下。
1 资料与方法
1.1一般资料选择自2012年7月至2016年7月收治的晚期结肠癌患者120例,患者诊断标准参考《结直肠癌诊疗规范(2015年版)》[7]中关于结肠癌的相关规定,且均经组织病理学确诊。按照随机数表法,将患者分为A组(n=60)与B组(n=60)。A组患者男性37例,女性23例;年龄42~68岁,平均(53.16±4.23)岁;病程1~3年,平均(2.02±0.53)年;病理类型:腺癌28例,黏液腺癌32例;病理分期:Ⅲb期35例,Ⅳ期25例。B组患者男性36例,女性24例;年龄42~67岁,平均(53.08±4.15)岁;病程1~3年,平均(2.06±0.42)年;病理类型:腺癌29例,黏液腺癌31例;病理分期:Ⅲb期34例,Ⅳ期26例。两组患者性别、年龄、病程、病理类型及分期比较,差异均无统计学意义(P>0.05)。本研究经医院伦理委员会批准,患者均签署知情同意。
1.2纳入与排除标准纳入标准:(1)功能状态评分≥70分;(2)预计生存期>6个月;(3)心电图检查无异常;(4)临床资料完整,且临床依从性高。排除标准:(1)肝肾功能异常;(2)存在其他原发性肿瘤;(3)凝血功能异常;(4)处于特殊时期患者,如妊娠期或哺乳期;(5)对研究中使用药物过敏者。
1.3治疗方法A组患者采用奥沙利铂注射液(生产厂家:江苏恒瑞医药股份有限公司,批准文号:国药准字H20050962,生产批号:110619,规格为100 ml:0.1 g)进行治疗。按照130 mg/m2剂量加入500 ml 50 g/L的葡萄糖注射液中静脉滴注,滴注时间为3 h。B组患者在A组基础上联合应用替吉奥胶囊(生产厂家:江苏恒瑞医药股份有限公司,批准文号:国药准字H20113281,生产批号:11101096,规格:25 mg)进行治疗,体表面积>1.50 m2,每次60 mg;体表面积1.25~1.50 m2,每次50 mg;体表面积<1.25 m2,每次40 mg,2次/d,连续治疗14 d后,停药7 d。两组患者连续治疗2个周期,每个周期21 d。
1.4观察指标分别于治疗前后抽取患者肘静脉血5 ml,置于未涂有肝素钠的采血管中,室温下静置20 min,以3 500 r/min的速度离心10 min,离心半径为3 cm,分离上清液血清。采用酶联免疫吸附测定法检测血清中癌胚抗原(carcinoembryonic antigen,CEA)、甲胎蛋白(α-fetoprotein,AFP)、糖类抗原19-9(carbohydrate antigen19-9,CA19-9)、细胞质胸苷激酶1(thymidine kinase 1,TK1)及免疫因子[白细胞介素-2(interleukin-2,IL-2)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及干扰素-γ(interferon-γ,INF-γ)]水平,试剂盒购自武汉博士德生物工程有限公司,严格按照试剂盒说明书进行操作。治疗结束后,比较两组患者的客观缓解率(objective remission rate,ORR),分析两组患者疾病进展时间(time to progression,TTP)、1年存活率及不良反应发生率。
1.5评价标准临床疗效评价参考世界卫生组织规定的评定标准[8],分为完全缓解(complete response,CR)、部分缓解(partial remission,PR)、稳定(stable disease,SD)及疾病进展(progression disease,PD)。CR:肿瘤消失,维持时间>4周;PR:肿瘤面积缩小≥50%,维持时间>4周;SD:肿瘤面积缩小<50%,维持时间>4周;PD:肿瘤面积增大>25%。
ORR=(PR+CR)患者例数/总例数×100%

2 结果
2.1两组患者治疗后ORR比较B组患者ORR为78.3%(47/60),明显高于A组的53.3%(32/60),差异有统计学意义(P<0.05),见表1。

表1 两组患者治疗后ORR比较/例(百分率/%)
2.2两组患者治疗前后血清CEA、AFP、CA19-9及TK1水平比较两组患者治疗前血清CEA、AFP、CA19-9及TK1水平比较,差异无统计学意义(P>0.05)。两组患者治疗后,血清CEA、AFP、CA19-9及TK1水平均较本组治疗前明显降低,且B组患者治疗后CEA、AFP、CA19-9及TK1水平均显著低于A组,差异均有统计学意义(P<0.05),见表2。

表2 两组患者治疗前后血清CEA、AFP、CA19-9及TK1水平比较
注:与治疗前比较,①P<0.05
2.3两组患者治疗前后血清免疫因子水平比较治疗前,两组患者血清免疫因子IL-2、TNF-α、INF-γ水平比较,差异无统计学意义(P>0.05)。与治疗前比较,两组患者治疗后血清IL-2、TNF-α及INF-γ水平明显升高,B组患者治疗后血清免疫因子水平显著高于A组,差异均有统计学意义(P<0.05),见表3。
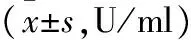
表3 两组患者治疗前后血清免疫因子水平比较
注:与治疗前比较,①P<0.05
2.4两组患者TTP、1年存活率及不良反应发生率比较A组患者TTP、1年存活率及不良反应发生率分别为(6.25±0.54)个月、43.3%(26/60)、46.7%(28/60);B组患者TTP、1年存活率及不良反应发生率分别为(6.17±0.46)个月、40.0%(24/60)、50.0%(30/60),两组间比较,差异均无统计学意义(P>0.05)。
3 结果
结肠癌与环境污染、生活习惯、遗传等因素密切相关,结肠癌患者多伴随发生肠梗阻、消化道出血等,严重影响患者的健康,临床上多采用手术切除病灶治疗结肠癌,晚期结肠癌患者肿瘤细胞转移,手术治疗效果并不明显[9-11]。原发肿瘤能够抑制继发肿瘤的生长,切除原发肿瘤后,对其抑制作用消失,导致小病灶继续发展,病情恶化,采用药物治疗可清除肿瘤病灶,提高患者存活率[3]。奥沙利铂由铂与反式-l-1,2-环己二胺、草酸的络合产生,其中,1,2-二氨环已烷基团取代顺铂的氨基[12-13]。奥沙利铂为敏感性化疗药物,疗效显著,毒性小,且与顺铂、卡铂无交叉耐药性,药学特性得到明显改善[13]。奥沙利铂作为第3代铂类抗癌药物,具有体外细胞毒性与体内抗肿瘤活性,同时,是临床上常用治疗结肠癌的药物,扩大抗癌谱,不仅适用于大肠癌、卵巢癌,且适用于淋巴癌、胃癌及非小细胞肺癌[13-15]。替吉奥最初由日本批准应用于胃癌治疗,随后被广泛应用于结直肠癌、非小细胞癌及头颈癌,口服替吉奥能够维持稳定的血药浓度,抗癌作用强,给药方便,患者依从性高[5,13]。替吉奥胶囊是新型的氟尿嘧啶类衍生物抗代谢类化疗药,包括替加氟、吉美嘧啶及奥替拉西钾[16]。
两组患者临床疗效显示,B组患者ORR明显高于A组,与孙翠玲等[6]研究结果一致,说明奥沙利铂联合替吉奥治疗晚期结肠癌效果显著。血清标志物可反映肿瘤的存在,可用于判断肿瘤的性质,因此,可通过调节血清标志物水平来影响肿瘤发展。CEA是由大肠癌组织产生的糖蛋白,广泛存在于消化系统癌,诱发患者免疫反应,正常人血清中仅存在少量CEA,同时,CEA是一个广谱性肿瘤标志物,对于多种肿瘤的诊断及预后判定具有重要作用[17]。AFP原发于肝癌患者,对于肝癌的阳性诊断率接近90%,还可应用于其他肿瘤诊断[17]。CA19-9是最具诊断价值的肿瘤相关抗原,存在于正常结肠上皮细胞,但血清中含量极低[17]。TK1影响肿瘤细胞增殖,从而反映肿瘤发展程度,对其进行针对性治疗也可用于治疗晚期结肠癌[18]。本研究结果显示,两组患者治疗后血清CEA、AFP、CA19-9及TK1水平较治疗前明显降低,而B组患者治疗后血清CEA、AFP、CA19-9及TK1显著低于A组,提示奥沙利铂联合替吉奥可明显降低血清中血清标志物水平,从而发挥治疗结肠癌作用。同时,晚期肿瘤患者免疫功能受到抑制,主要由患者体内的IL-2、TNF-α及INF-γ进行调节,在化疗过程中,晚期结肠癌患者的细胞免疫功能受损[3]。本研究结果显示,两组患者治疗后血清IL-2、TNF-α及INF-γ水平明显高于治疗前,而B组患者治疗后血清免疫因子水平显著高于A组,表明两种治理方案均可改善患者免疫功能,而联合用药提高免疫功能的作用更显著。奥沙利铂通过产生烷化结合物与DNA链上形成交联键损伤DNA,抑制DNA的合成与复制过程,加速肿瘤细胞凋亡[5]。替吉奥胶囊中的替加氟是氟尿嘧啶的前体药物,口服生物利用度高,经代谢后变成氟尿嘧啶,从而发挥抗肿瘤作用,同时,其毒性仅为氟尿嘧啶的1/7至1/4,代谢产生的γ-羟丁酸、γ-丁内酯具有抗血管作用[12,16]。吉美嘧啶分布在肝中,是氟尿嘧啶降解酶抑制剂,可延长氟尿嘧啶的作用时间[16]。奥替拉西钾抑制肠道黏膜细胞的乳酸核糖转移酶活性,阻滞氟尿嘧啶磷酸化进程,从而改善患者胃肠道不适症状[17]。本研究两组患者TTP、1年存活率及不良反应发生率比较,差异无统计学意义(P>0.05),这可能与选择患者的范围及个体差异有关,具体原因尚未明确,需要进一步的研究。
综上所述,奥沙利铂联合替吉奥治疗晚期结肠癌的疗效显著,降低血清相关标志物,提高免疫力,临床安全性高。
参考文献:
[1]熊锐华,任庆,田秀荣,等.替吉奥联合奥沙利铂治疗晚期结肠癌的临床研究[J].中国医药导刊,2012,14(7):1208-1210.
[2]付鸿江.经腹腔镜行结肠肿瘤手术治疗的最新进展[J].医学综述,2015,21(23):4286-4288.
[3]谢康康,范永田.奥沙利铂联合替吉奥治疗晚期结肠癌临床观察[J].药物流行病学杂志,2014,23(10):593-595.
[4]李国东,董新舒,刘明,等.直肠癌外科治疗进展[J].中华肿瘤防治杂志,2015,22(5):402-406.
[5]张仕林.艾迪注射液辅助奥沙利铂联合替吉奥治疗晚期结直肠癌的临床观察[J].中国药房,2015,26(36):5075-5077.
[6]孙翠玲,徐晓宇,高莹莹,等.奥沙利铂联合替吉奥治疗晚期结肠癌患者的临床疗效与安全性[J].中国临床药理学杂志,2017,33(16):1540-1542.
[7]中华人民共和国国家卫生和计划生育委员会医政医管局,中华医学会肿瘤学分会.结直肠癌诊疗规范(2015年版)[J].中国实用外科杂志,2015,35(11):1177-1191.
[8]Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1)[J].Eur J Cancer,2009,45(2):228-247.
[9]孙杰,姜丽娜,潘赛英,等.西妥昔单抗联合卡培他滨与奥沙利铂治疗晚期结直肠癌20例[J].医药导报,2012,31(1):17-19.
[10]廖述文,杨平,张通,等.藤黄酸对结肠癌LoVo细胞增殖和侵袭能力的影响[J].国际中医中药杂志,2014,36(3):220-222.
[11]许伦.奥沙利铂联合替吉奥方案与XELOX方案在晚期结直肠癌治疗中的疗效及毒副作用对比[J].实用癌症杂志,2016,31(1):99-102.
[12]郑晓川.奥沙利铂联合替吉奥治疗晚期结直肠癌的近期疗效观察[J].现代消化及介入诊疗,2015,20(6):642-644.
[13]王永领,刘华强,杨平,等.替吉奥联合奥沙利铂治疗晚期结直肠癌临床观察[J].山东医药,2014,54(19):55-56.
[14]Liu Y,Bi T,Wang Z,et al.Oxymatrine synergistically enhances antitumor activity of oxaliplatin in colon carcinoma through PI3K/AKT/mTOR pathway[J].Apoptosis,2016,21(12):1398-1407.
[15]Song N,Pogue-Geile KL,Gavin PG,et al.Clinical outcome from oxaliplatin treatment in stage Ⅱ/Ⅲ colon cancer according to intrinsic subtypes:secondary analysis of NSABP C-07/NRG oncology ran domized clinical trial[J].JAMA Oncol,2016,2(9):1162-1169.
[16]严海,黄丹,胡清林,等.奥沙利铂联合卡培他滨或替吉奥对晚期结肠癌患者血浆miR-21表达的影响[J].现代生物医学进展,2017,17(17):3291-3294.
[17]汤军,欧俐苹,陈玲,等.4种血清肿瘤标志物及粪便隐血的联合检测在Dukes B期结肠癌诊断中的应用[J].重庆医学,2017,46(22):3073-3076.
[18]王金亮,孟祥朝,张自立,等.结肠癌患者血清中microRNA-183及胸苷激酶1的表达及意义[J].天津医药,2017,45(1):72-75.
