MMP-9和TIMP-1在丰宫并殖吸虫感染大鼠致肺纤维化中的表达及意义
2018-04-12李芳
李 芳
运城护理职业学院,山西运城 043100
肺纤维化(pulmonary fibrosis,PF)是由慢性炎症性组织损伤和修复共同作用的结果,病变主要累及肺间质,也可累及肺泡上皮细胞和肺血管,以大量成纤维细胞聚集和细胞外基质(extracellular matrix,ECM)沉积为特点,并最终导致患者出现进行性呼吸困难、咳嗽、呼吸生理机能受限及气体交换障碍等症状[1-4]。近年来,肺纤维化的发病率、病死率呈上升趋势[5]。引起肺纤维化的病因有多种,如粉尘、病毒、细菌、寄生虫、药物、放射性损伤等。不同病因所致肺纤维化改变都从肺泡炎开始,在发展和修复过程中导致肺纤维化[6]。
各种原因引起的肺纤维化形成的过程中,细胞外基质(ECM)的代谢异常都是相似的。而MMPS是分解ECM的主要酶类,MMP-9作为MMPS家族较重要的成员之一,可以降解分布于肺基底膜和间质的胶原等ECM成分,进而影响肺纤维的发生,TIMP-1则可特异性抑制MMP-9的活性。正常情况下,在体内两者之间存在着一种动态平衡来维持内环境的稳定。两者的失衡被认为在肺纤维化的发生发展中起重要作用。
近年来多项关于各种因素所致的动物或人肺纤维化的实验都表明,在肺纤维化早期MMP-9表达升高,破坏了肺泡壁的ECM成分,为成纤维细胞、炎性细胞移行创造条件而触发肺纤维化;在疾病后期,TIMP-1表达相对增多,抑制了ECM的降解,调节肺组织重塑。但是有关MMP-9和 TIMP-1在丰宫并殖吸虫所致的肺纤维化中的表达的文献未见报道。本实验通过建立丰宫并殖吸虫感染大鼠肺纤维化实验模型,观察受损肺脏的的病理学特征及MMP-9和TIMP-1表达情况,从而了解MMP-9和TIMP-1在丰宫并殖吸虫致大鼠肺纤维化中的作用,有助于为其治疗及预后提供新途径和方法。
1 材料与方法
1.1 材料
丰宫并殖吸虫后尾蚴在云南省景洪市丰宫并殖吸虫流行区采集溪蟹,常规分离丰宫并殖吸虫后尾蚴。主要仪器:图像分析系统购自日本尼康公司。Rat MMP-9、TIMP-1 Elisa kit购自上海拜力生物科技有限公司;试剂:Masson染色试剂盒购自上海杰美基因科技有限公司。
1.2 方法
1.2.1实验动物 分组SD大鼠,正常对照组5只,感染组为20只。实验感染组每鼠腹腔注射丰宫并殖吸虫后尾蚴8条。对照组大鼠注射等量的蒸馏水即可。感染组按感染时间的长短分为4组即感染3周组,感染5周组,感染7周组,感染9周组。
1.2.2大鼠肺组织MMP-9和TIMP-1蛋白表达水平检测 免疫组化染色检测肺脏MMP-9和TIMP-1的表达,本实验是用抗体(兔抗MMP-9 ,TIMP-1多克隆抗体)追踪抗原(MMP-9 ,TIMP-1)。每张切片在高倍镜下400倍下随机选择5个视野,其阳性细胞呈棕黄或棕褐色。利用图像分析系统进行定量分析,测定阳性细胞的平均光密度用平均光密度代表相应蛋白即MMP-9 TIMP-1蛋白表达量的多少。
1.2.3ELISA法检测大鼠血清中MMP-9、TIMP-1含量 剖杀动物取血于抗凝管中,离心得血清。按Rat MMP-9、TIMP-1 Elisa kit的操作步骤进行测定。
1.3 肺组织病理学评分
剖杀动物取得肺组织制作石蜡切片,并行HE、Masson染色,在光学显微镜下观察染色结果,根据Szapiel等[7]方法评价肺泡炎症和肺纤维化程度。将等级资料转化为计量资料,即0级为0分,Ⅰ级为1分,Ⅱ级为2分,Ⅲ级为3分。肺泡炎分为4级:0级,无肺泡炎;Ⅰ级:轻度肺泡炎,病变范围占全肺的20%以下,肺泡结构完整;Ⅱ级:中度肺泡炎,病变范围占全肺的20%~50%;Ⅲ级:重度肺泡炎,受累面积>50%。肺间质纤维化也分为4级:0级,无纤维化;Ⅰ级:轻度纤维化,受累范围<20%;Ⅱ级:病变范围占全肺的20%~50%;Ⅲ级:弥漫性肺纤维化,病变范围超过全肺的50%。
1.4 统计学处理
采用统计学软件包SPSS17.0进行统计分析。所有实验数据均为计量资料,如资料服从正态分布,则用(x±s)表示;如资料呈偏态分布,则用(M±Q)表示。对服从正态分布的多组计量资料进行方差齐性检验,方差齐时,多组间比较采用单因素方差分析,当差异有统计学意义时,用SNK法(q-test)或最小显著性差异法(LSD)检验进一步行两两比较,以α=0.05作为检验水准,P<0.05为差异有统计学意义;对于不服从正态分布的资料或虽然是正态分布资料但经方差齐性检验后认为方差不齐时,用完全随机设计多样本资料的秩和检验即H检验,以α=0.05作为检验水准,P<0.05为差异有统计学意义,进一步进行两两独立样本比较的秩和检验(调整检验水准α'=α/总比较次数10次,即α'=0.005),以此作为检验水准看两两之间是否有差异。
2 结果
2.1 肺组织光学显微镜病理形态学变化
光镜下观察,对照组大鼠肺组织结构清晰,肺泡壁完整,肺泡隔无增宽,支气管腔及肺泡强内未见炎性渗出物,无肺泡炎改变,支气管壁,血管壁可见少许胶原组织(图1~2);感染组第3周肺泡壁稍增厚,局部轻度充血,水肿及少许炎症细胞浸润(图3~4);感染组第5周肺泡炎最显著,肺组织结构紊乱,肺泡隔充血,水肿及大量炎细胞浸润,致其明显增厚(图5~6);感染组第7周肺组织结构紊乱,部分肺泡融合,肺泡隔严重充血,水肿及炎细胞浸润,可见支气管上皮脱落(图7~8);感染组第9周肺泡结构破坏,有肺大泡形成,局部肺实变,实变周围有肺气肿,纤维增生形成结节状,仍有中性粒细胞,嗜酸性粒细胞等炎细胞浸润(图9~10),Masson染色可见被染成蓝色的胶原纤维。

图1 正常对照组大鼠肺组织切片(HE×40);
图2 正常对照组大鼠肺组织切片(Masson×20)
图3 感染第3周肺组织病理切片(HE×40);
图4 感染第3周肺组织病理切片(Masson×20)
图5 感染第5周肺组织病理切片(HE×40);

图6 感染第5周肺组织病理切片(Masson×20)

图7 感染第7周肺组织病理切片(HE×40);

图8 感染第7周肺组织病理切片(Masson×20)
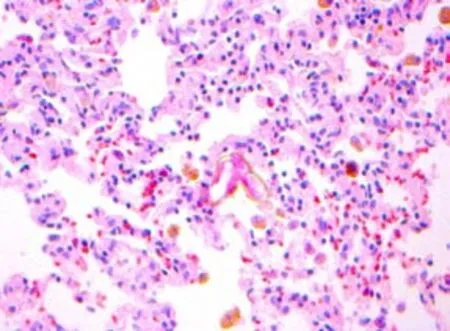
图9 感染第9周肺组织病理切片(HE×40);

图10 感染第9周肺组织病理切片(Masson×20)
2.2 肺组织病理学评分
综合HE染色及Masson染色的镜下表现,按照Szapiel等[7]方法评价肺泡炎症和肺纤维化程度。统计学分析结果显示:除感染7周组和感染9周组比较差异无统计学意义(P>0.05),其余任何两组比较,差异均有统计学意义(P<0.05)。肺纤维化评分,除感染5周组和感染7周组之间无统计学意义(P>0.05),其余任何两组比较,差异均有统计学意义(P< 0.05)。见图 11 ~ 12。
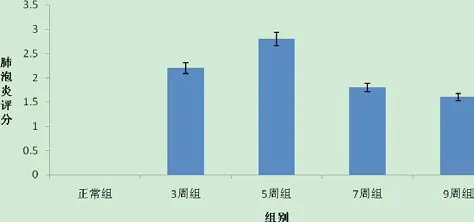
图11 各组肺泡炎程度评分比较
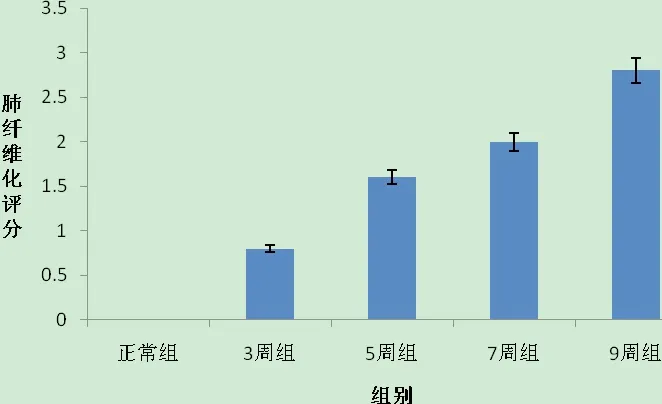
图12 各组肺纤维化程度评分比较
2.3 免疫组化结果
TIMP-1除感染3周组和感染5周组之间无统计学意义(P>0.05)MMP-9、TIMP-1正常对照组、感染7周组和感染9周组、MMP-9/TIMP-1任何两个组比较,差异均有统计学意义(P<0.05)。
表1 各组大鼠肺组织内MMP-9及TIMP-1蛋白水平表达及两者的比值(±s )

表1 各组大鼠肺组织内MMP-9及TIMP-1蛋白水平表达及两者的比值(±s )
组别 MMP-9 TIMP-1 MMP-9/TIMP-1正常对照组 0.47±0.02 0.45±0.01 1.04±0.01感染3周组 0.55±0.02 0.48±0.01 1.15±0.02感染5周组 0.70±0.04 0.49±0.01 1.43±0.04感染7周组 0.51±0.03 0.66±0.01 0.77±0.02感染9周组 0.49±0.01 0.88±0.01 0.56±0.01
2.4 ELISA法检测大鼠血清中MMP-9及TIMP-1含量,计算MMP-9/TIMP-1的比值
MMP-9、TIMP-1、MMP-9/TIMP-1,任何两组比较,差异均有统计学意义(P<0.05)。见表2。
表2 各组大鼠血清中MMP-9及TIMP-1含量及两者的比较(±s )
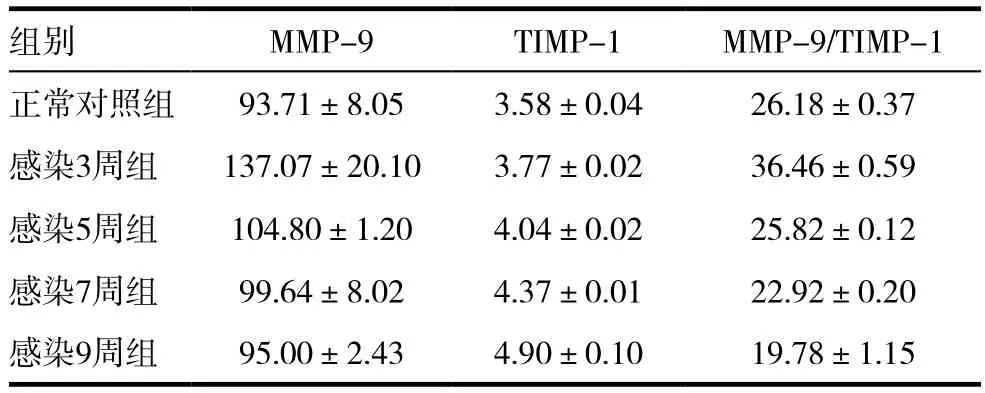
表2 各组大鼠血清中MMP-9及TIMP-1含量及两者的比较(±s )
组别 MMP-9 TIMP-1 MMP-9/TIMP-1正常对照组 93.71±8.05 3.58±0.04 26.18±0.37感染3周组 137.07±20.10 3.77±0.02 36.46±0.59感染5周组 104.80±1.20 4.04±0.02 25.82±0.12感染7周组 99.64±8.02 4.37±0.01 22.92±0.20感染9周组 95.00±2.43 4.90±0.10 19.78±1.15
3 讨论
肺纤维化是一类以弥漫性的肺泡炎和肺泡结构紊乱并最终以瘢痕组织取代正常肺组织为特征的疾病。其发生包括早期的肺泡炎阶段和后期的肺纤维化阶段。近年的研究发现MMPS与肺纤维化密切相关[8]。各种肺纤维化的共同病理为细胞外基质的代谢紊乱。而MMPS是上世纪90年代发现的一类分解ECM的主要酶类,MMP-9作为MMPS家族较重要的成员之一,可以降解分布于肺基底膜和间质的胶原等ECM成分,导致肺损伤进而启动肺纤维的发生,TIMP-1则可特异性抑制MMP-9的活性,从而参与细胞外基质的代谢。
近年来,有关MMP-9及TIMP-1在肺纤维化中表达变化的研究逐渐增多,学者们从实验或临床方面研究这两个因子与不同类型肺纤维化的关系,有人使用博来霉素建立小鼠肺纤维化模型来研究[9],有人使用射线照射小鼠全肺建立放射性肺纤维化模型来研究[10],有人建立糖尿病大鼠模型研究这两个因子在2型糖尿病大鼠肺组织中的表达变化[11],有人研究急性百草枯中毒大鼠肺组织中两个因子的表达变化[12],有人用高氧致新生大鼠肺部病变来研究[13]有人在临床上选取一些特发性肺纤维化患者或肺结核并发纤维化患者来测定他们血清及BALF中两个因子的水平[14-15]。但其在并殖吸虫所致肺纤维化中的表达情况,国内外未见报道。在本次实验中,我们用丰宫并殖吸虫来制造肺纤维化模型,由于丰宫并殖吸虫是一种生物性的病因,它对肺组织既有机械性损伤又有免疫病理损伤,通过本研究证实MMP-9及TIMP-1在丰宫并殖吸虫所致肺纤维化中的表达趋势是否与其他因素所致肺纤维化中表达类似。此外,在本实验中,我们不仅通过免疫组化方法检测MMP-9及TIMP-1在肺组织的表达水平,而且还用酶联免疫法测定大鼠血清中MMP-9及TIMP-1含量,意在了解MMP-9及TIMP-1在机体各成份中的变化趋势是否一致。
本实验结果提示,肺组织MMP-9表达在肺损伤早期表达增多,5周时达高峰,肺组织病变以炎性损伤为主,后期有所减少。而TIMP-1在整个过程中呈现持续增多的趋势,至9周时仍未下降,肺组织则逐渐出现纤维化病灶。MMP-9/TIMP-1比值也在5周时达最高,之后逐减少,感染9周时比值最低。同时显微镜下观察肺组织病理变化。并对肺泡炎及纤维化程度进行评分,发现肺泡炎症在早期较明显,尤其在感染后5周时其炎症最显著,肺泡充血水肿,大量炎细胞浸润,肺组织结构紊乱,之后炎症有所减轻,逐渐出现纤维化,9周时纤维化尤其明显。总之,MMP-9/TIMP-1比值在感染5周时最高,炎症最显著,两者比值在感染9周时最低,肺纤维化最显著,说明免疫组化所测得肺组织MMP-9/TIMP-1比值与肺泡炎及纤维化评分是一致的。其机制可能是:虫体首先在肺移行引起组织破坏和出血,肉眼可见点状片状充血灶,随后,出现炎性渗出,渗出物中含中性和嗜酸性粒细胞,巨噬细胞等,这些炎性细胞释放一系列细胞因子和炎性介质,促进MMPS的合成与活化,此期TIMP-1表达也增高,但相对于MMP-9不占优势,MMP-9/TIMP-1比值升高,该期MMP-9过度表达造成肺泡上皮细胞基底膜的破坏,炎性细胞入侵,加重早期的肺泡炎症反应,为后期的不恰当修复奠定基础;随着感染时间延长,虫体在肺部形成虫囊,由于囊壁包裹,急性炎症逐渐消退,MMP-9的产生与活化逐渐减少,但TIMP-1表达仍持续上升,引发了MMP-9/TIMP-1比例失衡,TIMP-1抑制了MMP-9对细胞基质的降解,导致细胞基质异常沉积,积极推动了肺纤维化的形成。
本实验中我们还检测了大鼠血清中MMP-9及TIMP-1含量,其变化趋势与肺组织中免疫组化所测是相似的,只是MMP-9及MMP-9/TIMP-1比值在感染后3周便达最高峰,该高峰较上述肺组织中所测结果提前出现,这可能是因为血液及肺泡液中炎性细胞如嗜酸性粒细胞,中性粒细胞,巨噬细胞等向血浆释放MMP-9的缘故。因为寄生虫感染时,血中嗜酸性粒细胞升高明显,一般为20%~40%,高者超过80%,而嗜酸性粒细胞是MMP-9的来源细胞之一。关于MMP-9变化趋势是否与嗜酸性粒细胞的变化趋势相一致,这将是之后的研究方向。孔璐等[16]研究发现血清MMP-9活性高峰较肺组织MMP-9高峰提早出现。
总之,在肺损伤早期,MMP-9/TIMP-1比值偏高,肺组织以炎性损伤为主,后期比值偏低,TIMP-1抑制了MMP-9对胶原等细胞外基质的降解,使肺组织中胶原逐渐沉积,促进纤维化形成。上述实验结果与李圣青等[9,14-15]研究结果是一致的。
本研究结果表明,在丰宫并殖吸虫所致肺损伤中MMP-9,TIMP-1表达改变及平衡破坏参与其中,引起早期肺基底膜炎性损伤和后期肺纤维化的发生。表明两者的失衡是丰宫并殖吸虫致肺纤维化发生的重要基础。提示我们在肺损伤的炎症阶段抑制MMP-9过度表达,在纤维化形成阶段适度抑制TIMP-1活性及产生,是肺纤维化防治的途径之一。
[参考文献]
[1] Liu L,Carron B,Yee HT,et al.Wnt pathway in pulmonary fibrosis in the bleomycin mouse model[J].J Environ PatholToxicolOncol,2009,28(2):99-108.
[2] Song JS,Kang CM,Rhee CK,et al.Effects of elastase inhibitor on the epithelial cell apoptosis in bleomycininduced pulmonary fibrosis[J].Exp Lung Res,2009,35(10):817-829.
[3] 李燕飞,胡长平,李峰.肺纤维化动物模型研究进展[J].中南医学科学杂志,2016,44(2):211-215.
[4] Moore BB,Lawson WE,Oury TD,et al.Animal Models of Fibrotic Lung Disease[J].Am J Respir Cell MolBiol,2013,49(2):167-179.
[5] 陈孟毅,孟爱民.肺纤维化动物模型及研究进展[J].中国比较医学杂志,2016,26(6):88-93.
[6] 刘涛,宋良文.肺纤维化发生的分子机制和早期防治研究进展[J].军事医学科学院院刊,2003,27(4):312-326.
[7] Szapiel SV,Elson NA,Fulmer JD.Bleomycin-induced interstitial pulmonary disease in the nude athymic mouse[J].Am Rev Respir Dis,1979,120(4):893-899.
[8] Oggionni T,Morbini P,Inghilleri S,et al.Time course of matrix metalloproteases and tissue inhibitors in bleomycininduced pulmonary fibrosis[J].Eur J Histochem,2006,50(4):317-325.
[9] 李圣青,张艰,黎志东,等.小鼠肺纤维化模型中MMP-9及其抑制剂表达水平的变化[J].细胞与分子免疫学杂志,2004,20(6):723-726.
[10] 李明,宋良文,孙丽,等.IV型胶原,MMP9和TIMP-1基因表达在早期放射性肺纤维化启动中的作用[J].解放军医学杂志,2007,32(10):1063-1065.
[11] 穆维新,沈亚欣,崔士杰,等.2型糖尿病大鼠肺组织基质金属蛋白酶-2,9及其抑制因子-1的表达变化[J].河北医药,2010,32(9):1034-1037.
[12] 佟飞,田英平,石汉文,等.急性百草枯中毒大鼠肺组织中基质金属蛋白酶及其组织抑制剂表达变化的研究 [J].中国急救医学,2006,26(1):41-43.
[13] LIU Xueyan,XU Gang,XUE Xindong.Dynamic expression and effects of MMP-9 and TIMP-1 on type IV collagen in lung tissue of neonatal rats with hyperoxiainduced CLD[J].China Journal of Modern Medicine,2008,18(16):2278-2282.
[14] 唐学义,王思琴,郑素歌,等.IPF患者基质金属蛋白酶及其抑制剂检测的临床意义[J].Journal of Medical Forum,2010,31(11):59-61.
[15] 段军,蒋永芳.肺结核并发纤维化患者BALF和血清MMP及TIMP-1检测的临床意义[J].现代生物医学进展,2010,10(10):1905-1907.
[16] 孔璐,潘颖,余和芬,等.肺间质纤维化大鼠体内明胶酶活性的变化[J].中国医学科学院学报,2006,28(5):717-720.
