条件培养基对大鼠慢性脊髓损伤后胶质GFAP表达的影响实验研究
2018-04-12吴翠莹张鹏飞戴宜武秦家振
张 鹏 吴翠莹 曾 旭 刘 宁 张鹏飞 戴宜武 秦家振
解放军陆军总医院,北京 100700
随着世界各国经济水平的发展,交通工具与城市建设飞速发展,同时带来脊髓损伤的发生率呈现逐年增高的趋势。脊髓损伤(spinal cord injury,SCI)是由于外界直接或间接因素导致脊髓损伤,在损害的相应节段出现各种运动、感觉和括约肌功能障碍,肌张力异常及病理反射等的相应改变,不仅给患者本人带来身体和心理的严重伤害,还对整个社会造成巨大的经济负担。尤其是慢性脊髓损伤,由于其治疗效果较差,备受各国研究人员的重视。
近年来,随着干细胞技术的发展,干细胞移植治疗 SCI 已成为热点,骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)为来源于中胚层间充质的成体干细胞,具有易于获取,无伦理学争议,增殖能力较强,易于体内外扩增等特性,除此之外,MSCs还具有免疫调节,促进神经轴突和血管再生等作用[1-2]。然而,间充质干细胞移植也有诸多不利:如无法长期存活、存在部位无法固定等。而间充质干细胞的条件培养基(BMSC-CM)因含丰富的细胞因子,对多种疾病均有积极的治疗效果[3-4]。
本实验通过观察动物行为学并进行免疫组化学检测得知,BMSC-CM能够在较大程度上影响慢性脊髓损伤后胶质纤维酸性蛋白(GFAP)表达[5]。并对大鼠慢性脊髓损伤后的功能恢复具有重要作用,现报道如下。
1 资料与方法
1.1 一般资料
随机选取脊髓神经损伤研究实验室84只雄性Wistar大鼠,两组大鼠均为慢性脊髓损伤,依据大鼠的受伤情况并运用随机数字表法将其分为对照组与观察组。对照组与观察组大鼠数量分别为42只,样本来源于受伤后 1、4、11、21、35、60、90d 等不同时期。
1.2 方法
(1)制作慢性压迫性脊髓损伤模型。手术前将大鼠固定在手术架上,并对其注射45mL的戊巴比妥钠麻醉药剂就行麻醉。以T13为中心切口,将大鼠受伤的脊髓进行切除,并将3mm长、0.5mm螺距的塑料钉嵌入大鼠的脊髓,使其脊髓受到10%的压力,之后每隔一天便重复此操作,直至受压程度达到40%,最大的受压程度可达到50%。
(2)BMSCs的培养及BMSC-CM的收集。BMSCs的原代分离培养:使用2%戊巴比妥钠(批准文号:国药准字H31021725,2010-08-17,生产单位:上海新亚药业有限公司)麻醉大鼠,无菌条件取股骨及胫骨,PBS清洗3次。剪掉股骨和胫骨的骨骺端,暴露骨髓腔,用含青、链霉素的DMEM培养基冲出骨髓,反复吹打;将冲出的骨髓制成单细胞悬液。将冲洗下来的液体制成单细胞悬液,经Percoll密度梯度离心法,分离和收集有核细胞,用含10%胎牛血清的DMEM/F12培养基重悬离心管中的细胞,镜下细胞计数,使细胞密度达到1×106个/mL,CO2培养箱培养,换液,将骨髓间充质干细胞不断传代、纯化,得到BMSCs。BMSC-CM的收集:纯化后的BMSCs,收集每次换液的培养基,经1500rpm离心去除细胞碎片后,放置与-80℃冰箱保存。
(3) ELISA操作过程(参考厂家试剂盒步骤)。①向96孔板加入100μL×稀释液,作为阴性对照。同时加入所测因子的标准品100μL到96孔板。②将所测样品100μL加到96孔板,每个样品2个微孔。③室温下孵育2h,注意用锡纸包裹96孔板避光。④孵育后将每个孔内的液体吸掉,然后每孔用400μL×冲洗液洗涤4次,每次1 ~ 2min,最后一次时将96孔板翻转置于吸水纸上。⑤每个微孔加入200μL酶标检测抗体,用封板胶纸封住反应孔,室温下孵育2h。⑥孵育后将每个孔内的液体吸掉,然后每孔用400μL ×冲洗液洗涤4次,每次1 ~ 2min,最后一次时将96孔板翻转置于吸水纸上。⑦加入200μL显色底物(显色剂A和显色剂B各100μL),室温下孵育30min,从最后一个微孔加样后开始计时。⑧加入50μL终止液,孔内溶液颜色会从蓝色变成黄色。⑨30min内进行检测,用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中生长因子的含量。计算 VEGF, bFGF,TGF-β, HGF, IL-6 的浓度。每个样品重复四次,每组取三个样品。
(4)进行免疫组织化学检测。对切除的脊髓浸泡后进行脱水与石蜡密封工作,当进行免疫组织化学检测工作时,采用SABC法,首先利用浓度为3%的过氧化氢对蜡片进行清洗,以此对蜡片进行杀菌工作;其次将蜡片放入0.01mol/L枸橼酸盐溶液中进行加热,在常温环境下待蜡片冷却后滴入抗原修复液,随后将其放入冰箱中冷藏约8 ~ 10h,将冰箱温度设定为3.5℃。最后,将蜡片从冰箱中取出并加入二抗生物素化羊抗鼠IgG,进行约30min的孵育以此来使脊髓样本中的胶质纤维酸性蛋白恢复活性,加入二氨基联苯胺与苏木素等显色剂在显微镜下进行观察。试验过后利用中性树胶对蜡片进行再次密封。上述采用的所有步骤之间均需使用0.01mol/L的磷酸盐缓冲液进行冲洗,并利用PBS代替一抗作为阴性对照。
(5)免疫荧光染色。将切片以 4%多聚甲醛固定 30min。用含 0.3% 或0.1%Triton X-100+10% BSA的 PBS 封闭非特异性染色。然后与一抗(anti-GFAP)4℃孵育过夜。冲洗后加入与一抗相对应的荧光二抗,室温孵育 1h,冲洗。用含 DAPI的封片剂(Vector Lab)封片后,在荧光显微镜下观察、拍照。
1.3 观察指标
(1)观察原代培养的骨髓间充质干细胞的培养及条件培养基情况。(2)观察两组大鼠的免疫组织化学检测结果。(3)观察两组大鼠的组织病理变化。(4)观察两组大鼠的生物行为学变化。
1.4 统计学处理
本次研究的所有数据将被录入至EXCEL中,采用 SPSS13.0 软件进行统计学处理,计量资料应用(x±s)表示,组间比较行t检验,计数资料采用(%)表示,行χ2检验,P<0.05表示差异具有统计学意义。
表2 两组大鼠的免疫组织化学检测结果比较(±s )

表2 两组大鼠的免疫组织化学检测结果比较(±s )
组别 n 脊髓损伤前脊髓损伤后1d 4d 11d 21d 35d 60d 90d对照组 42 153.18±18.03 131.87±15.12 120.27±9.82 115.21±13.08 102.37±11.93 114.09±14.21 121.07±13.57 124.58±15.16观察组 42 153.18±18.03 126.04±12.31 (133.24±10.29) (135.24±9.06) (169.25±9.61) 152.64±12.86 139.24±11.23 114.69±15.41 t 5.909 8.158 28.293 p 0.000 0.000 0.000

表3 两组大鼠的BBB评分比较(分)
2 结果
2.1 原代培养的BMSC-CM中细胞因子含量的检测结果
原代培养的 BMSCs 传至第二代时,细胞形态为长梭形的纤维状,折光性好(图 1)。我们用酶联免疫吸附法测定CM内多种因子VEGF, bFGF,TGF-β, HGF, IL-6的含量,结果如表 1。从检测结果来看,CM中含bFGF(16.51±3.70)pg/mL、VEGF(67.86±6.86)pg/mL、TGF-β(74.23±8.08)pg/mL、HGF(119.72±7.59)pg/mL、IL-6(92.15±6.42)pg/mL等多种细胞因子。

图1 原代培养的骨髓间充质干细胞(标尺为30μm)
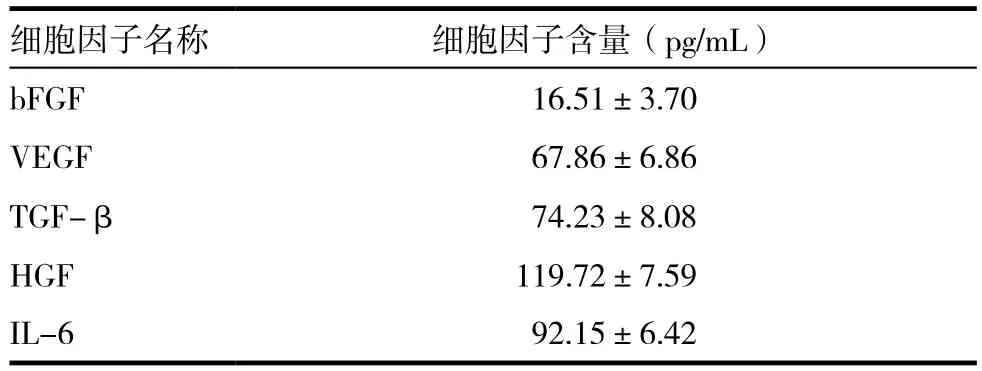
表1 Elisa检测骨髓源间充质干细胞条件培养基内分泌的细胞因子含量
2.2 对照组大鼠与观察组大鼠的免疫组织化学检测结果比较
观察组大鼠在受伤后其GFAP平均灰度值便开始上升,在第21d时其水平升到最高值,随后便开始逐渐下降。通过使用BMSC-CM,受伤第90d后其GFAP平均灰度值小于对照组大鼠,同时两组大鼠在受伤后第4,11,21天时GFAP平均灰度值差异较大,具有统计学意义(P<0.05),见表2。
2.3 观察组大鼠与对照组大鼠的生物行为学变化比较
观察组大鼠的神经功能恢复时间明显短于对照组大鼠,同时在第11天与21天的BBB评分差异明显,具有统计学意义(P<0.05),见表3。
2.4 对照组大鼠与观察组大鼠的两组大鼠的组织病理变化
对照组大鼠在脊髓受伤后第1天开始,其GFAP含量便开始上升,在进行脊髓压迫手术后,随着时间的延长,其神经元开始逐渐萎缩,并产生炎性细胞浸润现象。然而对于观察组大鼠而言,虽然受伤后第1天的GFAP含量也会上升,但是上升速度却慢于对照组大鼠,同时病变的情况要轻于对照组大鼠,见图 2、3。

图2 对照组大鼠受伤60d后 GFAP表达情况(标尺为25μm)
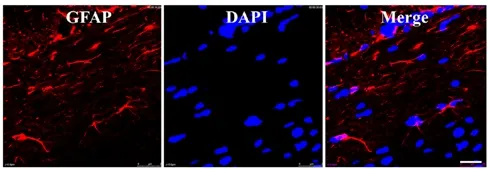
图3 观察组大鼠受伤60d后GFAP表达情况(标尺为25μm)
3 讨论
脊髓对于任何生物而言都是极其重要的神经组织,一旦受到损伤便会对生物体产生不良影响,因此必须及时采取有效的措施进行治疗[6]。BMMSCs是具有自我更新和多向分化潜能的成体干细胞,随着研究的深入,MSCs 的旁分泌作用越来越引起大家的关注,大量研究表明,MSCs 分泌的多种因子具有较好的促进创伤愈合和功能恢复的治疗效果[7-8],其分泌的一些分子已经证明具有抗凋亡和刺激细胞增殖的作用,例如血管内皮生长因子(VEGF)可诱导内皮细胞的增生、迁移,促进血管发生;成纤维细胞生长因子(bFGF)可诱导内皮细胞的增生;转化生长因子(TGF-β)可促进血管成熟;肝细胞生长因子(HGF)可抑制CD4+T细胞增殖,调节免疫;白介素6(IL-6)可调节炎症、诱导VEGF的分泌等[9-10]。BMSC-CM的作用机制主要是通过抑制细胞死亡,减轻炎症反应,促进血管再生而实现对受损组织的修复。
脊髓损伤早期,胶质瘢痕成份主要为小胶质细胞、少突胶质细胞、巨噬细胞和星形胶质细胞等;损伤后期,小胶质细胞、少突胶质细胞和巨噬细胞逐渐被星形胶质细胞所代替,成份较单一[11]。星形胶质细胞的胞体体积较大,多角形,细胞核圆形或卵圆形,由胞体向四周发出几个放射状突起。GFAP是一种酸性蛋白,分子量为50~52KD,属细胞骨骼蛋白,是星形胶质细胞的标志蛋白,其表达的高低可侧面反映星形胶质细胞增殖、肥大、坏死等改变的程度与胶质细胞的功能状态[12]。脊髓损伤后GFAP的表达逐渐增强,其高表达的区域即为胶质瘢痕富集区[13],本项实验结果表明,通过对观察组大鼠注射BMSC-CM,使得体内的星形胶质细胞的生长得到了抑制,进而在较大程度上降低了GFAP含量,使得大鼠在受伤21d左右便恢复了脊髓组织的正常功能[14]依据研究结果可知,两组大鼠在第21天时BBB评分差距最大,并且随后观察组大鼠的GFAP含量不断降低,因此使得大鼠逐渐恢复健康;同时也在较大程度上为受伤的脊髓神经提供了充足的营养,帮助神经元快速修复[15-18],能够有效的恢复大鼠的四肢功能,避免留下不良的后果,进而能够有效的提升大鼠的预后质量。除此之外,由于在脊髓受伤后GFAP的含量值上升较慢,也在在较大程度上降低了术后神经元萎缩的速度,进而使得炎性细胞的浸润速度减缓,因而观察组大鼠能够在较短时间内得以恢复。通过上述结果可充分表明,BMSC-CM能够有效的修复大鼠受伤的脊髓组织[19],并降低慢性脊髓损伤后GFAP的表达量,对于大鼠而言具有重要作用[20]。产生上述结果的总体原因在于GFAP的表达量受到了严重的抑制,因而其含量不断降低,避免了炎症细胞因子的产生,进而缩短了恢复时间。
综上所述,我院认为使用BMSC-CM能够有效的降低大鼠慢性脊髓损伤后GFAP表达量,同时提升BBB评分,进而使受伤大鼠快速恢复健康。通过大鼠实验表明,BMSC-CM对脊髓损伤后功能的恢复,具有重要的临床意义。本次研究样本容量有限,今后仍需大样本随机进一步观察。
[参考文献]
[1] Quertainmont R, Cantinieaux D, Botman O, et al.Mesenchymal stem cell graft improves recovery after spinal cord injury in adult rats through neurotrophic and proangiogenic actions [J]. PloS One,2012 , 7 (6) :e39500.
[2] Karaoz E, Kabatas S, Duruksu G, et al. Reduction of lesion in injured rat spinal cord and partial functional recovery of motility after bone marrow derived mesenchymal stem cell transplantation [J]. Turk Neurosurg, 2012, 22(2):207 -217.
[3] Timmers L, Lim SK, Hoefer IE, et al. Human mesenchymal stem cell-conditioned medium improves cardiac function following myocardial infarction[J]. Stem Cell Res, 2011, 6(3):206 -214.
[4] Kim HJ, Lee JH, Kim SH. Therapeutic effects of human mesenchymal stem cells on traumatic brain injury in rats:secretion of neurotrophic factors and inhibition of apoptosis[J].Journal of Neurotrauma, 2010, 27(1): 131-139.
[5] 陈春梅.原花青素对大鼠脊髓损伤后神经胶质酸性蛋白和脑源性神经营养因子表达的影响[J].中国康复理论与实践,2015,21(8):883-888.
[6] 王法臣,江慧,张伟,等.PPAR-γ对大鼠脊髓损伤后神经功能影响的研究[J].中华神经外科疾病研究杂志,2015,14(5):389-392.
[7] Mirotsou M, Jayawardena TM, Schmeckpeper J, et al.Paracrine mechanisms of stem cell reparative and regenerative actions in the heart[J]. Journal of molecular and cellular cardiology, 2011, 50(2): 280-289.
[8] Bruno S, Grange C, Deregibus MC, et al. Mesenchymal stem cell-derived microvesicles protect against acute tubular injury [J]. Journal of the American Society of Nephrology : JASN, 2009, 20(5): 1053-1067.
[9] Seval Y,Sati L,Celik—Ozenci C,et al.The distribution of angiopoietin-1,angiopoietin-2and their receptors tie--1 and tie--2 in the very early human placenta[J].Placenta,2008,29(9):809-815.
[10] Demir R,Kayisli U A,Cayli S,et al.Sequential steps during vasculogenesis and angiogenesis in the very early human placenta[J].Placenta,2006,27(6-7):535-539.
[11] Silver J, Miller JH. Regeneration beyond the glial scar[J].Nat Rev Neurosci, 2004,5(2): 146-156.
[12] Eng LF, Ghirnikar RS, Lee YL. Glial fibrillary acidic protein: GFAP-thirty-one years (1969-2000)[J].Neurochem Res,2000,25(9-10): 1439-1451.
[13] Huang X, Kim JM, Kong TH, et al. GM-CSF inhibits glial scar formation and shows long-term protective effect after spinal cord injury[J]. J Neurol Sci,2009,277(1-2):87-97.
[14] 许盈盈,黄银辉,陈雅芳,等.慢性间歇性缺氧对大鼠认知功能及脑室旁白质胶质细胞胶质纤维酸性蛋白、S100B 表达的影响 [J].中国老年学,2016,36(20):4987-4990.
[15] 叶缘苑,王高华,王惠玲,等.脑源性神经营养因子对慢性不可预见性温和应激大鼠行为和海马胶质纤维酸性蛋白表达的影响[J].中华精神科杂志,2012,45(5):299-303.
[16] 刘红,万朝权,田可耘,等.加巴喷丁联合吗啡对神经病理性疼痛大鼠脊髓胶质原纤维酸性蛋白表达的影响 [J].实用医学杂志,2012,28(23):3869-3871.
[17] 邵波,陈钰,彭余江,等.黄体酮对颅脑损伤大鼠脑组织中Nogo-A、胶质纤维酸性蛋白及胰岛素样生长因子 -1表达影响的研究 [J].浙江医学,2015,37(18):1510-1514.
[18] 皮斌,熊巍,孙扬,等.大鼠脊髓损伤后GFAP、cPLA2的表达变化及相关性研究[J].中国现代医学杂志,2013,23(32):31-35.
[19] 徐纪伟,孙丹华.麻黄碱对大鼠脊髓半切损伤后神经生长蛋白43和神经胶质纤维酸性蛋白表达的影响[J].广州中医药大学学报,2013,30(5):718-721.
[20] 陈春梅.经皮电刺激夹脊穴对大鼠脊髓损伤后神经胶质纤维酸性蛋白及炎症反应的影响[J].中国康复理论与实践,2016,22(6):660-666.
