不同剂量曲马多对炎症性疼痛大鼠疼痛行为学的影响及其机制探讨
2018-04-11李鹏涛秦颖肖智
李鹏涛,秦颖,肖智
(1遵义医学院研究生院,贵州遵义 563000;2遵义医学院医学与生物学研究中心)
疼痛是与组织损伤或潜在组织损伤相关的感觉、情感、认知和社会维度的痛苦体验。炎症性疼痛是生物源或化学源性炎症引发的疼痛,常见于风湿性关节炎、类风湿性关节炎、强直性脊柱炎等临床疾病。三磷酸腺苷(ATP)是一种快速兴奋性神经递质和神经调质[1],受体分为P2X受体、P2Y受体,P2X受体分为P2X1~P2X7共7种受体亚型。P2X7受体存在分子结构和功能的特点,在炎症、慢性疼痛、神经系统疾病、肿瘤的病理机制中发挥重要作用[2]。曲马多是一种非典型中枢阿片类受体镇痛药,无明显的不良反应,对全麻术后寒战具有预防和治疗作用[3]。研究[4,5]显示,曲马多通过下调脊髓背角c-Fos蛋白表达,对切口痛大鼠和神经病理性疼痛大鼠产生镇痛作用。文献[6]报道,曲马多抑制脊髓背角谷氨酸能神经元兴奋,加强γ-氨基丁酸能和甘氨酸能神经元兴奋传递产生镇痛作用。但目前对于P2X7受体激活是否介入曲马多的脊髓镇痛机制尚未见报道。本研究观察了曲马多对炎症性疼痛大鼠疼痛行为学的影响,并探讨其可能机制。
1 材料与方法
1.1实验动物采用清洁级雄性成年SD大鼠60只,体质量210~250 g,由第三军医大学实验动物中心提供[SCXK(渝)2012-0005]。每4只一笼饲养,置于湿度55%、温度(25±3)℃环境中,自由饮食,自然采光,适应环境1周。本实验严格按照有关动物伦理纲要进行操作,研究中尽量减少动物使用量和动物所承受的痛苦。
1.2药物、试剂与仪器盐酸曲马多注射液(2 mL∶100 mg,多多药业有限公司);兔抗大鼠P2X7多克隆抗体(美国abcam公司),3%牛血清白蛋白、辣根过氧化物酶标记山羊抗兔Ig G(H+L)、DAB显色试剂盒、抗体稀释液、RIPA裂解液(碧云天生物技术有限公司),抗大鼠β-actin(美国abcam公司);冰冻切片机(Leica-CM1950型,德国)。
1.3动物分组、炎症性疼痛模型制备及曲马多应用方法所有大鼠随机分为TH、TM、TL、F、NS组各12只。实验时首先让大鼠适应实验环境30 min,其后TH、TM、TL、F组大鼠在左足后底注射5%甲醛100 μL以制备炎症性疼痛模型,NS组注射等量生理盐水。10 min后,TH、TM、TL组大鼠鞘内分别注射25、15、5 μg/kg曲马多(溶于20 μL生理盐水),F、NS组分别注射等量生理盐水。各组大鼠足底注射生理盐水或甲醛成功后,均给予低浓度异氟烷进行浅麻醉,防止其过度活动。将大鼠俯卧置于实验操作台上,腹部放置一圆筒形支撑物,使腰骶部隆起,确定充分暴露腰椎间隙后,左手手指探查到脊柱下段钝形突起(髋结节),其水平位置为大鼠L6,使用25 μL微量进样器沿脊柱向上,在大鼠L5~6椎间隙进针,大鼠出现甩尾反射视为穿刺成功,30 s内缓慢注射生理盐水或曲马多20 μL,注射后观察其活动情况,出现运动功能障碍的大鼠排除在外,重新造模补足动物数。
1.4大鼠疼痛行为学观察将大鼠置于观察台上,台下斜放一镜子(与平台成30°),观察大鼠疼痛行为反应,注射侧后足行走正常、负重计0分,注射侧后足轻触观测台面计1分,注射侧后足抬离观测台面计2分,舔砥、咬、甩动或过分关爱注射侧后足计3分;另记录足底注射生理盐水或甲醛后60 min内注射侧后足的抬腿、舔足等疼痛行为的时间,每隔5 min计算1次疼痛分数。疼痛评分=∑各疼痛行为得分×持续时间(s)/300 s。
1.5大鼠脊髓背角P2X7受体阳性细胞数计数采用免疫组化染色法。建模后1 h每组随机取6只大鼠,腹腔内注射4%水合氯醛(20 mL/kg),深度麻醉后开胸暴露心脏,依次用生理盐水和4%多聚甲醛溶液灌注。取脊髓节段组织置于4%多聚甲醛溶液中,4 ℃冰箱保存;4 h后转移至30%蔗糖多聚甲醛溶液中。3 d后取脊髓腰膨大段(L4~6),OCT包埋后沿脊髓冠状位连续切片,厚25 μm。每4~5张脊髓切片取一张进行免疫组化染色分析,每只大鼠取10张。脊髓片漂洗、封闭后依次加入一抗(兔抗大鼠P2X7抗体)和二抗[辣根过氧化物标记山羊抗兔IgG(H+L)];DAB显色,脱水后封片,光镜下观察并采集图像。采用Image-pro plus6.0图像分析软件对脊髓阳性图片进行P2X7阳性细胞(细胞有相对完整的胞体和细胞核且边界清晰)计数,每张切片计数5个不重叠的视野,计数每一个视野(0.3 mm2)中的阳性细胞数(以此表示P2X7受体表达情况),取平均值。
1.6大鼠脊髓背角P2X7受体蛋白相对光密度值(ROD值)测算采用免疫印迹法。建模后1 h每组随机取6只大鼠。腹腔注射4%水合氯醛(20 mL/kg)麻醉,麻醉后迅速取脊髓腰膨大段(L4~6)组织,-80 ℃冰箱保存备用。检测时取出脊髓组织称重,加入RIPA裂解液(含PMSF,1∶100),超声波粉碎,离心取上清液,BCA法蛋白定量(蛋白定量为100 μg/mL)。取20 μL样品(蛋白含量20 μg/泳道)加样,电泳,电转至PVDF膜,TBST封闭后加入一抗[兔抗大鼠P2X7抗体(1∶200)和小鼠抗大鼠β-actin(1∶2 000)]4 ℃冰箱孵育;过夜后洗膜,加入二抗,室温孵育、洗膜。化学增强发光试剂与PVDF膜共孵育后显影,定影。图像进行目标条带扫描(方正扫描仪F5600),Bio-Rad生物图像处理系统进行分析,以β-actin为内参对照,对所测目标蛋白的条带光密度值进行标准化,得到各组P2X7受体蛋白的ROD值(以此表示P2X7受体蛋白表达情况)。
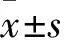
2 结果
2.1各组大鼠疼痛行为学评分比较结果见表1。

表1 各组大鼠疼痛行为学评分比较(分,
注:与NS组比较,*P<0.05;与F组比较,△P<0.05;与TL组比较,▲P<0.05;与TM组比较,#P<0.05。
2.2各组大鼠脊髓背角P2X7受体、P2X7受体蛋白表达比较结果见表2。
3 讨论

表2 各组大鼠脊髓背角P2X7受体、P2X7受体蛋白表达比较
注:与NS组比较,*P<0.05;与F组比较,△P<0.05;与TL组比较,▲P<0.05;与TM组比较,#P<0.05。
曲马多是中枢镇痛药,作用机制包括对阿片受体产生弱激动作用和抑制神经元突触对去甲肾上腺素和5-羟色胺的再摄取,从而加强机体下行性疼痛抑制系统的作用产生镇痛效果[7]。曲马多还具有外周抗炎症作用,但其具体机制不详。Lamana等[8]发现,大鼠颞下颌关节内注射甲醛或辣椒素后引起大鼠炎症性疼痛,局部注射曲马多后,可以阻断NO/cGMP信号转导途径,抑制初级疼痛传入神经元的激活;同时局部注射曲马多还减少损伤部位炎症细胞因子水平、白细胞迁移和血浆渗出,进而缓解疼痛。本研究显示,F组制模后5~60 min疼痛行为学评分较NS组增加,TL组制模后15~60 min、TM组制模后10~60 min、TH组制模后5~60 min疼痛行为学评分较F组减少,TM组、TH组制模后10~60 min疼痛行为学评分较TL组减少,TH组制模后10~60 min疼痛行为学评分较TM组减少。提示曲马多对炎症性疼痛大鼠有镇痛效应,且呈剂量依赖性,高剂量镇痛效果更好。
P2X7受体表达于中枢神经系统的小胶质细胞、星形胶质细胞和神经元。P2X7受体与其他P2X受体亚型不同,对ATP的亲和力较低,同聚体激活需要较高浓度的ATP。比较特殊的是,P2X7受体具有双功能性,长时间或反复多次较高浓度刺激,如持续的外源性ATP(>100 μmol/L)或P2X7受体激动剂刺激可以引起P2X7受体分子构象的变化,快速由离子通道转化为较大孔径的“膜孔”,这种非选择性膜孔增加细胞对多种离子的通透性和引起细胞内小分子代谢物丢失,并与疼痛的形成和维持机制密切相关。由于该膜孔由半通道连接蛋白和P2X7受体共同构成,因此使用孔道形成抑制剂可以减少IL-1β、诱生型一氧化氮合酶和环氧合酶-2的释放,进而缓解炎症和疼痛[9]。机体出现炎症、组织缺血、缺氧或损伤时,一方面,活化的免疫细胞、小胶质细胞以及死亡的细胞等可将胞内ATP释放进入细胞间隙,胞外ATP水平的增高可以激活P2X7受体;另一方面,促炎因子和细菌产物可上调胞膜P2X7受体表达,增加P2X7受体对ATP的敏感性,即在病理情况下,P2X7受体可活化并引起相关病理过程[10];并且激活的P2X7受体可以促进IL-1β、IL-1α、IL-2、IL-4、IL-6、IL-13、IL-18、TNF-α等炎症因子以及炎症调节因子NO、过氧化物阴离子等更多的炎症介质的释放,构成一个以P2X7受体激活为中心的“正反馈”环路,引起炎症性疼痛的形成和维持。文献[11,12]报道,通过使用P2X7受体拮抗剂BBG或ox-ATP可以缓解炎症性疼痛以及水肿等炎症症状。本研究显示,F组P2X7受体阳性细胞数、P2X7受体蛋白ROD值较NS组增加,TH、TM、TL组P2X7受体阳性细胞数、P2X7受体蛋白ROD值较F组减少,TH、TM组P2X7受体阳性细胞数、P2X7受体蛋白ROD值较TL组减少,TH组P2X7受体阳性细胞数、P2X7受体蛋白ROD值较NM组减少。提示曲马多可下调脊髓背角P2X7受体表达。曲马多抑制P2X7受体激活的机制考虑与ATP敏感的钾离子通道(KATP通道)有关。KATP通道在中枢神经系统广泛分布,为配体门控的内向整流钾离子通道。KATP通道激活后K+外流,细胞复极化加速,电压依赖型钙离子通道活性下降,Ca2+内流减少,影响神经递质或神经调质的释放。曲马多能选择性激动阿片μ受体,使G蛋白耦联的KATP通道激活,间接抑制Ca2+内流,减少ATP释放和P2X受体的激活[13]。有文献[14]报道,SD大鼠脊髓背角有KATP通道表达,因此我们认为,通过鞘内注射曲马多可间接激活脊髓背角KATP通道,使Ca2+内流减少,ATP释放减少,最终下调P2X7受体表达和功能,炎症性疼痛大鼠疼痛缓解,该推论还需进一步研究证实。
参考文献:
[1] Burnstock G. Historical review: ATP as a neurotransmitter[J]. Trends Pharmacol Sci, 2006,27(3):166-176.
[2] Tewari M, Seth P. Emerging role of P2X7 rceptors in CNS health and disease[J]. Ageing Res Rev, 2015,24(PtB):328-342.
[3] 曹学照,马虹,刘芳,等.曲马多对全身麻醉后寒战的干预治疗效果观察[J].山东医药,2010,50(31):72-73.
[4] Mei XP, Chen L, Wang W, et al. Combination of tramadol with minocycline exerted synergistic effects on a rat model of nerve injury-induced neuropathic pain[J]. Neurosignals, 2013,21(3-4):184-196.
[5] Liu YM, Zhu SM, Wang KR, et al. Tramadol inhibits c-fos expression in spinal cord dorsal horn and serum IL-6 levels induced by plantar incision in rats[J]. Zhejiang Da Xue Xue Bao Yi Xue Ban, 2009,38(4):392-398.
[6] Yamasaki H, Funai Y, Funao T, et al. Effects of tramadol on substantia gelatinosa neurons in the rat spinal cord: an in vivo patch-clamp analysis[J]. PLoS One, 2015,10(5):e0125147.
[7] Miotto K, Cho AK, Khalil MA, et al. Trends in tramadol: pharmacology, metabolism, and misuse[J]. Anesth Analg, 2017,124(1):44-51.
[8] Lamana SMS, Napimoga MH, Nascimento APC, et al. The anti-inflammatory effect of tramadol in the temporomandibular joint of rats[J]. Eur J Pharmacol, 2017,807:82-90.
[9] Chen SP, Qin T, Seidel JL, et al. Inhibition of the P2X7-PANX1 complex suppresses spreading depolarization and neuroinflammation[J]. Brain, 2017,140(6):1643-1656.
[10] Idzko M, Ferrari D, Eltzschig HK. Nucleotide signalling during inflammation[J]. Nature, 2014,509(7500):310-317.
[11] Itoh K, Chiang CY, Li Z, et al. Central sensitization of nociceptive neurons in rat medullary dorsal horn involves purinergic P2X7receptors[J]. Neuroscience, 2011,192(1):721-731.
[12] Dell′Antonio G, Quattrini A, Cin ED, et al. Relief of inflammatory pain in rats by local use of the selective P2X7ATP receptor inhibitor, oxidized ATP[J]. Arthritis Rheum, 2002,46(12):3378-3385.
[13] Shipton EA. Tramadol--present and future[J]. Anaesth Intensive Care, 2000,28(4):363-374.
[14] Kweon TD, Kim JY, Kwon IW, et al. Participation of KATPchannels in the antinociceptive effect of pregabalin in rat formalin test[J]. Korean J Pain, 2011,24(3):131-136.
