等离子体引发CH3OH/NH3偶联反应合成腈类化合物
2018-04-10易颜辉王旬旬王丽闫金辉张家良郭洪臣
易颜辉,王旬旬,王丽,闫金辉,张家良,郭洪臣
1 引言
有机腈类化合物具有氰基(N≡C―)官能团,是一类重要的含N有机分子,广泛应用于医药生产,例如抗癌药物比卡鲁胺、抗肿瘤药物法倔唑、抗抑郁药物西酞普兰和抗精神病药物哌氰嗪等1-3。另外,腈类化合物还可用于合成其它的含N有机分子,如嘧啶4、四氮烯5、吡咯6、胺7、亚胺8和含 N天然产物分子9。二甲基氨基乙腈[(CH3)2NCH2CN]、二甲基氰氨[(CH3)2NCN]和氨基乙腈[NH2CH2CN]是重要的医药中间体。二甲基氰氨在合成抗癌类药物六甲蜜胺过程中具有不可替代的作用10,氨基乙腈可用于生产噻吗心安。然而,这三种氨基腈类化合物的工业合成过程不仅使用有毒溶剂(二甲胺、氰化氢),而且产生过程不可避免产生废酸和废气,并且能耗高,合成过程示意图如图1所示。
甲醇的转化近年来受到广泛关注11-16。NH3作为一种非碳基氢源在等离子体条件下的活化和分解也已被研究17-19。通常,在固体酸催化剂作用下,甲醇和氨气可发生气相氨化反应生成甲胺20、在Cu-Zn-Cr催化剂表面发生脱氢氨化反应选择性生成甲酰胺21、在氧气或空气条件下氨氧化生成乌洛托品22。也有相关文献报道用甲醇和氨气在金属催化剂条件下合成氨基乙腈23。还有文献报道,在560 °C及常压条件下,以Sn4+ZSM-5作为催化剂,以甲醇、氨气和丙酮为原料合成吡啶及其衍生物24。目前,采用介质阻挡放电等离子体共转化CH3OH和NH3制备高附加值含N有机化合物的研究还未见报道。

图1 (CH3)2NCN、(CH3)2CH2CN和NH2CH2CN的工业合成过程Fig.1 Industrial synthetic processes of (CH3)2NCN,(CH3)2CH2CN and NH2CH2CN.
本文报道用介质阻挡放电(DBD)等离子体作为活化手段,引发CH3OH/NH3的偶联反应,在常温常压条件下直接合成二甲基氨基乙腈、二甲基氰胺和氨基乙腈。气体放电产生等离子体的本质是电子与气体分子非弹性碰撞电离的过程。气体中含有一定量的种子自由电子,在足够高的电场的加速作用下,种子自由电子向高压电极做加速运动,在运动过程中与气体分子或原子发生非弹性碰撞,使其激发、解离或电离。种子自由电子在电场中加速运动并与分子碰撞引发电子雪崩,使电子密度迅速增大。当电子的密度增加到一定值时,气体中的正离子、负离子及激发态物种的数目也达到一定的数目,形成了稳定的气体放电等离子体。通常,DBD等离子体具有气体温度低,而电子温度高(10000 K以上)的特点。在CH3OH/NH3等离子体中,具有较高动能的电子通过与反应物分子进行非弹性碰撞,将其具有的能量传递给CH3OH和NH3分子,被激发的CH3OH和 NH3分子发生解离可生成一系列自由基物种(CH3、CH2、CH、NH2、NH、N 和 CH2OH)。这些高活性的自由基物种通过自发的自由基反应,生成热力学和动力学有利的含N的有机化合物。该CH3OH/NH3偶联反应不仅可得到(CH3)2NCH2CN、(CH3)2NCN和 NH2CH2CN等高附加值产物,而且可副产其它的高附加值的精细化学品,如乙二醇[HOCH2CH2OH]、甲酰胺[HCONH2]、乙酰胺[CH3CONH2]、乌洛托品[(CH2)6N4]和1,2,4-三氮唑。
该等离子体引发的 CH3OH/NH3偶联反应具有工艺流程简单、原料廉价易得和无污染等优点,是一种绿色可持续的合成方法。本文主要考察介质阻挡放电等离子体反应器结构、放电参数(功率和平率)、反应条件(温度和停留时间)和填充材料等四个因素对反应结果的影响,并通过发射光谱诊断结果推测反应机理。
2 实验部分
2.1 试剂与仪器
实验过程中主要用到甲醇、乙醇、甲酰胺、乙酰胺、乌洛托品、乙二醇等化学试剂,这些化学试剂均为分析纯,且都购于国药集团化学试剂有限公司;二甲基氰胺为分析纯,购于Acros,氨气、甲烷、乙烷、一氧化碳纯度均为≥ 99.999%,购于大连大特气体有限公司。
实验过程中所用的等离子体电源(CPT-2000K)是从南京苏曼电子有限公司购买;GC-7890Ⅱ气相色谱是从上海天美科学仪器有限公司购买;5975 C单层四极杆质谱质谱仪是从安捷伦科技公司购买;DPO 3012示波器,购于美国泰克Tektronix公司;SP2758发射光谱,购于美国Princeton Instruments公司;D/max-2400型X射线粉末衍射,购于Bruker公司;Nicolet 6700傅里叶-红外光谱。
2.2 实验过程
如图2所示为等离子体引发CH3OH/NH3偶联反应的实验装置流程图。实验前,开通NH3的截止阀,通过质量流量控制器控制氨气的流量,并进入汽化混合器。CH3OH液体用高压恒流泵控制恒定的流量进入汽化混合器,并在200 °C左右温度条件下气化,并与 NH3充分混合。混合均匀的CH3OH/NH3气体混合物进入等离子体反应器。待汽化系统运行稳定后启动等离子体高压电源,调节电源的电压引发介质阻挡放电。放电过程中的电学参数(放电电压、放电电流及放电功率)用数字荧光示波器进行原位监测。CH3OH/NH3等离子体中的活性物种(激发态物种和自由基物种)通过原位发射光谱仪进行原位诊断。原料经过等离子体反应器后,未反应的原料携带反应产物进入收集器,收集器采用冰水混合物冷凝,在冷凝作用下,沸点较高的产物冷凝在收集器中。没有被冷凝下来的气体物质与未反应的原料一起通过十通阀自动进样进入气相色谱进行在线定量分析,检测器为TCD和FID,尾气经处理后排空。用具有FID检测器的气相色谱对收集的液体产物进行定量分析(手动进样)。
通过 GC-MS对反应生成的气态和液态产物进行定性,其中,气体产物中主要含有CH4、CO和 CO2等,液体产品中主要含 C2H5OH、(CH3)2NCH2CN、(CH3)2NCN、NH2CH2CN、HOCH2CH2OH、HCONH2、CH3CONH2、(CH2)6N4和(CH)2N2NH,液体产物的定性请见支持材料。实验过程中,NH3是过量的,而CH3OH是少量的,所以通过碳平衡来计算反应结果。CH3OH转化率及各种产物的选择性分别采用公式(1)和公式(2)来计算:
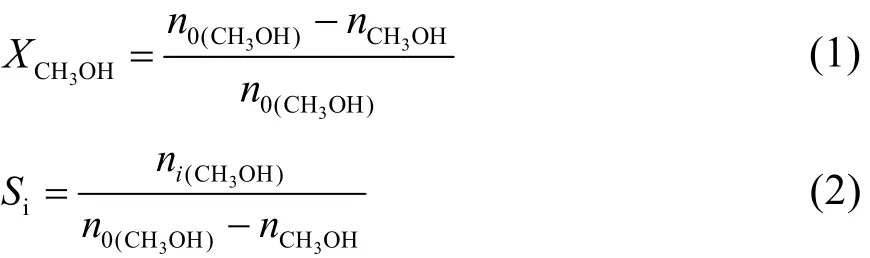
图2 反应装置示意图Fig.2 Schematic of the experimental setup.
上述公式(1)和(2)中, n0(CH3OH)和 nCH3OH分别代表反应前和反应后的甲醇摩尔数, ni(CH3OH)表示生成产物i消耗的CH3OH摩尔数。能量密度SED =P/V (P为注入功率W;V为放电区体积cm3)。
3 结果与讨论
3.1 反应器的影响
在等离子体化学反应中,反应器的结构及电极的材质是重要的影响因素,需要重点考察。如图 3所示,本文考察了四种结构的介质阻挡放电等离子体反应器中的CH3OH/NH3偶联反应。
图 3所示的四种反应器(A、B、C和 D)均为线筒式结构。上述四种反应器的有效放电区长度均为5 cm,极间距均为3.5 mm。其中,A反应器是单介质阻挡放电反应器,该反应器采用石英玻璃作为阻挡介质(阻挡介质厚度1 mm),采用不锈钢(SS)棒作为高压电极(SS棒的直径为2 mm),采用铝箔作为接地电极(铝箔厚度为 0.1 mm)。B反应器是双介质阻挡放电反应器,采用装填铝粉的石英玻璃套管作为高压电极(铝粉为150目,石英玻璃套管的壁厚为0.5 mm),采用铝箔作为接地电极,因此具有双层石英玻璃阻挡介质。C反应器也是单层阻挡介质反应器,阻挡介质是厚度为 1 mm的石英玻璃,高压电极是直径为2 mm的不锈钢棒,接地电极是循环食盐水(2% NaCl溶液),温度为90 °C的。D反应器大体结构与A反应器类似,与A反应器的不同点是采用螺旋铁丝作为接地极(铁丝直径为 2 mm),铁丝圈间的间距为 0.5 cm。

图3 反应器A、B、C和D结构示意图Fig.3 Schematic diagram of the reactor A, B, C and D.
图4为上述四种反应器中进行的CH3OH/NH3偶联反应的反应结果。总的来看,产物中除了有前面提到的腈类产物、乙二醇和酰胺类产物,还有甲烷和 CO副产物。由图4可以看出,四种不同结构反应器对应的甲醇转化率和产物选择性有显著的差异。从甲醇转化率来看,接地极为铝片的反应器A和B对应的甲醇转化率较高。对于腈类化合物的选择性,具有单层介质结构的的A、C和D反应器对应的腈类化合物的选择性较高,其中接地极为螺旋铁丝的D反应器的腈类化合物选择性比其它三种反应的高,达到13.1%。与D反应器相比,A反应器的甲醇转化率更高,且反应器 A对应的甲烷选择性较低,因此,后续的CH3OH/NH3偶联反应实验是在上述的A反应器中进行的。
如图5所示为上述四种反应器中的CH3OH/NH3介质阻挡放电的电流波形(电流脉冲值随时间的变化)。由图5可看出,反应器C和D的电流脉冲的高度较高,但是脉冲高度不稳定,说明介质阻挡放电主要是状态不稳定的丝状放电,并且脉冲数量较少,说明单个周期内的放电次数较少。而反应器A和B的电流脉冲数量较多,且呈现周期性变化规律,说明A和B反应器中介质阻挡放电主要是较稳定的弥散放电形式。通常,单个周期内脉冲数量越多,对应的单个周期内的放电次数较多,平均电子密度相对较高。A和 B反应器中的等离子体电子密度较高可能是其具有较高甲醇转化率的原因。值得一提的是,与B反应器相比,A反应器中的等离子体电流脉冲强度更强,并且脉冲数量更多。换句话说,无论是平均电子密度还是平均电子能量,A反应器都较 B反应器高。较高的平均电子能量和较高的平均电子密度可能更有利于活化 CH3OH和 NH3分子,得到较高的腈类选择性。
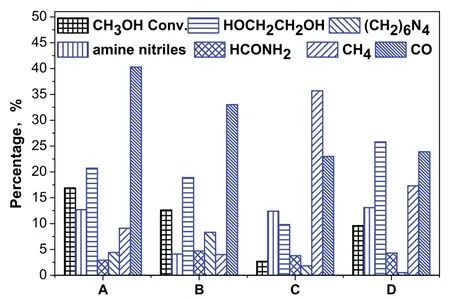
图4 不同结构反应器的甲醇转化率和产物选择性Fig.4 Effect of reactors on CH3OH conversion and products selectivity.

图5 四种反应器中CH3OH/NH3介质阻挡放电的电流波形图Fig.5 Current waveform of CH3OH/NH3 DBD.
在上述的A反应器中,不同的高压电极的材质对应的 CH3OH转化率和腈类选择性有显著差异,结果如图 6所示。这些不同材质的高压电极都是直径为2 mm的圆形金属棒。由图6可以看出,钨(W)棒高压极对应的甲醇转化率较高,而铝棒高压极对应的甲醇转化率较小。然而,铝棒高压极对应的腈类选择性相对较高,且与不锈钢电极对应的腈类化合物选择性相近,均为 12.7%左右。由于不锈钢高压电极对应的甲醇转化率较高,且不锈钢电极对应的甲烷和CO选择性最低,因此,优选出不锈钢棒为较好的高压极材质。不同电极材料的影响可能与以下两个因素有关:(1) 不同金属材料具有不同的原子外层电子排布,导致不同的电学性质;(2) 高压电极在等离子体化学反应过程中,与反应物分子直接接触,位于电极表面的金属原子有可能发挥一定的催化作用。

图6 不同高压电极材质对应的甲醇转化率和产物分布Fig.6 Effect of HV electrode material on CH3OH conversion and products selectivity.
3.2 放电条件的影响
等离子体注入功率是等离子体化学反应的一个关键参数。当反应器的放电体积固定时,注入功率是等离子体放电区能量密度的决定性因素。通常,注入功率越大,对应的等离子体放电区的能量密度就越高。注入功率分别为20、25、30和40 W的CH3OH/NH3等离子体偶联反应结果如图7所示。
由图7可以看出,注入功率对CH3OH转化率和氨基腈类产品选择性有显著的影响。随着注入功率由20 W增大到40 W,甲醇转化率显著升高,40 W的注入功率条件下甲醇的转化率达到60%左右。与甲醇转化率变化规律不同,随着注入功率增大,氨基腈类产品的选择性呈现先增大,而后下降的变化趋势,25 W注入功率条件下,氨基腈类产品选择性最高,达到 12.7%。此外,低功率时对应的甲烷和 CO副产物的选择性也较低。由图 7实验结果可推测,适中的能量密度有利于腈类化合物的生成,而过高的能量密度导致副产物CH4和CO的生成。也就是说,过高的能量密度导致CH3OH分子被过度活化,分解成CO或甲烷化。
在等离子体化学反应过程中,放电频率是一个重要参数。25 W注入功率时,放电频率分别为8、10、12、14和 15 kHz的 CH3OH/NH3等离子体偶联反应结果如图8所示。由图8可以看出,随着放电频率由8 kHz升高到15 kHz,甲醇的转化率先降低后又有较小幅度的升高。但是,氨基腈类产品的选择性随放电频率的增加呈现先增后降的变化趋势。在12 kHz放电频率条件下,腈类化合物的选择性较高。

图7 不同注入功率对应的甲醇转化率和产物选择性Fig.7 Effect of input power on CH3OH conversion and products selectivity.
放电频率分别为8、10、12、14和15 kHz的CH3OH/NH3介质阻挡放电的放电电流波形如图 9所示。从图 9可看出,随着放电频率的升高,电流脉冲数量逐渐减少,放电的脉冲宽度逐渐降低。频率为12 kHz时DBD的电流脉冲的数量和宽度适中,等离子体放电状态较稳定。由此可推测,等离子体中的平均电子能量和电子密度在12 kHz时都比较适中,这可能是适中的放电频率(12 kHz)有利于生成腈类化合物的原因。
3.3 反应条件的影响
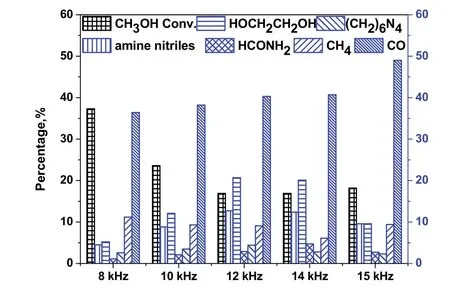
图8 不同放电频率对应的甲醇转化率和产物选择性Fig.8 Effect of discharge frequency on CH3OH conversion and products selectivity.

图9 不同频率CH3OH/NH3 介质阻挡放电电流波形Fig.9 Current waveform of CH3OH/NH3 DBD at varied discharge frequency.
原料停留时间是影响等离子体化学反应结果的至关重要的条件之一。在A反应器中,在液态甲醇进料量 0.02 mL·min-1、NH3体积流速 44 mL·min-1、放电频率12 kHz、等离子体区能量密度 SED = 6.63 J·s-1·cm-3(SED: specific energy density)的条件下,考察停留时间对 CH3OH/NH3等离子体偶联反应的影响。停留时间的考察是在单位体积能量密度不变的条件下,通过改变等离子体放电区长度,即等离子体放电区体积来实现的。停留时间分别为 3.6、4.5、5.4和 6.3 s的CH3OH/NH3等离子体偶联反应结果如图10所示。
由图10可知,随着停留时间由3.6 s延长到6.3 s,甲醇的转化率显著地升高。在相同的能量密度条件下,甲醇分子在等离子体放电区的停留时间越长,甲醇分子与等离子体中的高能电子发生非弹性碰撞而被活化(激发和解离)的概率越高,因而甲醇的转化率随停留时间延长而升高。由图10还可以看出,随着停留时间由3.6 s延长到6.3 s,腈类化合物的选择性逐渐降低,而副产物甲烷和CO的选择性逐渐升高。该实验结果可能由两方面原因造成的,一方面是由于这些腈类产物与原料分子相比更活泼,容易发生进一步的二次化学反应,进而发生分解;另一方面是由于CH3OH分子在等离子体中长时间停留,可能会发生过度活化,进而分解成 CO或发生甲烷化反应。由此可知,较短的停留时间有利于 CH3OH/NH3偶联反应生成腈类。

图10 不同原料停留时间的甲醇转化率和产物选择性Fig.10 Effect of feed residence time on CH3OH conversion and products selectivity.
反应温度通常对化学反应具有重要的影响。注入功率25 W的条件下,通过对以下三种方式改变等离子体区的反应温度,即对反应器进行不保温、保温和用加热炉加热。不保温条件下用热电偶监测反应器的器壁温度约为285 °C,保温条件下用热电偶监测反应器器壁温度为370 °C左右,通过控温仪和加热炉对反应器加热可分别控制反应器器壁温度为430 °C和480 °C左右,在此,器壁温度被近似认为与反应温度相当。反应温度分别为285、370、430和480 °C的反应结果如图11所示。由图11可得,反应温度显著影响CH3OH/NH3等离子体偶联反应的结果。随反应温度的升高,甲醇的转化率逐渐升高,但腈类的选择性逐渐降低。并且,低温条件下,副产物甲烷和 CO的选择性也较低。由此可知,高温会导致甲醇的分解及甲烷化反应,从而生成更多的 CO和 CH4副产物,而较低的反应温度则有利于CH3OH/NH3偶联反应生成腈类。
3.4 填充材料的影响
在等离子体放电区添加填充材料通常会对等离子体化学反应的结果产生显著的影响。一方面,填充材料可能会起到催化作用;另一方面,填充材料会增大等离子体区的折合电场强度,尤其是材料表面的场强。在甲醇流速0.02 mL·min-1,氨气流速 44 mL·min-1,P = 30 W,f = 12 kHz,l = 40 mm条件下,添加不同填充材料的CH3OH/NH3等离子体偶联反应的结果如表1所示。
由表 1可知,大多数填充材料都有利于甲醇的转化,只有BaTiO3显著地降低了甲醇转化率,不同填充材料对应的甲醇转化率大小顺序是Na-ZSM-5 > γ-Al2O3> TS-1 > fumed SiO2> TiO2>石英砂(SiO2) > 空管 > BaTiO3。其中,添加Na-ZSM-5和γ-Al2O3时,甲醇转化率超过了90%,这可能是由于Na-ZSM-5和γ-Al2O3具有酸催化的功能,在反应条件下通过酸催化促进了甲醇的转化。另一方面,不同填充材料对应的氨基腈类产物选择性也大不相同。由表 1可看出,添加不同填充材料时,腈类化合物选择性从大到小的排列顺序是 fumed SiO2> TS-1 > 石英砂(SiO2) > 空管 > BaTiO3> γ-Al2O3> Na-ZSM-5 > TiO2。由此可知,往 CH3OH/NH3等离子体中分别填充白炭黑、TS-1和石英砂这三种填充材料有利于生成腈类化合物,而填充γ-Al2O3和Na-ZSM-5虽然能提高甲醇转化率,但显著地降低了腈类化合物的选择性。

图11 不同反应温度的甲醇转化率和产物选择性Fig.11 Effect of reaction temperature on CH3OH conversion and products selectivity.
3.5 反应机理的初步讨论
在3.1节中已经提到反应器A具有较高的腈类选择性(12.7%),但反应器B的腈类选择性最低(4.1%)。为了初步探讨CH3OH/NH3等离子体偶联反应生成腈类化合物的机理,采用带光纤的发射光谱仪分别对反应器 A和反应器 B中的CH3OH/NH3等离子体进行原位光谱诊断,诊断的光谱结果如图12所示。
由图12可知,反应器A和B中等离子体发.射光谱都出现了336 nm、431 nm和656 nm谱线,这三条谱线分别归属为NH* (A3∏ → X3S-)25、CH(A2∑→X2∏)26和 Hα(2p2p03/2 → 3d2D3/2)27。同时,发射光谱中也出现了564-567 nm、610-670 nm和720-780 nm三个谱带。其中,第一个谱带归属为NH3* (Schuster′s bands)28,后两个谱带归属为NH2* (NH3α bands)29。图12光谱诊断结果说明,本文所讨论的CH3OH/NH3等离子体中含有CH、NH和 NH2三种自由基物种。通常,甲醇或甲烷等离子体中,CH自由基是通过CH3自由基逐步脱氢而生成,也就是说 CH自由基的发射光谱也从侧面表明,CH3OH/NH3等离子体也还含有CH3和CH2自由基物种。由于反应器A中的光谱强度明显高于反应器B中的等离子体光谱强度,由此可得A反应器中的CH3、CH2、CH、NH3和NH自由基物种浓度要高于B反应器中这些自由基物种的浓度。值得注意的是,反应器A对应的光谱中还出现了388 nm谱线,而反应器B对应的光谱没有出现 388 nm 谱线,该谱线归属为 C≡N 物种(B2∑→X2∑)30。由此可知,A 反应器中 CH3OH/NH3等离子体中C≡N物种浓度明显高于B反应器中的浓度,该物种很可能是促进生成腈类化合物的重要中间体,这也就解释了为什么A反应器中腈类化合物选择性较高。
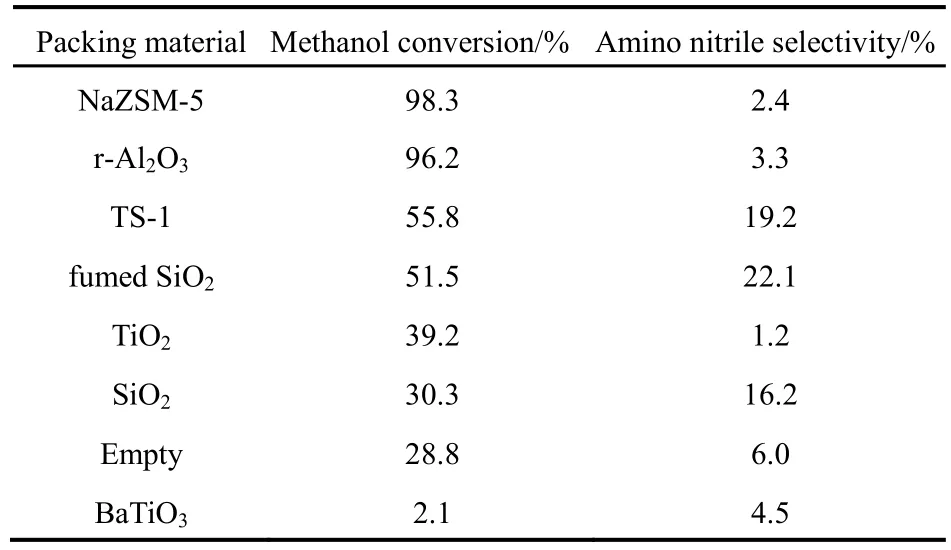
表1 不同填充材料的甲醇转化率和氨基腈类选择性Table 1 Effect of packing materials on CH3OH conversion and amino nitriles selectivity.
文献中曾提到很多生成C≡N物种的基元反应31,但是由发射光谱可知,CH3OH/NH3等离子体中含有 CH3、CH2、CH、NH2和 NH自由基物种。由此可推测,在本文所述的CH3OH/NH3等离子体条件下,C≡N 物种可通过以下3个主要的基元反应(R1-R3)生成:
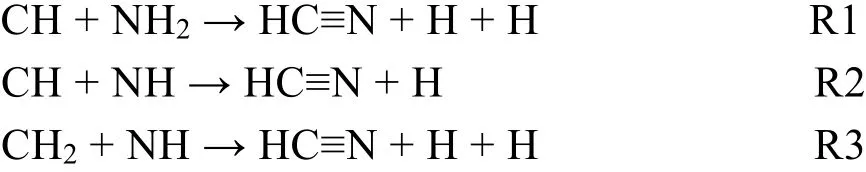
所生成的 C≡N活性物种具有很高的反应活性,它能进一步与CH3OH/NH3等离子体中的活性自由基物种(CH3、CH2、CH、NH2和 NH)发生自由基反应生成(CH3)2NCH2CN、(CH3)2NCN和NH2CH2CN等氨基腈类化合物。
上述实验结果表明,该等离子体引发的CH3OH/NH3偶联反应可在常温常压条件下直接合成二甲基氨基乙腈、二甲基氰胺和氨基乙腈,合成过程不使用任何有毒试剂。尽管如此,与目前的氯代烃取代法和酰胺脱水等工艺相比,该等离子体合成过程还是存在能耗高,且选择性偏低等不足之处。添加合适的催化剂可能会是降低能耗,并提高目标产物选择性的一个研究方向。

图12 反应器A和B中的CH3OH/NH3 等离子体发射光谱结果Fig.12 Optical Emission Spectra of CH3OH/NH3 DBD plasma in the reactor A and reactor B.
4 结论
通过对 CH3OH/NH3介质阻挡放电反应器结构、放电条件、反应条件和填充材料四个因素的考察,发现 A反应器有利于生成腈类化合物;A反应器中适中的功率、适中的放电频率、短停留时间、低反应温度有利于生成腈类化合物;在 A反应器中添加白炭黑作为填充材料可显著提高腈类化合物选择性。在最佳条件下(A反应器、不锈钢棒高压极、放电区长度40 mm、注入功率30 W、放电频率是12 kHz、醇氨比是1 : 4、停留时间4.5 s、反应温度285 °C、填充20-40目白炭黑),甲醇的转化率达到 51.5%,氨基腈类化合物的选择性达到22.1%,收率为11.4%。由CH3OH/NH3等离子体的原位发射光谱诊断结果推测C≡N活性物种可能是引发生成氨基腈类化合物的重要反应中间体物种。该研究为甲醇和氨气提供了一种精细化利用途径。
(1) Fatiadi, A. J. Preparation and Synthetic Applications of Cyano Compounds; Wiley: New York, 1983.
(2) Fleming, F. F.; Yao, L; Ravikumar, P. C.; Funk, L; Shook, B. C.J. Med. Chem. 2010, 53, 7902. doi: 10.1021/jm100762r
(3) Sundermeier, M.; Zapf, A.; Mytyala, S. Baumann, W.; Sans, J.;Weiss, S.; Beller, M. J. Chem. Εur. 2003, 9, 1828.doi: 10.1002/chem.200390210
(4) Movassaghi, M.; Hill, M. D. Νat. Protoc. 2007, 2, 2018.doi: 10.1038/nprot.2007.280
(5) Yang, J.; Karver, M. R.; Li, W.; Sahu, W.; Devaraj, N. K. Angew.Chem. Int. Εd. 2012, 51, 5222. doi: 10.1002/anie.201201117
(6) Yu, S.; Xiong, M.; Xie, X.; Liu, Y. Angew. Chem. Int. Εd. 2014, 53,11596. doi: 10.1002/anie.201407221
(7) Lu, S.; Wang, J.; Cao, X.; Li, X.; Gu, H. Chem. Commun. 2014, 50,3512. doi: 10.1039/C3CC48596J
(8) Kim, J.; Hong, S. H. Org. Lett. 2014, 16, 4404.doi: 10.1021/ol501835t
(9) Fleming, F. F. Νat. Prod. Rep. 1999, 16, 597.doi: 10.1039/A804370A
(10) Dornan, P.; Rowley, C. N.; Priem, J.; Barry, S. T.; Burchell, T.J.; Woo, T. K.; Richeson, D. S. Chem. Commun. 2008, 3645.doi: 10.1039/B803732A
(11) Lin, L. L.; Zhou, W.; Gao, R.; Yao, S.; Zhang, X.; Xu, W.;Zheng, S.; Jiang, Z.; Yu, Q.; Li, Y. W.; Shi, C.; Wen, X. D.;Ma, D. Νature 2017, 544, 80. doi: 10.1038/nature21672
(12) Natte, K.; Neumann, H.; Beller, M.; Jagadeesh, R. V. Angew.Chem. Int. Εd. 2017, 56, 6384. doi: 10.1002/anie.201612520
(13) Khare, R.; Liu, Z. H.; Han, Y.; Bhan, A. J. Catal. 2017, 348,300. doi: 10.1016/j.jcat.2017.02.022
(14) Hwang, A.; Kumar, M.; Rimer, J. D.; Bhan, A. J. Catal. 2017,346, 154. doi: 10.1016/j.jcat.2016.12.003
(15) Hu, S.; Zhang, Q.; Yin, Q.; Zhang, Y. F.; Gong, Y. J.; Zhang,Y.; Wu, Z. J.; Dou, T. Acta Phys. -Chim. Sin. 2015, 31, 1374.[胡思, 张卿, 尹琪, 张亚飞, 巩雁军, 张瑛, 吴志杰, 窦涛.物理化学学报, 2015, 31, 1374. ] doi:10.3866/PKU.WHXB201504302
(16) Zhang, J.; Yuan, Q. C.; Zhang, J. L.; Li, T.; Guo, H. C. Chem.Commun. 2013, 49, 10106. doi: 10.1039/C3CC45877F).
(17) Wang, L.; Yi, Y. H.; Zhao, Y.; Zhang, R.; Zhang, J. L.; Guo, H.C. ACS Catal. 2015, 5, 4167. doi: 10.1021/acscatal.5b00728
(18) Wang, L.; Zhao, Y.; Liu, C. Y.; Gong, W. M.; Guo, H. C.Chem. Commun. 2013, 49, 3787.doi: 10.1039/C3CC41301B
(19) Sun, S. Q.; Yi, Y. H.; Wang, L.; Zhang, J. L.; Guo, H. C. Acta Phys. Chim. Sin. 2017, 33, 1123. [孙帅其, 易颜辉, 王丽,张家良, 郭洪臣. 物理化学学报, 2017, 33, 1123.]doi: 10.3866/PKU.WHXB201703301
(20) Fan, J. X.; Yu, H. B; Zang, J. Z.; Xing, S. J. Industrial Catalysis 2013, 21 (5), 7. [范景新, 于海斌, 臧甲忠, 邢淑建. 工业催化, 2013, 21, 7.]
(21) Qiang, L. P.; Chen, Y. B.; Cao, W.; Zhao, S. F. J. Fine and Specialty Chemical 2012, 20, 15. [强林萍, 陈云斌, 曹伟富,赵素芬. 精细与专用化学品杂志, 2012, 20, 15.]
(22) Shadrin, D. V.; Daut, V. A.; Ozhegov, A. I.; Gusev, A. L.;Avramenko, EH.V.RU 2198887-C1, 2003.
(23) Pan, W. X.; Feng, J.; Wen, T.; Wu, X. H.: Method for One-step Synthetising Nitrile and Amino-acetic Acid by Methanol Ammoniation Dehydrogenation. CN 101597240 A, 2009
(24) Wang, Z. M. The synthesis of 2, 6-Dimethylpyridine. M. S.Dissertation, Zhejiang University, Hangzhou, 2003. [汪钟民.2,6-二甲基吡啶的合成研究[D], 杭州: 浙江大学, 2003.]
(25) Muller, U.; Schulz, G. J. Chem. Phys. 1992, 96, 5924.doi: 10.1063/1.462661
(26) Worsley, M. A.; Bent, S. F.; Fuller, N. C. M.; Dalton, T.J. Appl. Phys. 2006, 100 (8), 083301. doi: 10.1063/1.2358303
(27) Petrović. Z. L.; Phelps, A. V. Phys. Reν. Ε 2009, 80, 016408.doi: 10.1103/PhysRevE.80.016408
(28) Watson, J. K. G.; Majewski, W. A.; Glownia, J. H. J. Mol.Spectrosc. 1986, 115, 82. doi: 10.1016/0022-2852(86)90277-8
(29) Herzberg, G.; Ramsay, D. A. J. Chem. Phys. 1952, 20, 347 doi: 10.1063/1.1700418
(30) Vandevelde, T.; Nesladek, M.; Ouaeyhaegens, C.; Stals, L.Thin Solid Films 1996, 290-291, 143.doi: 10.1016/S0040-6090(96)09189-4
(31) Glarborg, P.; Miller, J. A.; Kee, R. J. Combust. Flame 1986, 65,177. doi: 10.1016/0010-2180(86)90018-0
