ARID2在原发性肝癌中的表达及对细胞增殖与细胞周期的影响
2018-04-10李孝斌王家中孙学军
张 立,王 炜,李孝斌,李 杰,王家中,孙学军*
(1西安交通大学第二附属医院普通外科,西安 710004;2西安交通大学第一附属医院普通外科;*通讯作者,E-mail:sunxy@mail.xjtu.edu.cn)
原发性肝细胞癌(hepatocellular carcinoma,HCC)是最常见的消化系统恶性肿瘤之一,其恶性程度及死亡率极高[1-3]。目前,HCC在临床诊断和综合治疗方面都有很大程度的提升,但患者预后仍旧不容乐观[4]。目前认为,抑癌基因的功能缺失和致癌基因的激活与HCC的发生密切相关,但其分子机制尚未完全阐明。本实验通过免疫组化、qPCR、小干扰RNA(small interfering RNA,siRNA)干扰、MTT及流式细胞术检测ARID2在配对肝癌组织、不同肝癌细胞株中的表达及对细胞功能的影响。
1 材料与方法
1.1 临床病理标本
收集2015-01~2015-12西安交通大学第一附属医院60例连续HCC患者的配对癌组织和癌旁组织(距癌组织2 cm),患者接受手术切除前,未接受任何抗肿瘤治疗。所有标本均在组织离体后30 min内放置液氮内保存。术前与所有患者或家属签署标本收集知情同意书,经西安交通大学伦理委员会批准并严格遵照《赫尔辛斯基宣言》医学伦理道德准则实施。
1.2 细胞株及试剂
三种HCC细胞株MHCC-97H,HepG2、SMMC-7721及人正常肝细胞株LO2购自中国科学院上海细胞库,Trizol试剂盒购自Life Technologies,TaqMan RNA反转录试剂盒购自Applied Biosystems,Lipofectamine2000转染试剂盒购自美国Invitrogen。
1.3 免疫组化检测在HCC组织及癌旁组织中ARID2的表达
采用ABC法切片经二甲苯脱蜡、梯度乙醇水化后,枸橼酸钠缓冲液加热抗原修复高火10 min,中低火13 min;3%过氧化氢封闭内源性过氧化物酶;参考抗体说明书滴加稀释后ARID2(1 ∶100,Abcom)抗体,4 ℃冰箱过夜;湿盒室温复温1 h后滴加生物素标记二抗(购自北京中杉金桥公司),37 ℃孵育2 h,亲和素-生物素-过氧化物酶复合物染色(SABC)法行二氨基联苯胺(DAB)显色,苏木紫衬染,重新脱水透明,封片,显微镜下观察。所有染色采用已知阳性癌组织切片作为阳性对照,磷酸盐缓冲液(PBS)代替一抗作为阴性对照。
结果判定标准:ARID2主要表达在细胞核中,根据肿瘤细胞质的染色程度和染色细胞百分率分析评分。以出现淡黄-棕褐色颗粒作为阳性结果,由2名副高级职称病理医师进行独立双盲评分。每张病理切片随机选取10个10×40倍光学显微镜视野,将ARID2的染色范围及染色强度依据以下标准半定量化,结果取平均值。染色范围:染色阳性细胞数占总细胞数的比率按≤5%为0分,6%-25%为1分,26%-50%为2分,51%-75%为3分,≥76%为4分;染色强度:未染色为0分,淡黄色为1分,棕色为2分,棕褐色为3分。将染色范围与染色强度计分相乘得出结果:0-4分为低表达,5-12分为高表达。
1.4 实时定量PCR分析HCC细胞中ARID2的表达
利用Trizol从HCC及LO2细胞提取总RNA。使用TaqMan RNA反转录试剂盒对ARID2进行定量PCR扩增,U6作为内对照。采用CFX Manage软件(美国Bio-Rad)分析进行结果分析,采用2-ΔCt方法计算相对表达量并绘制图表。
1.5 qPCR筛选siRNA
结合本实验室培养条件及细胞功能状态,选择HepG2细胞株进行后续siRNA干扰及功能学实验,根据PubMed公布的ARID2基因序列设计3对siRNA(见表1)。参照Lipofectamine2000说明书进行siRNA转染,筛选有效抑制ARID2的siRNA。
表1siRNA-ARID2引物序列
Table1siRNA-ARID2sequencesoftheprimers
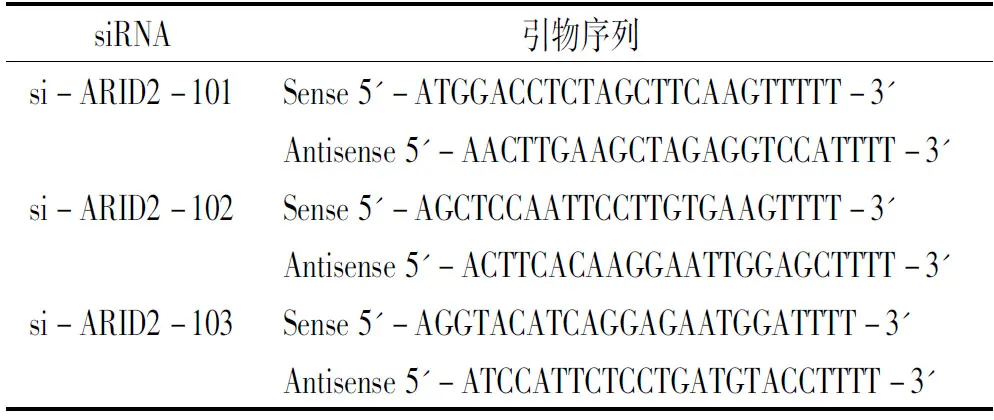
siRNA引物序列 si-ARID2-101si-ARID2-102si-ARID2-103Sense5'-ATGGACCTCTAGCTTCAAGTTTTT-3'Antisense5'-AACTTGAAGCTAGAGGTCCATTTT-3'Sense5'-AGCTCCAATTCCTTGTGAAGTTTT-3'Antisense5'-ACTTCACAAGGAATTGGAGCTTTT-3'Sense5'-AGGTACATCAGGAGAATGGATTTT-3'Antisense5'-ATCCATTCTCCTGATGTACCTTTT-3'
1.6 MTT实验检测细胞增殖
取对数期HepG2细胞常规消化细胞离心收集细胞,调整细胞数量并接种于96孔板,培养24 h后先后加MTT、DMSO后测定OD值并绘制图表,所有实验具体步骤参照第四军医大学出版的细胞与分子生物学常用实验技术指导。
1.7 流式细胞仪检测细胞周期
将细胞接种于6孔板按照2×105/孔转染48 h,将细胞固定于4 ℃ 70%乙醇24 h,50 μg/ml碘化丙啶染色(凯基生物,中国)。采用流式细胞仪细胞分选(FACS,美国)和CellQuest软件(Becton Dickinson,美国)进行细胞周期分析。
1.8 统计学分析
采用Pearson χ2检验计算ARID2表达在组织中与病理特征的关系,t检验分析ARID2的表达差异,可信区间为95%,P<0.05为差异具有统计学意义,统计学分析采用SPSS18.0统计软件进行。
2 结果
2.1 ARID2在HCC组织中的表达水平
ARID2阳性染色主要位于细胞核中,呈棕色、棕黄色颗粒样(见图1),在HCC组织中,78.3%(47/60)高表达,21.7%(13/60)低表达,在癌旁组织中,25.0%(15/60)高表达,75.0%(45/60)低表达,两者具有统计学差异(P<0.05)。
2.2 ARID2在HCC细胞中的表达
利用qPCR方法检测在三种HHCC-97H、HepG2、SMMC-7721细胞株中ARID2水平的表达均高于正常LO2肝细胞的表达(P<0.05,见图2)。
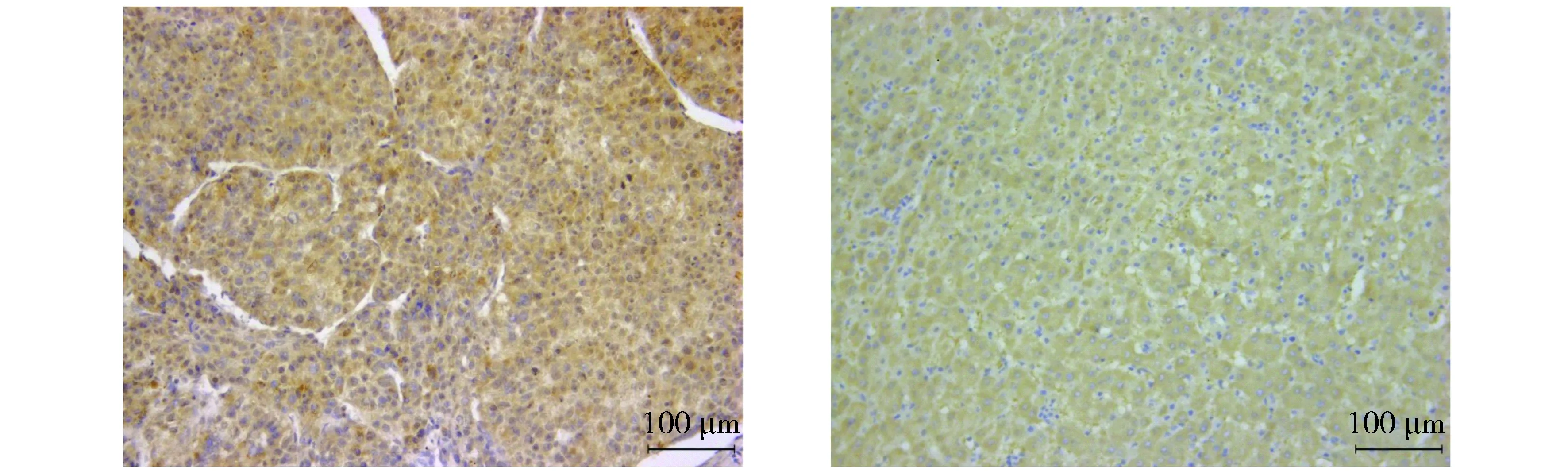
A.ARID2在癌组织中高表达 B.ARID2在癌旁组织低表达,阳性染色位于细胞核图1 ARID2在HCC组织及癌旁组织中的表达水平Figure 1 Expression of ARID2 in HCC tissue and adjacent tissue
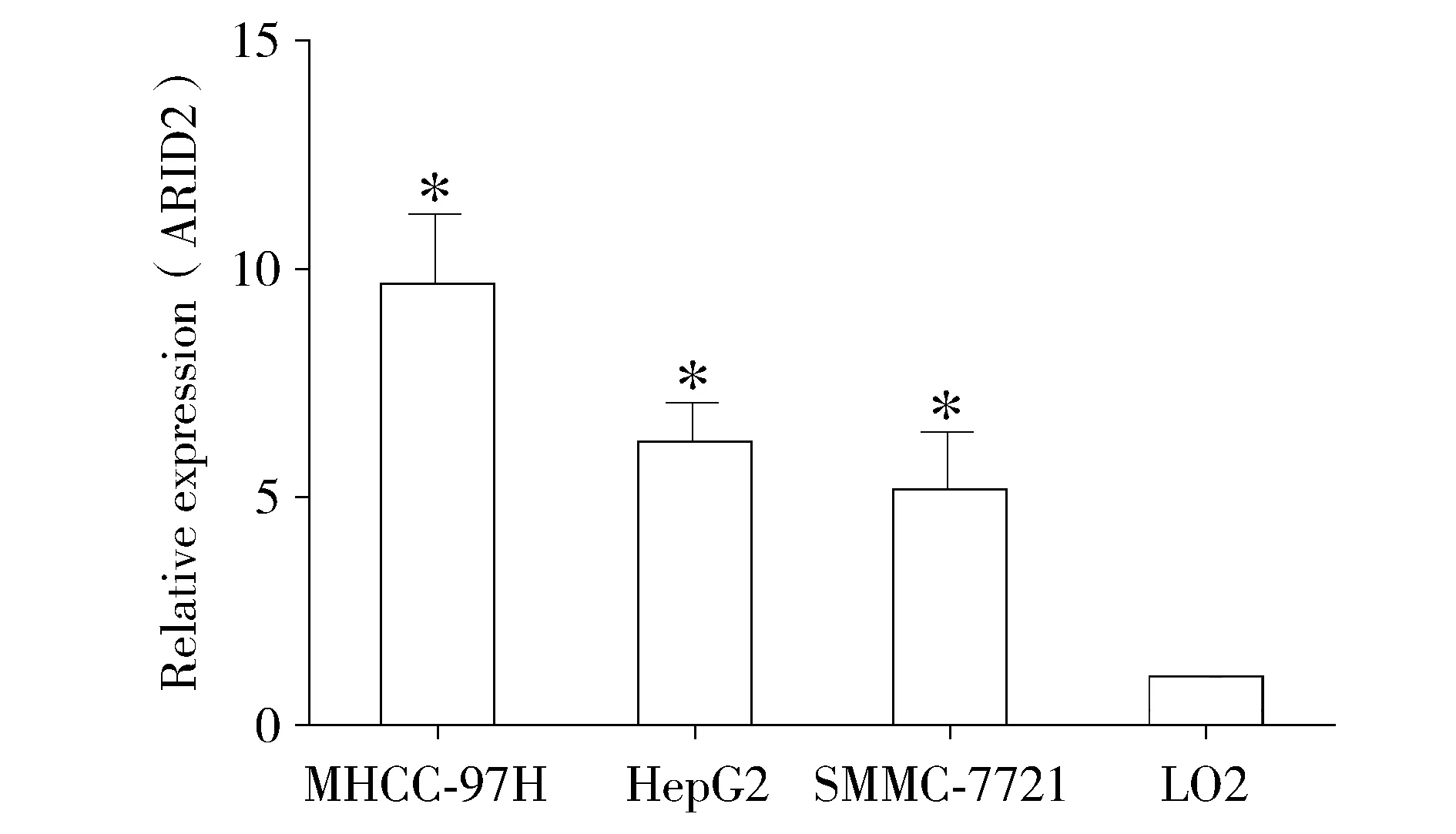
与LO2细胞比较,*P<0.05图2 ARID2在4种细胞株中的表达Figure 2 Expression of ARID2 in different HCC cell lines
2.3 qPCR筛选siRNA
si-RNA-101-3分别转染HepG2细胞后48 h收集总RNA,行qPCR实验检测ARID2的表达水平,实验重复3次。si-RNA-101组的灰度比值为0.763 4±0.148 1,对ARID2的表达有明显抑制作用(P<0.01,见图3)。
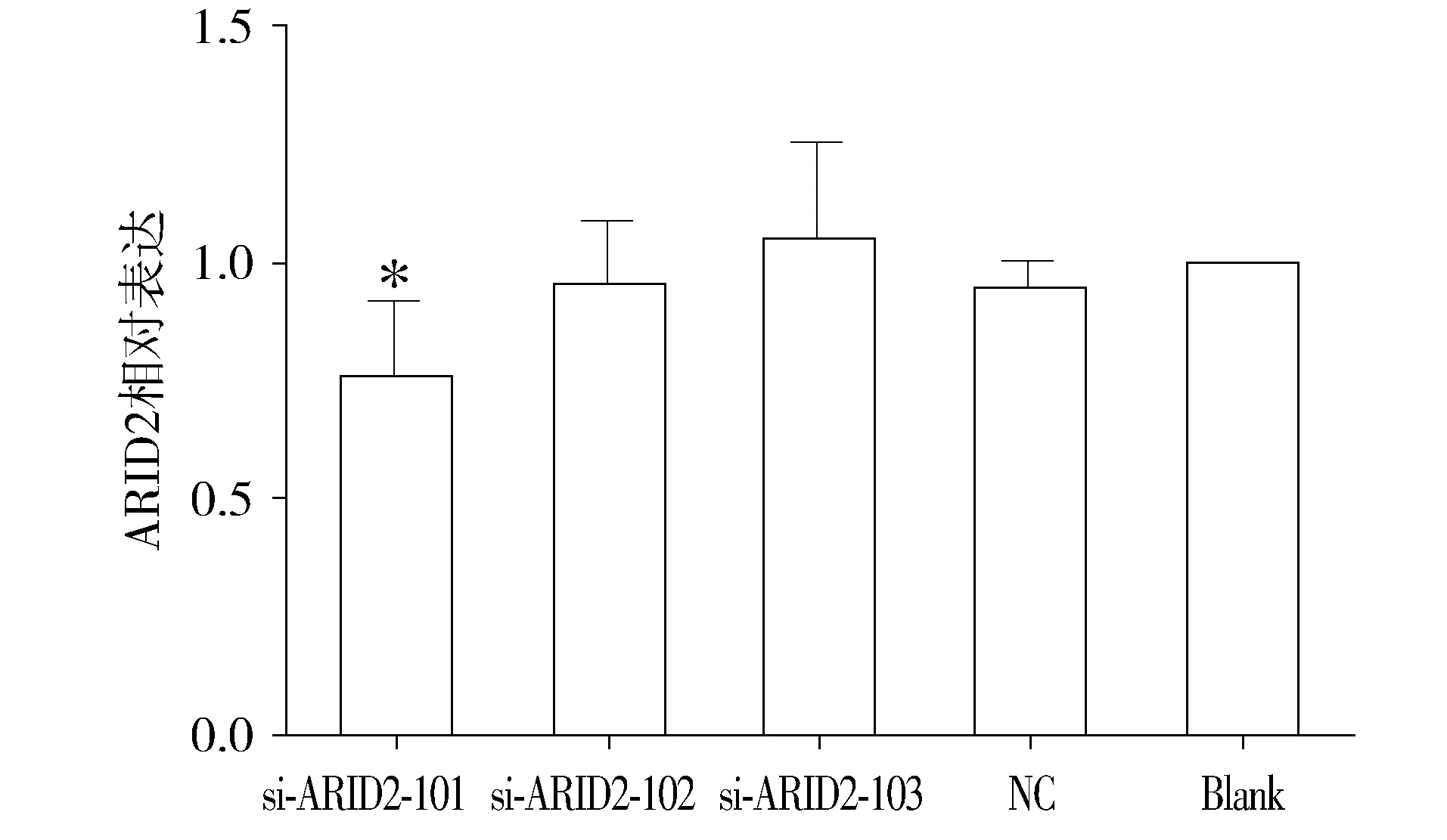
与其他四组比较,*P<0.01图3 siRNA干扰后HepG2中ARID2的表达Figure 3 Expression of ARID2 in HepG2 after siRNA interference
2.4 siRNA干扰后细胞增殖情况
MTT结果显示,与对照组NC相比较,ARID2基因被沉默后HepG2细胞系增殖能力降低,转染24 h、48 h无显著差异,在72h时肿瘤细胞增殖能力显著下降(0.686 9±0.124 5)与NC组比较具有明显差异(P<0.05,见图4)。结果显示沉默ARID2基因后可抑制HepG2细胞系增殖。
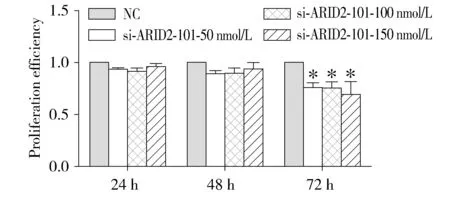
与NC组比较,*P<0.05图4 MTT检测HepG2细胞株ARID2基因沉默后细胞增殖情况Figure 4 Cell proliferationof HepG2 cell line after ARID2 gene silencing by MTT
2.5 siRNA干扰后细胞周期情况
流式细胞仪检测结果见图5。与阴性对照组比较,沉默了ARID2基因后HepG2细胞株G1期明显增多[(82.33±3.11)%vs(68.22±2.71)%,P<0.01],S期细胞明显减少[(26.42±2.10)%vs(12.33±2.21)%,P<0.01],说明大量细胞阻滞在G1期。结果表明下调ARID2的表达具有抑制肝癌细胞G1/S转化的作用。
3 讨论
ARID2属于ARID家族,是从一种参与依赖配体的核受体转录激活的SWI/SNF染色质重塑复合物PBAF中被分离鉴定出来的[5]。SWI/SNF复合物是一种进化保守的多亚单位的染色质重塑复合物,对染色质重塑起着决定性作用,能够利用ATP水解产生的能量动员核小体,使染色质重构,从而调节靶基因的转录,控制多种生物学过程包括细胞增殖和生长抑制[6]。越来越多的研究证实了这种复合物在肿瘤发生中的作用,它的几个亚单位具有内在的肿瘤抑制因子活性,或者是肿瘤抑制基因激活所必需的。目前部分研究认为ARID2基因是抑癌基因,在多种癌组织内呈低表达[7-10],但肝癌组织内仍存在不同[11],本实验中ARID2在HCC组织及细胞中高表达,并且通过siRNA干扰HepG2细胞中的ARID2表达,MTT结果显示HepG2增殖能力显著下降,流式细胞仪显示HepG2细胞停滞于G1期,可能与以下机制相关。
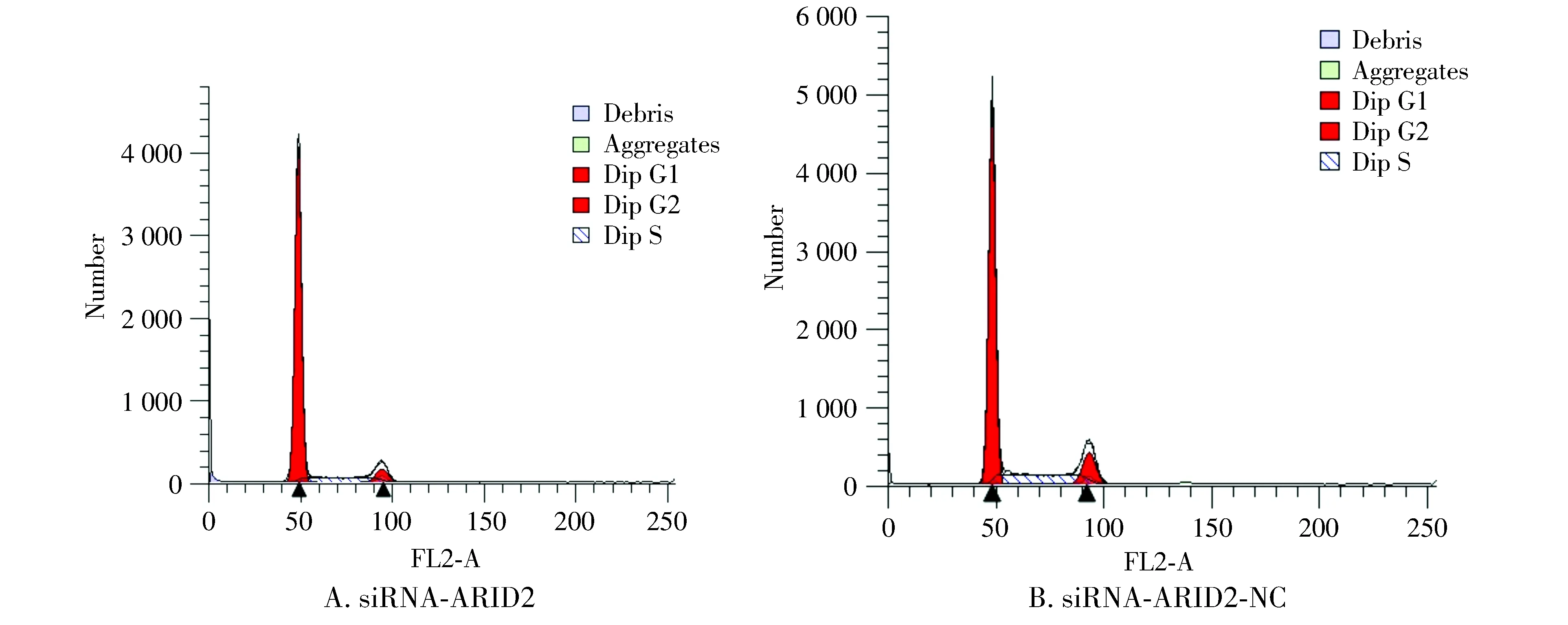
图5 流式细胞术测定ARID2基因沉默后HepG2细胞周期Figure 5 Cell cycle of HepG2 after ARID2 gene silencing by flow cytometry
ARID2为PBAF复合物组件之一,一种SWI/SNF染色质重构复合物,作用于核受体引起的配体依赖型转录激活。功能分析显示通过siRNA抑制ARID2转录,无论在肝癌细胞还是正常肝细胞中,导致干扰素α诱导性跨膜蛋白1(IFITM1)基因转录降低,而IFITM1对于干扰素诱导的抗增殖活性的发挥是必需的[12]。ARID2的突变导致在IFN信号传导中相关基因表达的缺失,进而使得肝炎病毒感染的宿主细胞逃过干扰素介导的抗增殖活性,那么ARID2突变的被感染宿主细胞就有可能丧失高表达MHC Ⅰ型抗原分子的能力,而无法应答干扰素信号,以至于效应型T淋巴细胞无法识别。
Zhao等[12]的研究显示,ARID2不是直接影响肿瘤细胞增殖的基因,其抑癌基因功能主要体现在提高了干扰素介导的抗肿瘤细胞增殖。一般和HCC相关的ARID2的研究是看突变率,将其作为肿瘤检测的标志基因,认为肝癌细胞中ARID2突变率高(无意突变,缺失突变)导致失活。所以检测ARID2在肝癌细胞系中转录水平表达量,结果是高低不一(有高的,也有低的)[11]。据此,敲除ARID2来检测细胞增殖,因为没有外界压力(干扰因素),所以ARID2的功能并不能在增殖结果中体现,也就是抑制ARID2,HCC被抑制。细胞周期同样如此。
本实验证明了HCC中ARID2的表达增加,降低ARID2的表达与HCC的增殖降低及细胞周期的停滞具有相关性,ARID2可作为重要的生物标志物,靶向干预ARID2,可影响HCC的增殖与细胞周期。
参考文献:
[1]Hu J, Yuan R, Huang C,etal. Double primary hepatic cancer (hepatocellular carcinoma and intrahepatic cholangiocarcinoma) originating from hepatic progenitor cell: a case report and review of the literature[J]. World J Surg Oncol, 2016, 14(1):218.
[2]Bouda D, Lagadec M, Alba CG,etal. Imaging review of hepatocellular carcinoma after thermal ablation: The good, the bad, and the ugly[J]. J Magnetic Res Imaging, 2016, 44(5):1070-1090.
[3]Arslanoglu A, Seyal AR, Sodagari F,etal. Current guidelines for the diagnosis and management of hepatocellular carcinoma:a comparative review[J].AJR Am J Roentgenol,2016,207(5):W1.
[4]Yan H, Zhong G, Xu G,etal. Sodium taurocholatecotransporting polypeptide is a functional receptor for human hepatitis B and D virus[J]. Elife, 2012, 1(1):e00049.
[5]Yan Z, Cui K, Murray DM,etal. PBAF chromatin-remodeling complex requires a novel specificity subunit, BAF200, to regulate expression of selective interferon-responsive genes[J]. Genes Dev, 2005, 19(14):1662-1667.
[6]Reisman D,Glaros S,Thompson EA.The SWI/SNF complex and cancer[J]. Oncogene, 2009, 28(14):1653-1668.
[7]Duan Y, Ling T, Gao Q,etal. Chromatin remodeling gene ARID2 targets cyclin D1 and cyclin E1 to suppress hepatoma cell progression[J]. Oncotarget, 2016, 7(29):45863-45875.
[8]Aso T, Uozaki H, Morita S,etal. Loss of ARID1A, ARID1B, and ARID2 expression during progression of gastric cancer[J]. Anticancer Res, 2015, 35(12):6819-6827.
[9]Warner WA, Wong DJ, Palma-Diaz F,etal. Clinicopathological and targeted exome gene features of a patient with metastatic acinic cell carcinoma of the parotid gland harboring an ARID2 nonsense mutation and CDKN2A/B deletion[J]. Case Rep Oncol Med, 2015,2015:893694.
[10]You J, Yang H, Lai Y,etal. ARID2, p110alpha, p53, and beta-catenin protein expression in hepatocellular carcinoma and clinicopathologic implications[J]. Hum Pathol, 2015, 46(7):1068-1077.
[11]姬旭慧,张玲,张江波,等.原发性肝细胞癌细胞系和组织中ARID2的表达[J].郑州大学学报(医学版),2013,48(6):786-788.
[12]Zhao H, Wang J, Han Y,etal. ARID2: a new tumor suppressor gene in hepatocellular carcinoma[J]. Oncotarget, 2011, 2(11):886-891.
