MicroRNA-29a对人正常滋养细胞迁移和侵袭功能的影响及其可能的机制
2018-04-10莫玉俏卢敏陈小菊
莫玉俏,卢敏,陈小菊
(海南省人民医院 产科,海南 海口 570311)
子痫前期是妊娠期特有疾病,以妊娠20周后出现高血压、蛋白尿为主要特征,可伴有全身多器官功能的损害或衰竭,严重患者可以出现抽搐、昏迷甚至死亡[1],对孕产妇和围生儿造成严重危害。子痫前期的发病机制尚不明确[2],但子痫前期患者的临床症状在胎盘娩出后消失的这一现象提示发育异常的胎盘在子痫前期发病过程中扮演着重要角色[3]。目前认为滋养细胞的侵蚀不良与子痫前期患者存在的胎盘浅着床和螺旋动脉重铸障碍密切相关[4]。
MicroRNA(miRNA)是一类存在于生物体中可以调控基因表达的内源性非编码小分子RNA,通过降解靶基因mRNA或阻止其蛋白翻译对靶基因进行调节[5]。近年来研究表明,子痫前期患者胎盘组织及外周血中存在着大量异常表达的miRNA[6-7],影响滋养细胞的增殖、侵袭等生物学功能,与子痫前期的发生发展密切相关[8-10]。miR-29a是较早发现的miRNA之一,miR-29a在多种肿瘤中表达异常,并且与肿瘤细胞的增殖、凋亡、迁移及侵袭能力密切相关[11-14],但miR-29a对滋养细胞迁移、侵袭等细胞生物学功能是否有影响尚不明确。近期LI等[15]在对子痫前期孕妇与正常孕妇的血浆miRNA表达谱进行比较时发现,子痫前期孕妇血浆中miR-29a表达增高,并应用实时聚合酶链反应(real-time PCR)进行了验证,但miR-29a在子痫前期孕妇胎盘组织中的表达情况尚不明确。本研究检测miR-29a在子痫前期和正常孕妇胎盘组织中的表达情况,在体外建立高表达miR-29a的滋养细胞系模拟子痫前期孕妇胎盘组织中miR-29a的高表达状态,并分析过表达miR-29a对滋养细胞迁移、侵袭能力的影响,以探讨miR-29a在子痫前期发生发展中可能的作用机制。
1 资料与方法
1.1 一般资料
选择2015年1月-2016年1月在海南省人民医院产科住院行剖宫产分娩的30例子痫前期孕妇为研究对象,并选择同期30例行剖宫产分娩的正常孕妇作为对照组。所有孕妇均为单胎初产,无烟、酒等特殊嗜好,无内外科合并症及其他产科合发症。子痫前期的诊断标准参照第8版《妇产科学》[16]。本次研究报医院伦理委员会批准,告知研究事项后均签署知情同意书。胎盘娩出后,在母体面胎盘中央区以以脐带为中心剪取大小约1 cm×1 cm×1 cm的胎盘组织,避开机化、钙化或出血灶。将所有收集的组织在离体20 min内置于液氮速冻,-80℃保存备用。
1.2 细胞与试剂
人正常滋养细胞系HTR8/Svneo购自ATCC中国细胞库。hsa-miR-29amimics及mimics-NC均购自上海吉凯基因公司,逆转录试剂盒及real-time PCR试剂盒购自日本TaKaRa公司,miR-29a及U6引物由上海吉凯基因公司设计合成,Trizol试剂和脂质体2000(LipofectamineTM2000)购自美国Invitrogen公司,鼠抗人ITGB1、GAPDH单克隆抗体和辣根过氧化物酶标记的兔抗鼠IgG均购自美国Abcam公司,Transwell小室购自美国Costar公司,Matrigel胶购自美国BD公司。
1.3 方法
1.3.1生物信息学分析采用TargetScan(www.targetscan.org)和miRanda(www.microrna.org)生物信息学在线预测软件分析miR-29a的靶基因。
1.3.2细胞培养人正常滋养细胞系HTR8/Svneo培养在含10%胎牛血清的RPMI1640培养基中,37℃、5%二氧化碳CO2饱和湿度培养箱中培养,细胞呈贴壁生长。
1.3.3细胞转染取对数生长的HTR8/Svneo细胞接种于6孔板培养,细胞密度至60%~70%,严格按Lipofectamine 2000试剂盒操作说明书进行转染操作,将miR-29a mimics及阴性对照(mimics-NC)转染HTR8/Svneo细胞,实验分为miR-29a mimics组(转染miR-29a mimics的HTR8/Svneo细胞)、mimics-NC组(转染 mimics-NC的HTR8/Svneo细胞)及空白对照组(未进行转染操作的自然生长HTR8/Svneo细胞)。
1.3.4real-time PCR检测胎盘组织及细胞系miR-29a的表达使用TRizol试剂从组织或细胞中提取总RNA,测定浓度及纯度合格后,严格按照逆转录试剂盒说明书操作进行逆转录合成cDNA。取cDNA按Real-PCR试剂盒说明书配置反应体系进行real-time PCR反应,反应条件:预变性94℃ 2 min,变性94℃20 s,退火延伸60℃ 30 s,扩增40个循环。以U6作为内参基因,实验重复3次,miR-29a表达量数值采用2-△△Ct法计算。
1.3.5Western blot检测转染后HTR8/Svneo细胞ITGB1蛋白的表达收集对数生长期的细胞,用蛋白裂解液提取细胞总蛋白,BCA法测定蛋白样品浓度。每孔取40μg蛋白上样,SDS-聚丙烯酰胺凝胶上电泳30 min,加入5%脱脂奶粉溶液,室温封闭2 h后,加入适当浓度一抗,4℃反应过夜后,次日洗膜后,再加入辣根过氧化物酶标记的二抗,室温孵育2 h,洗膜后,将膜置于ECL化学发光中,凝胶成像系统显影,以ITGB1蛋白条带灰度值与GAPDH蛋白条带灰度值的比值表示ITGB1蛋白的相对表达量。
1.3.6划痕实验检测转染后HTR8/Svneo细胞迁移能力的变化取转染24 h后各组HTR8/Svneo细胞,用10μl枪头在孔板中心轴处沿直线轻轻划痕,PBS洗去漂浮细胞后继续培养,培养24 h,在显微镜下观察拍照记录0和24 h时刻划痕间距,以细胞划痕愈合百分比表示各组细胞的迁移能力。
1.3.7Transwell侵袭实验检测转染后HTR8/Svneo细胞侵袭能力的变化将Matrigel基质胶包被Transwell小室基底膜,收集转染24 h后各组HTR8/Svneo细胞,向上室加入含5×104个细胞,稀释于不含胎牛血清的RPMI1640培养液中,下室加入含10%胎牛血清的RPMI1640培养液,37℃、5%二氧化碳CO2饱和湿度培养24 h后取出,棉签擦净基质胶及上室面未迁移的细胞,甲醛固定,0.5%结晶紫染色,随机选取显微镜下5个不同视野计数穿出细胞数,取平均值,实验重复3次。
1.4 统计学方法
采用SPSS 20.0软件进行数据分析,计量资料以均数±标准差(±s)表示,两组间均数比较采用t检验,3组间均数比较采用单因素方差分析,采用SNK-q检验进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 两组孕妇临床特征的比较
两组患者在年龄、分娩孕周等临床特征方面比较差异无统计学意义(P>0.05),而在血压、新生儿出生体重等方面比较差异有统计学意义(P<0.05)。见附表。
2.2 两组孕妇胎盘组织中miR-29a的表达水平
Real-time PCR结果显示,子痫前期组孕妇胎盘组织中miR-29a表达水平高于对照组孕妇,差异有统计学意义(t=66.489,P=0.000)。见图1。
2.4 miR-29a靶基因的预测
通过TargetScan 和miRanda生物信息学在线预测软件预测miR-29a的靶基因,从2个软件得到的结果进行交集分析预测并综合分析,预测ITGB1是miR-29a的1个潜在靶基因,该基因的3’UTR中存在与miR-29a互补的结合位点。见图2。
2.5 转染后HTR8/Svneo细胞miR-29a的表达
Real-time PCR检测各组细胞miR-29a表达水平,经单因素方差分析,差异有统计学意义(F=1 230.78,P=0.000),各组miR-29a表达水平有差别;进一步两两比较显示,miR-29a mimics组细胞miR-29a的表达水平高于mimics-NC组和空白对照组(q=60.862,P=0.000;q=60.667,P=0.000);mimics-NC组miR-29a的表达水平与空白对照组比较,差异无统计学意义(q=0.196,P=0.903)。见图 3。
2.6 转染后HTR8/Svneo细胞ITGB1蛋白表达水平的变化
Western blot检测各组细胞ITGB1蛋白表达水平,经单因素方差分析,差异有统计学意义(F=31.200,P=0.004),各组ITGB1蛋白表达水平差异有统计学意义;进一步两两比较显示,miR-29a mimics组细胞中ITGB1蛋白表达低于mimics-NC组和空白对照组(q=9.369,P=0.001;q=9.954,P=0.000);mimics-NC组ITGB1蛋白的表达水平与空白对照组比较,差异无统计学意义(q=0.586,P=0.213)。见图4。
附表 两组孕妇临床特征 (n =30,±s)
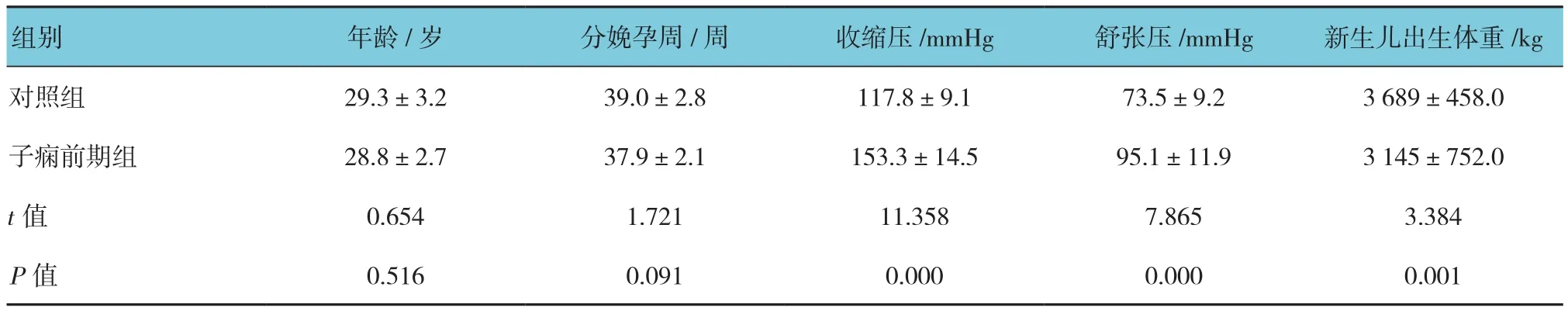
附表 两组孕妇临床特征 (n =30,±s)
组别 年龄/岁 分娩孕周/周 收缩压/mmHg 舒张压/mmHg 新生儿出生体重/kg对照组 29.3±3.2 39.0±2.8 117.8±9.1 73.5±9.2 3 689±458.0子痫前期组 28.8±2.7 37.9±2.1 153.3±14.5 95.1±11.9 3 145±752.0 t值 0.654 1.721 11.358 7.865 3.384 P值 0.516 0.091 0.000 0.000 0.001
2.7 转染后HTR8/Svneo细胞迁移能力的变化

图1 胎盘组织中miR-29a的相对表达量

图2 miR-29a靶基因的预测

图3 3组HTR8/Svneo细胞中miR-29a的相对表达量
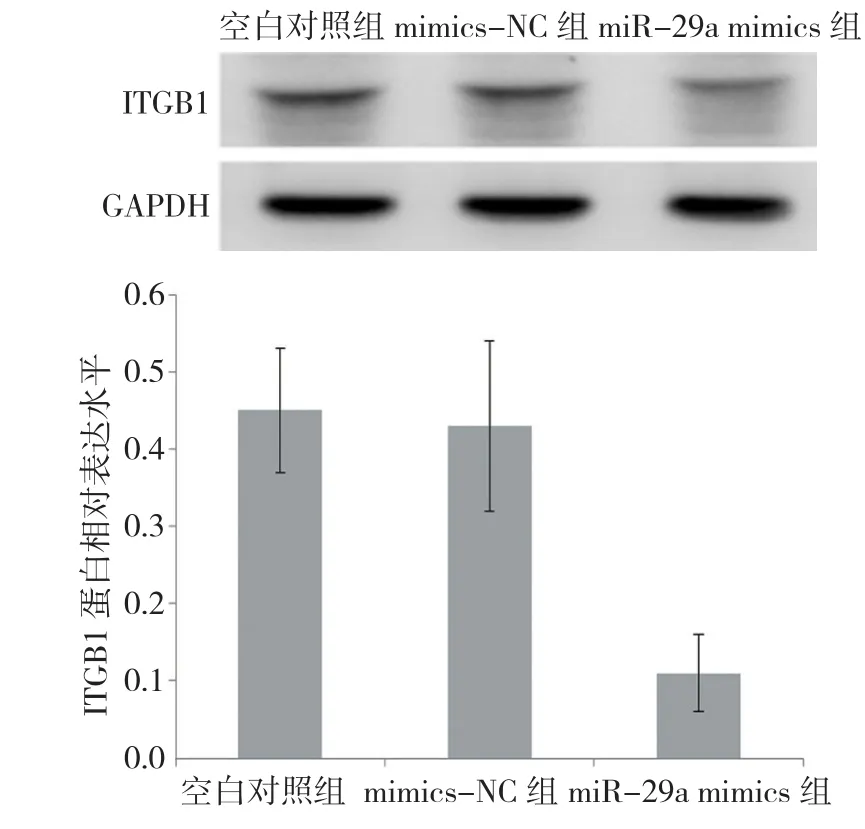
图4 3组HTR8/Svneo细胞ITGB1蛋白的相对表达
划痕实验显示3组细胞的划痕愈合百分比分别为:miR-29a mimics组(50.2±4.4)%,mimics-NC组(75.6±4.6)%,空白对照组(76.1±5.1)%,3组比较差异有统计学意义(F=59.350,P=0.000)。进一步两两比较显示,miR-29a mimics组细胞划痕修复能力低于mimics-NC组和空白对照组(q=13.212和13.472,均P=0.000);mimics-NC组和空白对照组比较,差异无统计学意义(q=0.260,P=0.301)。见图5。
2.8 转染后HTR8/Svneo细胞侵袭能力的变化
侵袭试验显示3组细胞穿入下层小室的细胞数目分别为:miR-29amimics组(22±5)个/HP,mimics-NC组(65±10) 个 /HP;空 白 对 照 组(61±11)个/HP,3组比较差异有统计学意义(F=41.290,P=0.000)。进一步两两比较显示,miR-29a mimics组细胞数少于mimics-NC组和空白对照组(q=11.632和10.550,均P=0.000);mimics-NC组和空白对照组比较,差异无统计学意义(q=1.082,P=0.189)。见图6。
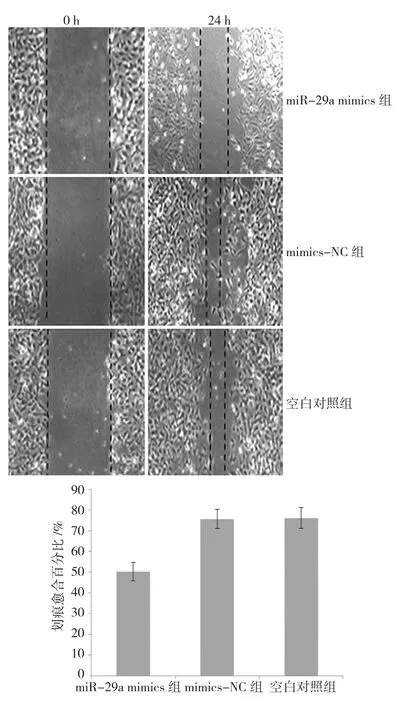
图5 3组HTR8/Svneo细胞划痕愈合百分比

图6 3组HTR8/Svneo细胞侵袭实验细胞数目
3 讨论
子痫前期是妊娠期孕妇合并症,是孕产妇及围生儿死亡的主要原因,具体的发病机制至今尚不明确,阻碍了该疾病的预后和治疗。目前较一致的看法认为血管重铸不足和胎盘功能障碍与子痫前期有关,其中胎盘滋养细胞浸润功能下降是导致胎盘浅着床和螺旋动脉重铸失败的原因之一。近年来研究发现,子痫前期孕妇胎盘与正常孕妇胎盘相比,存在着一些特异性、异常表达的microRNA,提示microRNA表达的变化可能参与的子痫前期的发生发展,为探索子痫前期的发病机制提供了新的思路。
miR-29a位于染色体7q32.3负链的普通型脆性位点FRA7H内,目前有关miR-29a在恶性肿瘤方面的研究较多。LIU等[11]在研究中发现,miR-29a通过靶向ROBO1调控胃癌细胞的迁移侵袭功能。HAN等[12]发现miR-29a通过靶向CEACAM1调控肺腺癌细胞的增殖、迁移及侵袭行为。但miR-29a是否与滋养细胞的迁移、侵袭功能相关,目前尚未见报道。本研究发现miR-29a在子痫前期孕妇胎盘组织中表达水平较正常孕妇增高,因此推测miR-29a的高表达可能与滋养细胞迁移侵袭能力的下降有关。
为了验证miR-29a的高表达与人正常滋养细胞迁移侵袭能力的关系,本研究应用细胞转染技术,对人正常滋养细胞HTR8/Svneo转染miR-29a模拟物后,细胞中miR-29a表达水平增高,成功模拟了子痫前期孕妇胎盘组织中miR-29a的高表达状态,同时划痕实验和Transwell侵袭实验证实人正常滋养细胞HTR8/Svneo中miR-29a表达水平增高后,细胞的迁移和侵袭能力出现相应的下降,证实子痫前期孕妇胎盘组织miR-29a的高表达与其滋养细胞迁移侵袭能力下降有关。
进一步研究miR-29a调控人正常滋养细胞迁移侵袭的机制,本研究应用目前常用的miRNA靶基因预测软件TargetScan 和miRanda对miR-29a的靶基因进行预测,综合分析,最终选定ITGB1作为候选靶基因进行研究。本研究发现对人正常滋养细胞HTR8/Svneo转染miR-29a模拟物后,细胞中miR-29a表达水平增高,Western blot显示ITGB1蛋白表达水平降低,说明miR-29a与ITGB1之间存在负向调控关系,后续的实验将通过双荧光素酶报告基因实验对miR-29a与ITGB1之间的靶向调控关系进行进一步的验证。ITGB1是细胞黏附分子家族中重要的一类分子,是介导细胞与细胞外环境(如细胞外基质、ECM等)之间连接的跨膜受体,并且其可以促进基质金属蛋白酶的活化及分泌,降解ECM,促进细胞的迁移与侵袭[17-18]。JIANG等[19]通过基因芯片技术发现ITGB1、UBB、PIK3R1、MAPRE1及VEGFA基因参与了子痫前期的病理进程。LI等[20]在研究中通过real-time PCR证实子痫前期孕妇胎盘组织中ITGB1、MCL1、MMP2及VEGFA的表达水平较健康对照组降低,提示子痫前期孕妇胎盘组织中ITGB1的表达降低与子痫前期密切相关。子痫前期孕妇胎盘组织中miR-29a的高表达负向调控ITGB1的表达,造成ITGB1低表达,从而使滋养细胞迁移及侵袭能力下降,参与子痫前期的发生发展。
综上所述,miR-29a在子痫前期孕妇胎盘组织中高表达,增高滋养细胞miR-29a表达能降低滋养细胞迁移及侵袭能力,其调控机制可能与miR-29a对ITGB1的表达的负向调控有关,为子痫前期发病机制的研究及子痫前期的诊疗提供了新的思路。
参 考 文 献:
[1]CRAICIIM, WAGNERSJ, WEISSGERBERTL, et al. Advances in the path physiology of pre-eclampsia and related podocyteinjury[J].Kidney Int, 2014, 86(2): 275-285.
[2]STEEGERSEA, VONDADELSZENP, DUVEKOTJJ, et al. Preeclampsia[J]. Lancet, 2010, 376(9741): 631-644.
[3]KIM Y J. Pathogenesis and promising non-invasive markers for preeclampsia[J]. ObstetGynecol Sci, 2013, 56(1): 2-7.
[4]TAL R. The role of hypoxia and hypoxia-inducible factor-1Alpha in preeclampsiapathogenesis[J]. Biology of Reproduction, 2012,87(6): 1-8.
[5]BARTEL D P. MicroRNAs: genomics, biogenesis, mechanism,andfunction. Cell, 2004, 116(2): 281-297.
[6]CHOI S Y, YUNJ, LEEOJ, et al. MicroRNA expression profiles in placenta with severe preeclampsia using a PNA-based microarray[J]. Placenta, 2013, 34(9): 799-804.
[7]BETONIJS, DERRK, PAHLMC, et al. MicroRNA analysis in placentas from patients with preeclampsia:comparison of new and published results[J]. Hypertens Pregnancy, 2013, 32(4): 321-339.
[8]DORIDOT L, MIRALLES F, BARBAUX S, et al. Trophoblasts,invasion, andmicroRNA[J]. Front Genet, 2013(4): 248.
[9]SUN M, CHEN H, LIU J, et al. MicroRNA-34a inhibits human trophoblast cell invasion by targeting MYC[J]. BMC Cell Biol,2015(16): 21.
[10]DING J, HUANG F, WU G, et al. MiR-519d-3p suppresses invasion and migration of trophoblast cells via targeting MMP-2[J]. PLoS One, 2015, 10(3): e0120321.
[11]LIU X, CAI J, SUN Y, et al. MicroRNA-29a inhibits cell migration and invasion via targeting Roundabout homolog 1 in gastric cancer cells[J]. Mol Med Rep, 2015, 12(3): 3944-3950.
[12]HAN H S, SON S M, YUN J, et al. MicroRNA-29a suppresses the growth, migration, and invasion of lung adenocarcinoma cells by targeting carcinoembryonic antigen-related cell adhesion molecule 6[J]. FEBS Lett, 2014, 588(20): 3744-3750.
[13]CHEN L, XIAO H, WANG Z H, et al. miR-29a suppresses growth and invasion of gastric cancer cells in vitro by targeting VEGFA[J]. BMB Rep, 2014, 47(1): 39-44.
[14]刘永敏, 段萍, 鄢文海, 等. 过表达microRNA-29a上调锌脂蛋白91对大鼠肾上腺嗜铬细胞瘤细胞凋亡的影响[J]. 中国现代医学杂志, 2016, 26(11): 18-23.
[15]LI H, GE Q, GUO L, et al. Maternal Plasma miRNAs Expression in Preeclamptic Pregnancies[J]. Biomed Res Int, 2013, 2013:970265.
[16]谢幸, 苟文丽. 妇产科学[M]. 第8版. 北京: 人民卫生出版社,2013: 64-73.
[17]WANG L, ZHANG Y, LV W, et al. Long non-coding RNA Linc-ITGB1 knockdown inhibits cell migration and invasion in GBCSD/M and GBC-SD gallbladder cancer cell lines[J]. ChemBiol Drug Des, 2015, 86(5): 1064-1071.
[18]MORI H, LO A T, INMAN J L, et al. Transmembrane/cytoplasmic, rather than catalytic, domains of Mmp14 signal to MAPK activation and mammary branching morphogenesis via binding to integrin β1[J]. Development, 2013, 140(2): 343-352.
[19]JIANG F, YANG Y, LI J, et al. Partial least squares-based gene expression analysis in preeclampsia[J]. Genet Mol Res, 2015,14(2): 6598-6604.
[20]LI P, GUO W, DU L, et al. microRNA-29b contributes to preeclampsia through its effects on apoptosis, invasion and angiogenesis of trophoblastcells[J]. ClinSci (Lond), 2013, 124(1):27-40.
