脐带间充质干细胞对辐射损伤小鼠造血功能的影响
2018-04-09颜贺欣李伟韦立顺宋永红单铁英高鹏杨以会乔俊红
颜贺欣,李伟,韦立顺,宋永红,单铁英,高鹏,杨以会,乔俊红
1.河北工程大学 医学院,河北 邯郸 056002;2.河北工程大学 附属医院,河北 邯郸 056002;3.军事科学院 军事医学研究院 生物安全处,北京 100071
伴随科学技术的快速发展,日常生活里人们不可避免地要接触放射性电离辐射,例如核作业人员、临床上的放射性治疗手段以及生活中的低剂量辐射。长期的电离辐射会对人体器官脏器的机能造成损伤,例如辐射后造血功能降低、器官组织形态改变、代谢功能改变,以及生物膜、酶活性和微循环的改变等[1]。目前,对放射性电离辐射的研究热点是寻求有效的无副作用的治疗手段和方法,探讨放射性电离辐射产生的损伤。脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSC)是一类多功能干细胞,可从大部分结缔组织和器官间质中提取到。UCMSC有非常强大的功能,包括自我更新和自我复制的功能,多向分化潜能和在特定环境下定向分化增殖为各种组织和器官细胞的功能,免疫调节功能,具有分化度低、有丝分裂低、DNA分离不对称等特征[2]。基于这些特性,UCMSC在辐射性损伤的治疗中有很大进展,是用于辐射医学治疗的理想选择。我们通过制作小鼠电离辐射损伤模型,观察量化指标,探究UCMSC对辐射损伤小鼠造血功能的防护作用。
1 材料和方法
1.1 材料
清洁级SD小鼠(雄性,8周龄,体重20±2 g)购自青岛药检所动物中心,所有动物经检疫符合实验动物标准,试验期间在室温18~22℃、湿度45%~65%的标准鼠房环境中统一饲养,整个试验过程都严格遵循《实验动物管理条例》。
UCMSC悬浮液来自清华大学深圳研究生院;超氧化物歧化酶(SOD)和丙二醛(MDA)测定试剂盒购自南京建成生物工程研究所;PBS缓冲液购自武汉博士德生物工程有限公司;7200型全自动生化分析仪为日本岛津公司产品;放射源为青岛大学附属医院放疗科直线加速器;UV757CRT型紫外分光光度计为上海精科公司产品;酶标仪为天津瑞泽公司产品。
1.2 实验动物模型的建立
采用2 Gy剂量的医用直线加速器对小鼠进行全身照射。
1.3 实验动物分组
将80只雄性清洁级小鼠随机平均分为4组,即正常组(不干预)、放射组(照射,不予治疗)、普通组(照射后12 h尾静脉注射UCMSC悬浮液)和加强组(照射后12和24 h,2次给予UCMSC悬浮液)。
1.4 外周血细胞测定
各阶段采集血液标本前小鼠禁食12 h,次日腹腔注射10%水合氯醛麻醉后,将其仰卧固定于手术台上,碘伏消毒颈部至腹部皮肤,沿腹正中线剪开皮肤和腹膜,推移肠管暴露后腹膜,钝性分开,剖开胸,经心脏用一次性抗凝真空采血管于无菌条件下取血1~2 mL并混匀,2 h内送血标本上机检查血常规;取0.5 mL全血于自动血球分析仪进行细胞计数,剩余血样室温静置40 min后4000 r/min离心10 min,取上层血清于冻存管中,-80℃冰箱保存。离心后所收集血清用来测定SOD活性和MDA含量。
1.5 统计学处理
数据采用SPSS17.0软件进行统计分析,计量资料以x±s表示。组间比较用单因素方差分析和t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 各组小鼠辐射损伤后白细胞数的变化
血常规结果显示,小鼠辐射损伤后白细胞总数明显下降,与正常组相比差别显著(P<0.05);与对照组比较,注射UCMSC后普通组和加强组小鼠白细胞总数显著增高,差别显著(P<0.05)。结果见表1。
2.2 各组小鼠辐射损伤后淋巴细胞数的变化
小鼠辐射损伤后淋巴细胞总数明显下降,与正常组相比差别显著(P<0.05);与对照组比较,注射UCMSC后普通组和加强组小鼠淋巴细胞总数显著增高,差别显著(P<0.05)。结果见表2。
2.3 各组小鼠辐射损伤后红细胞数的变化
小鼠辐射损伤后红细胞总数明显下降,与正常组相比差别显著(P<0.05);与对照组比较,注射UCMSC后普通组和加强组小鼠红细胞总数显著增高,差别显著(P<0.05)。结果见表3。
2.4 各组小鼠辐射损伤后血红蛋白数的变化
小鼠辐射损伤后血红蛋白总数明显下降,与正常组相比差别显著(P<0.05);与对照组比较,注射UCMSC后普通组和加强组小鼠血红蛋白总数显著增高,差别显著(P<0.05)。结果见表4。
2.5 辐射后小鼠血清SOD活性和MDA含量检测
2.5.1 小鼠血清中的SOD活性 图1显示,放射组与正常组比较,血清SOD活性下降(P<0.01);普通组与放射组比较,血清SOD活性升高(P<0.05);加强组与普通组比较,SOD活性升高(P<0.01)。
2.5.2 小鼠血清中的MDA含量 图2显示,放射组与正常组比较,血清MDA含量下降(P<0.01);普通组与放射组比较,血清MDA含量升高(P<0.05);加强组与普通组比较,血清MDA含量升高(P<0.05)。
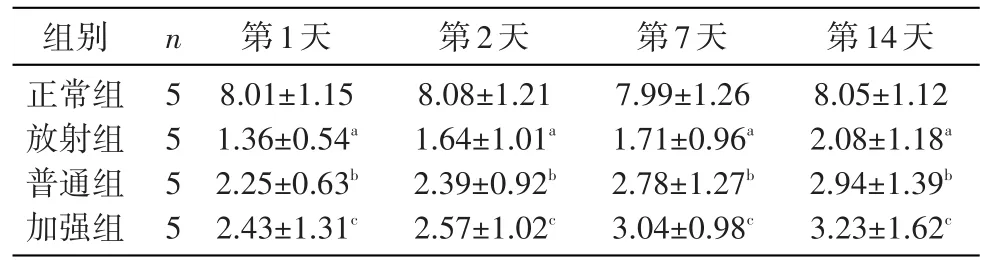
表1 不同组小鼠血常规检测白细胞计数(x±s,1012/L)
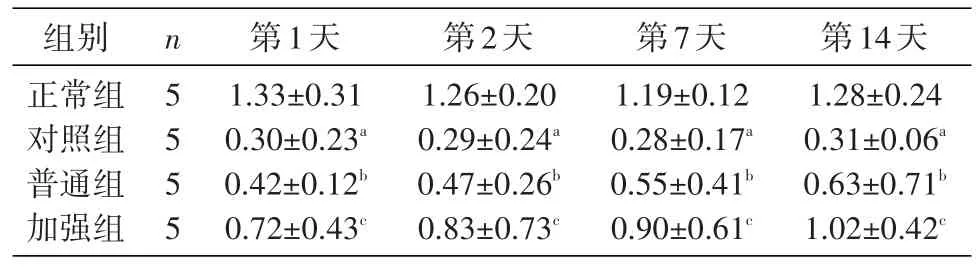
表2 不同组小鼠血常规检测淋巴细胞计数(x±s,109/L)
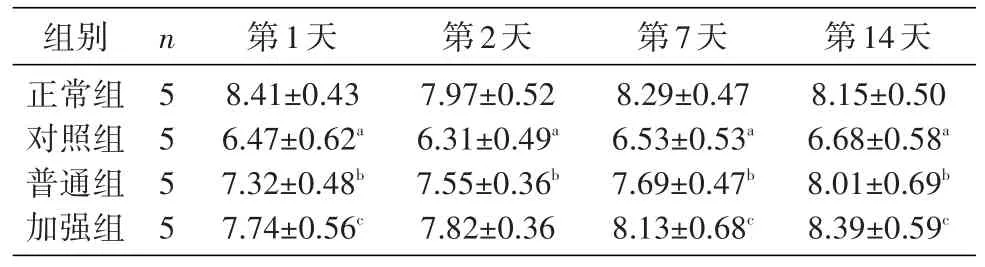
表3 不同组小鼠血常规检测红细胞计数(x±s,1012/L)

表4 不同组小鼠血常规检测血红蛋白计数(x±s,g/L)
3 讨论
全身辐射性损伤损害机体的各个系统,其中造血系统对辐射的敏感性很高,所以对造血系统的危害非常严重。电离辐射会破坏造血微环境和造血细胞的增殖能力[3],使机体的防御适应能力下降,免疫功能降低,不能维持正常的生命活动,严重时会出现出血、感染、休克甚至死亡[4]。辐射后机体细胞内产生自由基,它会破坏机体细胞的生物膜和核酸[5-6]。SOD具有超强的氧化作用,可以氧化自由基保护机体细胞,活性越高清除自由基的能力越强;MDA是氧化后降解的中间产物,对细胞有杀伤性,含量越低细胞损伤越小。机体受到电离辐射后,造血系统功能下降,外周血白细胞、红细胞、淋巴细胞减少,导致机体贫血,易发生感染等并发症,主要表现为造血综合征,同时出现细胞凋亡的现象[7-9]。因此,急需寻求有效的治疗方法,解决由辐射引起的造血系统损伤这一难题。
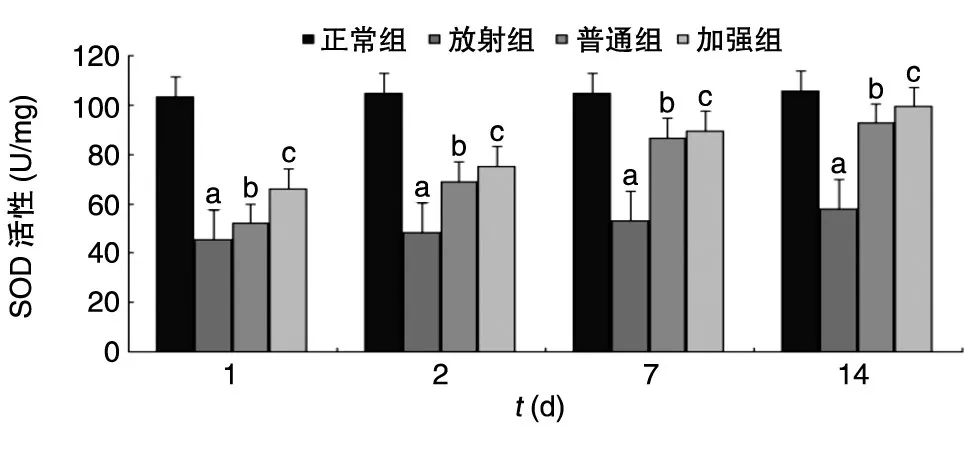
图1 辐射小鼠血清中SOD活性变化a:P<0.01;b:P<0.05;c:P<0.01
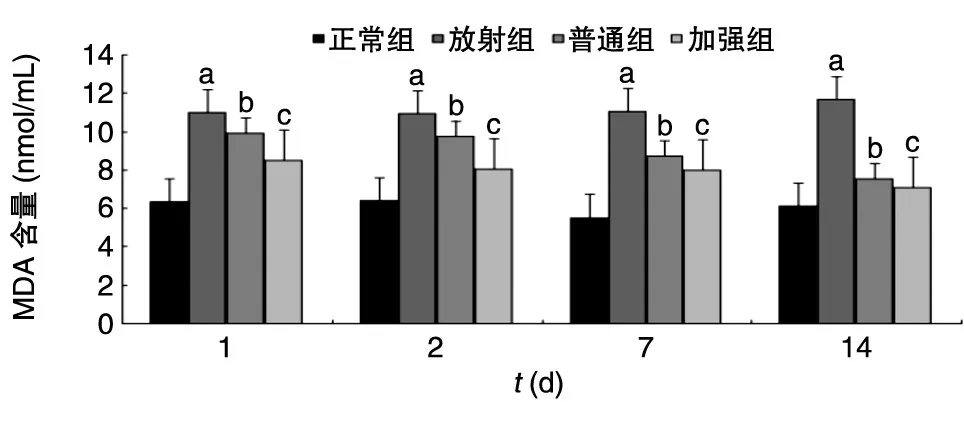
图2 辐射小鼠血清中MDA含量变化a:P<0.05;b:P<0.05;c:P<0.01
目前针对放射性损伤的治疗方法主要是药物治疗,例如抗生素、中草药的有效成分[10]、细胞因子及激素类等。近几年,具有独特生物学特性的间充质干细胞受到广大研究者的青睐,间充质干细胞在放射性损伤疾病的治疗中也展现了优势,它具有多向分化为成体干细胞的能力,能分泌一些特殊细胞因子,具有归巢到损伤的局部组织的能力。归巢到受损组织局部的UCMSC,在刺激因子[4]的作用下分化为相应组织细胞,促进损伤组织的再生和修复。它能分泌造血因子,重造造血环境,免疫原性低,在电离辐射损伤的临床治疗应用中具有非常广阔的前景。但间充质干细胞体外培养传代过程中体积增大,定向归巢到局部受损组织部位的数量很少,同时会出现堵塞血管的情况,影响治疗的效果。本实验采用的是经过高迁徙间充值干细胞三维培养体系培养传代的细胞,比传统培养细胞体积小70%,仍保持原有的特性和功能,避免出现上述问题[11]。
实验结果表明,注射UCMSC悬浮液的小鼠外周血细胞数比放射组小鼠有所增加,说明UCMSC在一定程度上改善了辐射对小鼠造血功能的损伤。UCMSC可以提高辐射小鼠血清中SOD的活性并显著降低血清中MDA的含量,说明UCMSC抑制了小鼠辐射性氧化损伤,对辐射引起的造血系统功能损伤有一定的防护作用。综上所述,脐带间充质干细胞可以改善受损的造血微环境,显示出良好的应用前景,为放射性疾病的治疗提供了新的途径,值得进一步探讨。
[1] 傅尚志.电离辐射对肝脏的损伤[J].国外医学·放射医学核医学分册,1999,21(4):188-191.
[2] 陈剑,徐锦常.角膜缘干细胞及其临床意义[J].国外医学·眼科学分册,1992,16(6):143-149.
[3] 周美娟,郑莉,丁振华.辐射对造血系统的影响[J].国外医学·放射医学核医学分册,2004,28(3):139-142.
[4] 宫黎明,方宁,陈代雄,等.人羊膜间充质干细胞在大鼠受损肝组织中分化为肝细胞[J].中国组织工程研究与临床康复,2011,36(15):6709-6713.
[5] Barbisan L F,Scolastici C,Miyamoto M,et al.Ef⁃fectsofcrudeextractsofAgaricusblazeion DNA damage and on rat liver carcinogenesis induced by di⁃ethylnitrosamine[J].Genet Mol Res,2003,2(3):295-308.
[6] Wel1s P G,Bhuller Y,Chen C S,et al.Molecular and biochemical mechanisms in teratogenesis involving reactive oxygen speciesi[J].ToxicolApplPharmacol, 2005,207(2 Suppl):354-366.
[7] 叶根耀.电离辐射对造血系统的影响[J].中华血液学杂志,1996,17(3):166-167.
[8] Mothersill C,Seymour C.Radiation-induced non-target⁃ed effects of low doses-what,why and how[J]?Health Phys,2011,100:302.
[9] Rodel F,Frey B,Gaipl U,et al.Modulation of inflam⁃matory immune reactions by low-dose ionizing radia⁃tion:molecular mechanisms and clinical application[J]. Curr Med Chem,2012,19(12):1741-1750.
[10]Schaue D,Jahns J,Hildebrandt G,et al.Radiation treatment of acute inflammation in mice[J].Radiat Bi⁃ol,2005,81(9):657-667.
[11]Pinar B,Henríquez-Hernández L A,Lara P C,et al. Radiation induced apoptosis and initial DNA damage are inversely related in locally advanced breast can⁃cer patients[J].Radiat Oncol,2010,5(85):1-5.
