谷氨酰胺酶1在结肠癌中的表达及其对细胞代谢重编程的影响
2018-04-09陶波龙曲璇张伟申亮亮张英起
陶波龙,曲璇,张伟,申亮亮,张英起
1.空军军医大学 药学院生物制药学教研室,陕西 西安 710032;2.陕西中医药大学,陕西 咸阳712046;3.空军军医大学 基础医学院生物化学与分子生物学教研室,陕西 西安 710032
结肠癌严重威胁着人类的健康,最新数据显示,在世界范围内,其发生率和致死率均位居第三[1]。寻找影响结肠癌发生的关键分子,对于其早期诊断和靶向治疗均具有重要意义。肿瘤代谢重编程的发生是其恶性演变的重要原因,细胞具有大量摄取葡萄糖和谷氨酰胺的特点,即使在有氧条件下也通过糖酵解通路产能,这种代谢方式称为Warburg效应[2-3]。谷氨酰胺酶1(glutamin⁃ase 1,GLS1)是调节谷氨酰胺代谢的关键酶,细胞摄取的谷氨酰胺经GLS1转变为谷氨酸,从而进入细胞内的代谢转变过程[4]。我们在结肠癌临床样本中检测了GLS1的表达状态,并通过siRNA干涉方式观察GLS1对细胞葡萄糖和谷氨酰胺的利用情况,为后续研究其生物学功能打下基础。
1 材料和方法
1.1 材料
HT29细胞和Caco2细胞购自美国ATCC细胞库;高糖和无糖DMEM培养基购自HyClone公司;GLS1 shRNA购自Sigma公司;结肠癌组织芯片购自西安艾莉娜生物公司;脂质体LipofectAMINE 2000购自Invitrogen公司。
1.2 免疫组织化学
利用链霉素抗生物素-过氧化物酶法检测结肠癌样本蛋白表达。根据GLS1染色的强弱进行免疫组化评分:①阳性细胞所占百分比(<5%:0分;6%~25%:1分;26%~50%:2分;51%~75%:3分;>75%:4分);②染色强度(未着色:0分;淡黄色:1分;黄色:2分;褐色:3分);③上述两者数据相乘,获得组织样本染色最终评分。样本统一随机编码后由2名设盲的病理医生同时评定给出分数,取平均值。
1.3 MTT法检测细胞增殖能力
用LipofectAMINE 2000转染结肠癌细胞HT29和Caco2,24 h后将细胞制成单细胞悬液,以104/孔接种到96孔板;分别在培养0、1、2、3 d的时间点进行MTT实验,每孔加入MTT溶液至终浓度为5 mg/mL,孵育4 h后通过DMSO溶解结晶物;在酶联免疫检测仪上测定各孔的D490nm值,并绘制细胞生长曲线。
1.4 葡萄糖摄取实验
将上述转染24 h的细胞以5×105/孔接种至6孔板,待细胞贴壁后弃培养基,更换为无血清无酚红DMEM,继续培养24 h;加入50 μmol/L 2-NBDG(Sigma公司)作用1 h,收取细胞,用流式细胞仪检测荧光信号强度。
1.5 谷氨酰胺摄取实验
将上述转染24 h的细胞以5×105/孔接种至6孔板,待细胞贴壁后弃培养基,更换为无血清无酚红DMEM,继续培养24 h,收集培养上清待检测,超声波裂解细胞并取裂解产物待检测。通过BCA法测定蛋白浓度,用于确定单位蛋白的代谢物含量(具体的测试原理:谷氨酰胺→谷氨酸+ NH3,通过NH3来计算谷氨酰胺的量)。根据试剂盒说明书得到相应数值,以无细胞对照孔培养液检测值为初始浓度,计算获得谷氨酰胺含量。即,细胞摄取的谷氨酰胺=无酚红DMEM中谷氨酰胺初始浓度-培养上清中谷氨酰胺浓度。
1.6 Western印迹
收集上述转染24 h的细胞,加入RIPA蛋白裂解液,超声波裂解,4℃离心取上清液,收集总蛋白,经10%SDS-PAGE分离后,电转(200 mA、2 h)至NC膜上,用含5%脱脂奶粉的TBST封闭2 h后用1∶1000稀释的GLS1抗体4℃孵育过夜,次日加入二抗孵育1 h,ECL发光检测剂显示。
2 结果
2.1 GLS1在结肠癌组织中的表达
免疫组化实验(图1)显示GLS1在结肠癌和对应的癌旁组织中均有表达,但结肠癌组织中的表达量远高于癌旁组织。统计学分析表明GLS1在结肠癌中显著高表达(P<0.001)(图2)。
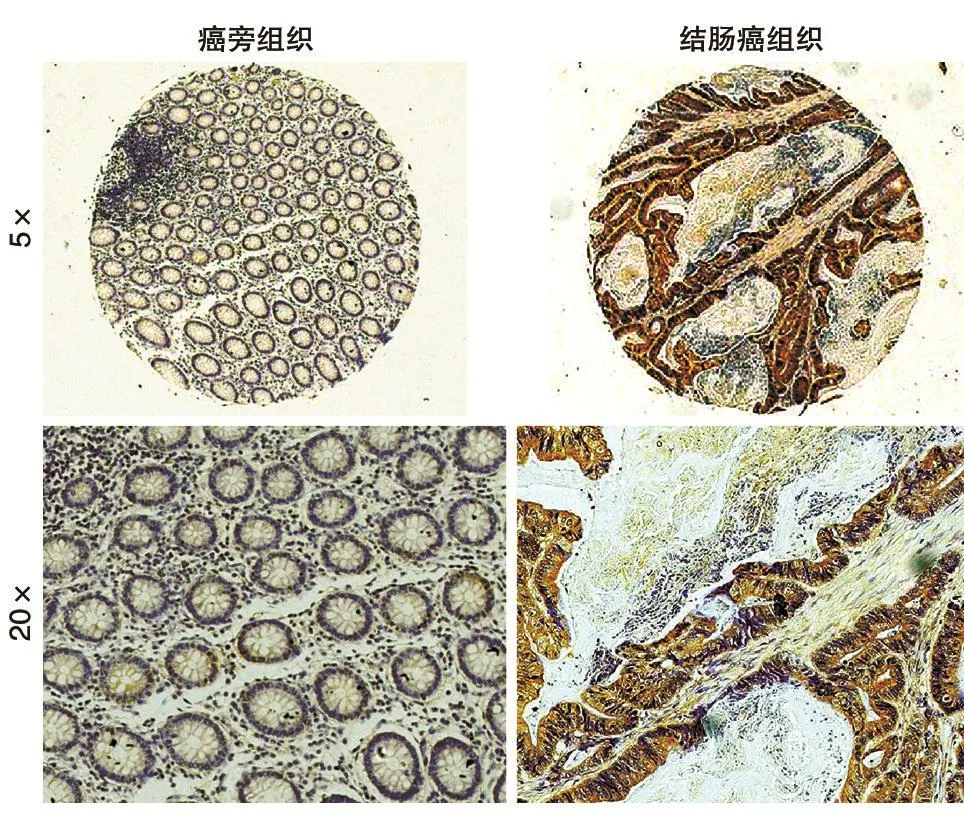
图1 免疫组织化学检测GLS1在结肠癌和癌旁组织中的表达
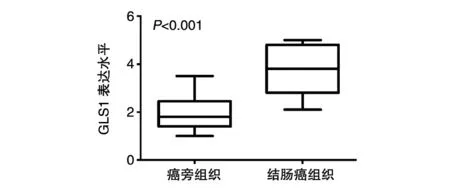
图2 统计学分析GLS1在结肠癌和癌旁组织中的表达差异
2.2 siRNA干涉GLS1表达鉴定及对细胞增殖的影响
将对照siRNA和GLS1 siRNA转染HT29和Caco2细胞后,GLS1蛋白在GLS1 siRNA组中的表达显著低于对照siRNA组(图3)。MTT法检测结果表明GLS1 siRNA组的细胞增殖能力显著降低(图4)。
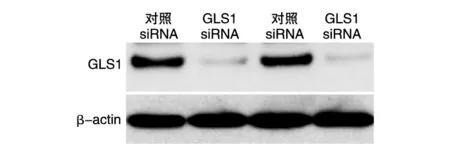
图3 Western印迹检测GLS1的表达
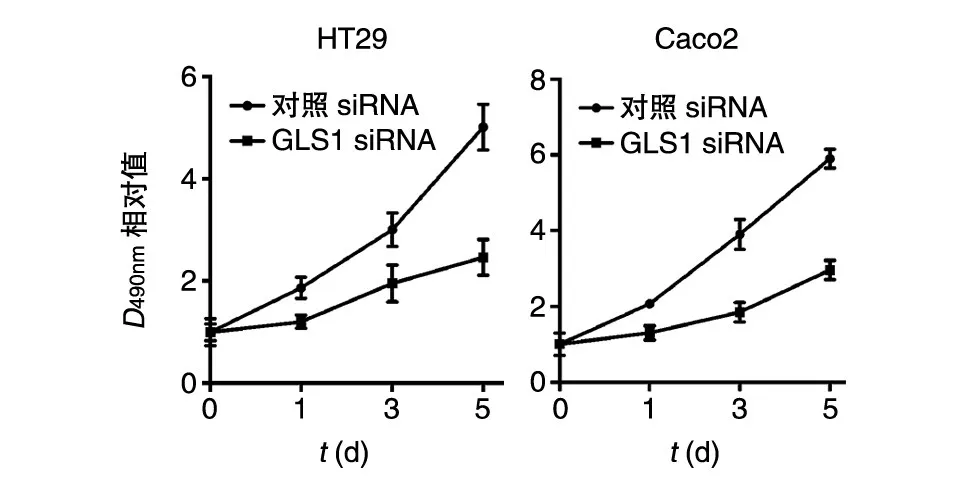
图4 干涉GLS1对结肠癌细胞增殖能力的影响
2.3 干涉GLS1对细胞代谢重编程的影响
我们对干涉GLS1的细胞进行了代谢重编程能力检测。葡萄糖摄取实验结果显示,GLS1干涉后,细胞对葡萄糖的摄取能力显著低于对照组(图5);谷氨酰胺摄取实验显示,GLS1的干涉也可以明显抑制细胞对谷氨酰胺的摄取(图6)。这些结果提示,GLS1在调节葡萄糖代谢和谷氨酰胺代谢过程中均发挥重要作用。
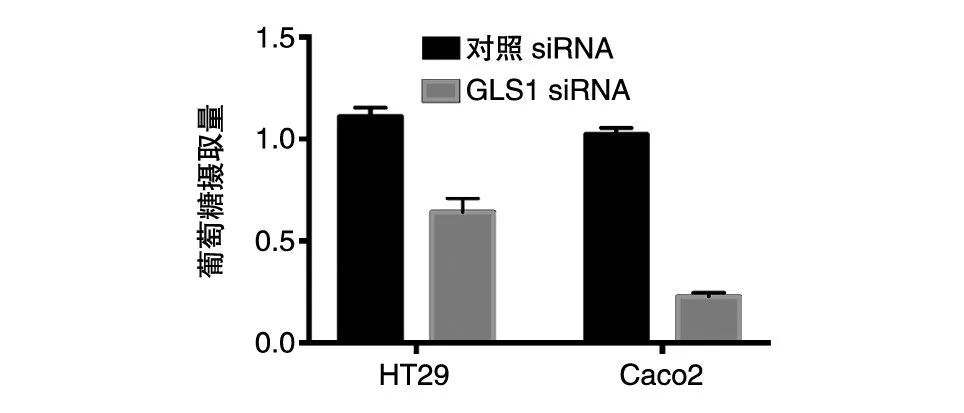
图5 结肠癌细胞对葡萄糖的摄取能力
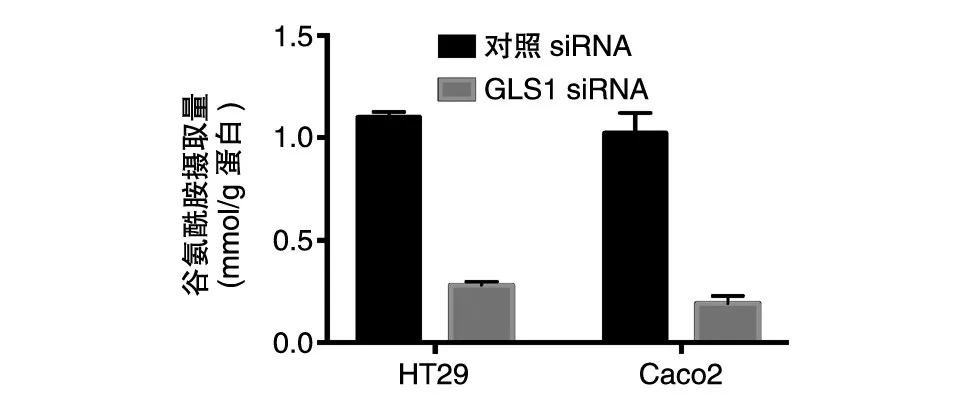
图6 结肠癌细胞对谷氨酰胺的摄取能力
3 讨论
结肠癌是世界范围内的高发恶性肿瘤之一,以每年超过100万例新增病例的速度递增[5-6]。尽管结肠癌从正常上皮细胞演变成恶性肿瘤的进程相对较长,但由于缺乏有效的肿瘤标志物,早期诊断效果欠佳,晚期预后和疗效较差,往往会对患者的健康和生命构成威胁。
肿瘤代谢的改变是判断其恶性程度的重要标志之一,而葡萄糖和谷氨酰胺是肿瘤细胞利用并依赖的重要能源物质。肿瘤细胞仍有Warburg效应,也是肿瘤特有的十大标志特征之一[2-3],这种代谢方式已在许多类型的肿瘤中得到验证,如前列腺癌、乳腺癌、肝癌、皮肤癌、结直肠癌等[2]。这种代谢方式的优势在于,利用葡萄糖进行有氧酵解的肿瘤细胞通过糖酵解途径生成的中间产物可用于核苷酸和脂肪酸等物质的合成,为肿瘤的增殖提供充足的原料,同时又避免了氧化磷酸化产生大量的自由基对细胞自身的杀伤。谷氨酰胺的重要作用体现在为细胞的增殖提供足够的碳源、氮源和ATP[7-9],为线粒体TCA循环提供原料[10-12],为抗氧化系统提供谷胱甘肽等还原当量[13-14]。研究发现,通过有氧酵解方式代谢的肿瘤细胞相对正常细胞更依赖谷氨酰胺的摄入[15]。此外,谷氨酰胺还能调节细胞内重要癌基因和信号通路,如PI3K/Akt、mTOR等,促进肿瘤的恶性演进过程[16]。
本研究中,我们在结肠癌模型中发现GLS1显著高表达,建立了GLS1表达与结肠癌发生之间的联系。同时,在干涉GLS1后,发现细胞的增殖能力、对葡萄糖和谷氨酰胺的摄取能力均显著下降,表明GLS1在调控谷氨酰胺代谢的同时,还可以影响细胞对葡萄糖的摄取,证明细胞内谷氨酰胺通路和葡萄糖代谢通路之间紧密相连,相互影响。这一结果为后续探讨GLS1在结肠癌细胞中影响糖代谢重编程的机制打下了重要基础。
[1] Siegel R,Desantis C,Jemal A.Colorectal cancer sta⁃tistics,2014[J].CA Cancer J Clin,2014,64(2):104-117. [2] Wu W,Zhao S.Metabolic changes in cancer:beyond the Warburg effect[J].Acta Biochim Biophys Sin, 2013,45(1):18-26.
[3] Hanahan D,Weinberg R A.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
[4] Jones N P,Schulze A.Targeting cancer metabolism--aiming at a tumour's sweet-spot[J].Drug Discov To⁃day,2012,17(5-6):232-241.
[5] Siegel R,Naishadham D,Jemal A.Cancer statistics, 2012[J].CA Cancer J Clin,2012,62(1):10-29.
[6] Cunningham D,Atkin W,Lenz H J,et al.Colorectal cancer[J].Lancet,2010,375(9719):1030-1047.
[7] Reitzer L J,Wice B M,Kennell D.Evidence that glu⁃tamine,not sugar,is the major energy source for cul⁃tured HeLa cells[J].J Biol Chem,1979,254(8):2669-2676.
[8] Fan J,Kamphorst J J,Mathew R,et al.Glutaminedriven oxidative phosphorylation is a major ATP source in transformed mammalian cells in both nor⁃ moxia and hypoxia[J].Mol Syst Biol,2013,9:712.
[9] Rider C C.Apparent inhibition of ATP citrate lyase by L-glutamate in vitro is due to the presence of glu⁃tamine synthetase[J].JNeurochem,1986,46(4):1246-1250.
[10]Le A,Lane A N,Hamaker M,et al.Glucose-indepen⁃dent glutamine metabolism via TCA cycling for prolif⁃eration and survival in B cells[J].Cell Metab,2012, 15(1):110-121.
[11]Yang C,Ko B,Hensley C T,et al.Glutamine oxida⁃tion maintains the TCA cycle and cell survival during impaired mitochondrial pyruvate transport[J].Mol Cell, 2014,56(3):414-424.
[12]Saqcena M,Mukhopadhyay S,Hosny C,et al.Block⁃ing anaplerotic entry of glutamine into the TCA cycle sensitizes K-Ras mutant cancer cells to cytotoxic drugs [J].Oncogene,2015,34(20):2672-2680.
[13]Curthoys N P,Watford M.Regulation of glutaminase activity and glutamine metabolism[J].Annu Rev Nutr, 1995,15:133-159.
[14]Cetinbas N,Daugaard M,Mullen A R,et al.Loss of the tumor suppressor Hace1 leads to ROS-dependent glutamine addiction[J]. Oncogene, 2015,34(30):4005-4010.
[15]Lu W,Pelicano H,Huang P.Cancer metabolism:is glutamine sweeter than glucose[J]?Cancer Cell,2010, 18(3):199-200.
[16]Wang Qian,Hardie R A,Balaban S,et al.Inhibition of glutamine uptake regulates mTORC1,glutamine me⁃tabolism and cell growth in prostate cancer[J].Cancer Metab,2014,2(s1):27.
