两栖动物脑形态大小的进化权衡与生态适应研究进展
2018-04-09廖文波
廖文波
(西华师范大学 两栖爬行类生态适应研究中心,四川 南充 637009)
生态适应性是有机体随着环境因子变化而改变自身形态、结构和生理生化特性,以便于与环境相适应的过程,其是在长期自然选择过程中形成的[1]。达尔文在《物种起源》一书中指出,动物群是由对环境具不同适应方式的个体所组成,可保证动物群中有部分个体面对环境的变化具有存活优势,并成功繁衍后代[1]。在进化过程中,自然选择保留了具有不同表型特征的个体。当环境条件发生较大的改变时,个体也将通过相应的适应对策来应对环境的变化,从而保证物种的存活和繁殖。脑作为有机体的重要认知器官,其生态适应性能够提高物种的适合度,从而应对环境变化带来的不利影响,保证物种繁衍[2]。
脑作为学习、记忆、认知和信息处理的中枢系统[3],其形态大小在达尔文进化论中处于核心位置[1],它能够对选择压力等重要的生态和进化过程产生深远的影响,有助于加深对物种认知过程的理解。脑形态大小进化的研究在动物保护中发挥了重要的作用,并有望为动物的保护提供一些新的启示,因为脑形态大小能够直接预测物种的濒危等级[4-5]。因此,尽管对脑形态大小的进化研究已有50 多年的历史,但它依然是动物进化生物学中最富有活力的研究领域[6]。脑作为动物重要的组织器官,其形态大小能够体现环境选择压力的作用[6-7]。“认知假说”和“能量限制假说”能够解释脑形态大小对环境变化的适应性[1-2]。通常情况下,“认知假说”认为大的脑可以提高认知能力,其有利于在波动或新的环境下寻找配偶、觅食和避开天敌[8-10]。然而,脑也是高耗能器官,大的脑需要消耗更多的能量,因此,“能量代价假说”认为小的脑在不稳定的环境下更有利于物种的存活[11]。可见,环境变化是物种脑形态大小变化的重要驱动力。除此之外,脑容量也与身体的其他组织器官大小有关,“能量组织代价假说”预测动物生长更大的脑容量必须以减少其他组织生长的能量投入为代价[12]。已有的研究表明鱼类、两栖类、鸟类和灵长类等类群的脑的进化均符合“能量组织代价假说”[13-16]。
与恒温动物相比,变温动物脑形态大小的进化研究能够更加深入发展脑对环境变化适应性的理论基础以及阐明生物多样性的保护价值。半个世纪以来,生态学家和进化生物学家围绕恒温动物脑形态大小对不同地理环境发生的生态适应做了大量研究,很多重要成果在Nature,Science,ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,Naturecommunications等权威刊物上发表[1,6,14,16-17]。但是,一些会极大影响变温动物脑形态大小进化的环境因素、物种的生活史和行为特征却被忽视了。目前关于变温动物脑形态大小的环境适应性的研究较少[18-20]。在脊椎动物中,两栖动物对环境变化非常敏感,其行为和生活史特征明显受环境变化的影响,结合两栖类生活史特征和行为特征来探讨其脑形态大小的生态适应机制,对生态学和进化生物学的发展具有重要的理论意义[4]。随着全球气候的变化,两栖类的物种或种群数量受到严重威胁,大约有40%的物种面临灭绝。自上世纪70年代以来,全世界高海拔地区至少有25种无尾两栖类已经灭绝[21-22]。因此,研究两栖类的脑形态大小的变化在预测物种的濒危情况和指导当地生物多样性的保护方面具有重要的应用价值[5]。
本文从物种的形态特征、行为特征、生活史特征及系统进化关系等几个不同层次出发,阐述两栖动物脑形态大小的进化权衡与生态适应。
1 环境变化对两栖动物脑形态大小进化的影响
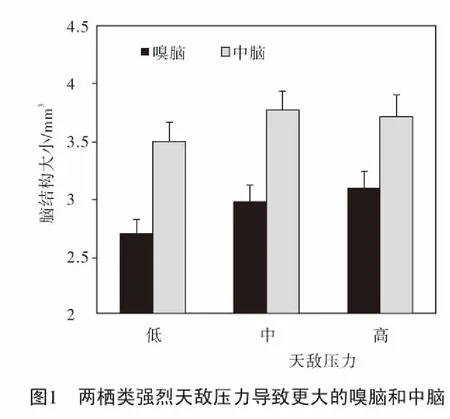

环境变化将引起物种的栖息地类型、食物类型和天敌压力发生变化,其终将影响物种脑形态大小的进化[23]。两栖类脑形态大小演化与环境因素有关,两栖类生活的栖息地类型能够解释中脑大小的变化,天敌压力能够解释嗅脑和中脑大小的变化,而食物类型不能解释脑形态大小的变化(图 1)。由此表明,两栖动物脑形态大小的增加是为了识别外界的天敌,其与脑的“认知假说”结论一致。此外 “能量限制假说”和“脑大小异速生长假说”同时影响两栖类脑形态大小的进化[12]。此外,季节性长度明显影响华西蟾蜍(Bufoandrewsi)相对脑形态大小变化,在不稳定的环境压力下,该物种有更小的脑,其与“能量限制假说”一致[24]。然而,温度变化程度与沼水蛙(Hylaranaguentheri)的脑容量不存在显著的相关性,其与“能量限制假说”不一致[25-26]。此外,Luo et al.(2017)对30种两栖动物的脑形态大小与温度和降雨量的关系进行了研究,结果发现温度的变化与总脑和中脑呈显著性负相关,其与“能量限制假说”一致。然而,降雨量变化和干旱季节长度与总脑大小无显著相关性[27]。
2 两栖动物脑容量与其它器官的进化关系
“能量组织代价假说”预测增加脑的大小将以减少其它组织器官的大小为代价,即脑容量与其它组织(例如肠长度)存在显著的负相关[12]。基于以上假设,Jin et al.(2015)发现峨眉林蛙(Ranaomeimontis)的脑容量与肠长度存在显著的权衡关系,其符合“能量组织代价假说”[28]。相反,黑斑蛙(Pelophylaxnigromaculatus)的脑容量与肠长度不存在显著的相关性,其不符合“能量组织代价假说”[29]。此外,Liao et al.(2016)以30个两栖类物种为研究对象,利用分子系统回归分析方法(PGLS)研究了两栖动物脑容量与肠长度以及其它器官的关系,结果表明:两栖动物脑容量与肠长度呈显著负相关,其符合“能量组织代价假说”[30](图2)。上述工作深化了人们对两栖类脑容量与其它组织大小进化关系的认识,发现了脑容量与肠长度存在显著的进化关系,这一发现为研究两栖类“能量组织代价假说”提供了理论依据,并为后期开展不同发育阶段食性对脑容量与其它器官大小进化关系的影响的研究提供了理论基础。
3 两栖动物脑形态大小对性选择的适应性
性选择是导致鸟类和兽类物种脑形态大小进化的主要动力[31-33]。通常情况下,性选择强度明显增加脑大小。但是,现在仍不清楚两栖类脑大小的进化是否与性选择有关。Zeng et al. (2016)对43个两栖类物种的脑形态大小与性选择(求偶方式、婚配制度和睾丸重)的进化关系进行了研究,结果表明:性选择不能促使脑容量发生变化,但求偶行为和婚配制度影响嗅脑的大小进化(图 3)。因此,性选择在两栖动物脑形态大小进化过程中的作用不显著[34]。上述工作深化了人们对两栖类脑形态大小与性选择关系的认识,发现了性选择对脑形态大小的进化不显著,这一发现为研究两栖类性选择与脑形态大小的进化关系提供了理论依据。

4 两栖动物脑形态大小对隐蔽色的适应性进化
动物经常通过改变身体颜色来适应生活的环境,从而躲避环境中天敌的压力,提高动物的存活以及后代的繁衍[35-36]。动物隐蔽色与天敌压力的关系研究,主要集中在爬行动物的变色龙[36]。但是,关于隐蔽色与动物脑形态大小的进化关系,目前还很少研究。我们实验室使用了49种两栖动物的野外图片,对隐蔽色进行计分,同时利用Adobe Photoshop CS6软件对28个物种进行了隐蔽色测量,然后用分子系统回归分析方法(PGLS)分析了脑容量和脑的5个主要部分(嗅脑、大脑、间脑、中脑、小脑)与隐蔽色的进化关系,目前结果表明:总脑的大小、嗅脑、大脑、间脑、中脑与隐蔽色均有一定的相关性。为了更加深入的探讨脊椎动物脑大小与隐蔽色的进化关系,我们还需要收集更多的数据来进行验证。
综上所述,将来还需要进一步探讨两栖类脑形态大小对物种分布范围的适应性演化、个体发育阶段的食性变化对脑容量与肠长度的权衡关系的影响,以及两栖类脑容量与肠长度进化率的差异性。总之,“认知假说”和“能量限制假说”能够解释两栖动物脑形态大小的进化。在同一类群的不同物种之间,脑形态大小不同,其差异性不仅与遗传因素有关,而且也与环境因素有关[6]。进一步研究环境因素和遗传因素与脑形态大小之间的关系,对了解脑各部分的功能进化具有重要的意义[9]。
参考文献:
[1]DARWIN C.The Descent of Man and Selection in Relation to Sex[M].London:John Murray,1871.
[2]BARTON R A,AGGLETON J P,GRENYER R.Evolutionary coherence of the mammalian amygdala[J].Proceedings of the Royal Society B:life Sciences,2003,270(1514):539-543.
[3]BARTON R,HARVEY P.Mosaic evolution of brain structure in mammals[J].Nature,2000,405(6790):1055-1058.
[4]ABELSON E S.Brain size is correlated with endangerment status in mammals[J].Proceedings of the Royal Society B:life Sciences,2016,283(1825):20152772.
[6]SAYOL F,MASPONS J,LAPIEDRA O,et al.Environmental variation and the evolution of large brains in birds[J].Nature Communications,2016,7:13971.
[7]SAFI K,DECHMANN D.Adaptations of brain regions to habitat complexity:a comparative analysis in bats (Chiroptera)[J].Proceedings of the Royal Society B:life Sciences,2005,272(1559):179-186.
[8]ALLMAN J,MCLAUGHLIN T,HAKEEM A.Brain weight and life-span in primate species[J].Proceedings of the National Academy of Sciences of the United States of America,1993,90(1):118-122.
[9]VAN WOERDEN J T,WILLEMS E P,VAN SCHAIK C P.Large brains buffer energetic effects of seasonal habitats in catarrhine primates[J].Evolution,2011,66(1):191-199.
[10] SCHUCK-PAIM C,ALONSO W J,OTTONI E B.Cognition in an ever-changing world:Climatic variability is associated with brain size in neotropical parrots[J].Brain Behavioral Evolution,2008,71(3):200-215.
[11] VAN WOERDEN J T,VAN SCHAIK C P,ISLER K.Effects of seasonality on brain size evolution:evidence from strepsirrhine primates[J].American Naturalist,2010,176(6):758-767.
[12] AIELLO L C,WHEELER P.The expensive-tissue hypothesis:the brain and the digestive system in human and primate evolution[J].Current Anthropology,1995,36(2):199-221.
[13] ISLER K,VAN SCHAIK C.The expensive brain:a framework for explaining evolutionary changes in brain size[J].Journal of Human Evolution,2009,57(4):392-400.
[14] NAVARRETE A,VAN SCHAIK C P,ISLER K.Energetics and the evolution of human brain size[J].Nature,2011,480(7375):91-93.
[15] TSUBOI M,HUSBY A,KOTRSCHAL A,et al.Comparative support for the expensive tissue hypothesis:Big brains are correlated with smaller gut and greater parental investment in Lake Tanganyika cichlids[J].Evolution,2015,69(1):190-200.
[16] BENSON-AMRAM S,DANTZER B,STRICKER G,et al.Brain size predicts problem-solving ability in mammalian carnivores[J].Proceedings of the National Academy of Sciences of the United States of America,2016,113(9):2532-2537.
[17] DUNBAR R I,SHULTZ S.Evolution in the social brain[J].Science,2007,317(5843):1344-1347.
[18] GONDA A,HERCZEG G,MERIL J.Adaptive brain size divergence in nine-spined sticklebacks (Pungitiuspungitius)[J].Journal of Evolutionary Biology,2009,22(8):1721-1726.
[19] GONZALEZ-VOYER A,WINBERG S,KOLM N.Social fishes and single mothers:brain evolution in African cichlids[J].Proceedings of Royal Society B:life Sciences,2009,276(1654):161-167.
[20] LIAO W B,LOU S L,ZENG Y,et al.Evolution of anuran brains:disentangling ecological and phylogenetic sources of variation[J].Journal of Evolutionary Biology,2015,28(11):1986-1996.
[21] WAKE B D.Facing extinction in real time[J].Science,2012,335(6072):1052-1053.
[22] FITZPATRICK B M,JOHNSON J R,KUMP D K,et al.Rapid spread of invasive genes into a threatened native species[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(8):3606-3610.
[23] JERISON H J.Evolution of the Brain and Intelligence[M].Academic Press,1973.
[24] JIANG A,ZHONG M J,YANG R L,et al.Seasonality and age is positively related to brain size in Andrew’s toad (Bufoandrewsi)[J].Evolutionary Biology,2015,42(3):339-348.
[25] GU J,LI D Y,LUO Y,et al.Brain size inHylaranaguentheriseems unaffected by variation in temperature and growth season[J].Animal Biology,2017,67(3/4):209-225.
[26] MAI C L,LIAO J,ZHAO L,et al.Brain size evolution in the frogFejervaryalimnocharisdoes neither support the cognitive buffer nor the expensive brain framework hypothesis[J].Journal of Zoology,2017,302(1):63-72.
[27] LUO Y,ZHONG M J,HUANG Y,et al.Seasonality and brain size are negatively associated in frogs:evidence for the expensive brain framework[J].Scientific Reports,2017,7(11):16629.
[28] JIN L,LIU W C,LI Y H,et al.Evidence for the expensive-tissue hypothesis in the Omei Wood Frog (Ranaomeimontis)[J].Herpetological Journal,2015,25(2):127-130.
[29] ZHAO L,MAO M,LIAO W B.No evidence for the ‘expensive-tissue hypothesis’ in the dark-spotted frog,Pelophylaxnigromaculatus[J].Acta Herpetologica,2016,11(1):69-73.
[30] LIAO W B,LOU S L,ZENG Y.et al.Large brains,small guts:The expensive tissue hypothesis supported in anurans[J].American Naturalist,2016,188(12):693-700.
[31] IWANIUK A N,DEAN K M,NELSON J E.A mosaic pattern characterizes the evolution of the avian brain[J].Proceedings of the Royal Society B:Life Science,2004,271(4):S148-S151.
[32] PITNICK S,JONES K E,WILKINSON G S.Mating system and brain size in bats[J].Proceedings of the Royal Society B:Life Science,2006,273(1587):719-724.
[33] FITZPATRICK J L,ALMBRO M,GONZALEZ-VOYER A,et al.Sexual selection uncouples the evolution of brain and body size in pinnipeds[J].Journal of Evolutionary Biology,2012,25(7):1321-1330.
[34] ZENG Y,LOU S L,LIAO W B,et al.Sexual selection impacts brain anatomy in frogs and toads[J].Ecology and Evolution,2016,6(19):7070-7079.
[35] RUXTON G D,SHERRATT T N,SPEED M P.Avoiding Attack[M].Oxford: University Press,2004.
[36] STEVENS M.Predator perception and the interrelation between different forms of protective coloration[J].Proceedings of the Royal Society B:Life Science,2007,274(1617):1457-1464.
