原花青素抑制脂多糖激活神经小胶质细胞的机制
2018-04-09张小强梁晓瑜王
张 妍 张小强* 梁晓瑜王 旭 刘 静
(1. 东南大学公共卫生学院,江苏 南京 210009;2. 东南大学环境医学工程教育部重点实验室,江苏 南 京 210009)
原花青素(proanthocyanidin,PC)是一类黄烷醇单体及其聚合体形成的多酚类化合物,广泛存在于水果、蔬菜、树皮中。原花青素生物学功能丰富,具有较强的抗氧化和清除自由基[1]、 抗炎[2]、 神经保护[3]等功能,且其在人体内的生物活性很高,作用安全可靠,广泛应用于食品、保健、医疗等领域。
小胶质细胞是中枢神经系统中一类固有免疫细胞。当大脑受到外界环境刺激时,静息的小胶质细胞会被迅速激活,持续释放肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)、一氧化氮等细胞毒性分子,引发神经炎症反应并损伤周围神经元。脂多糖(lipopolysaccharide,LPS)是革兰阴性杆菌胞壁外膜层的重要组分[4]。
Toll样受体(Toll like receptor,TLR)是一类天然免疫受体,在小胶质细胞中表达较为广泛。其中TLR4作为TLR家族中的重要成员,是介导脂多糖应答的最主要受体。p38丝裂原活化蛋白激酶(p38 MAPK)是丝裂原激活蛋白激酶(MAPK)通路之一,在炎症反应和众多神经退行性疾病中发挥重要作用。研究表明,LPS刺激小胶质细胞可引起TLR4/p38 MAPK信号通路的活化并释放炎性细胞因子[5]。目前原花青素的研究主要集中于抑制小胶质细胞活化产生促炎性因子的形态学研究上[6],缺乏机制学研究。本研究利用LPS激活小鼠小胶质细胞(BV2细胞)构建体外炎症模型,原花青素进行干预,探讨原花青素抑制LPS激活 BV2细胞的相关机制。
1 材料与方法
1.1 药品与试剂
BV2细胞株购自中国医学科学院基础医学研究所细胞中心;原花青素,购于上海阿拉丁生化科技股份有限公司;LPS(E. coli O55:B5)、四甲基噻唑蓝(thiazolyl blue,MTT)均购自Sigma公司;DMEM高糖培养基购于HyClone公司;胎牛血清购自Clarkbio公司;0.25%胰蛋白酶-EDTA溶液购自Gibco公司;NO检测试剂盒(S0021)、BCA蛋白浓度试剂盒(P0010)购自上海碧云天生物技术有限公司;TNF-α、IL-1β、IL-6 ELISA试剂盒均购于南京森贝伽生物科技有限公司;TLR4、p38、p-p38及actin一抗和二抗、免疫印迹化学发光试剂盒均购自Santa Cruz公司。
1.2 主要仪器
Series 8000恒温培养箱购自Thermo Scientific公司,IX51倒置显微镜购自Olympus公司,5417R高速冷冻离心机购自Eppendorf AG公司,RT-6000酶标分析仪购自Rayto公司。
1.3 实验方法
1.3.1细胞培养 BV2细胞用含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM高糖完全培养基,于CO2体积分数5%的37 ℃恒温培养箱中培养。每天更换1次培养基,每2~3 d传代1次,取对数生长期细胞进行实验。
1.3.2Griess法测定NO水平 LPS诱导BV2细胞活化,构建体外炎症损伤模型。BV2细胞以1×105/mL 的密度接种于24孔板,每孔800 μL。待细胞贴壁后,设立对照组 、 LPS(0.01、0.1、 1.0、10.0和20.0 μg/mL)组。LPS刺激BV2细胞24 h后收集细胞上清,按试剂盒说明书操作,测定吸光度D(540)值。样品中NO含量根据标准曲线计算,由此确定并验证LPS的造模浓度。
1.3.3MTT法检测细胞活性 BV2细胞以1×104/mL的密度接种于96孔板,每孔100 μL。待细胞贴壁后,设调零组、对照组、LPS(1.0 μg/mL)组、原花青素(0.1、0.5、2.5、10.0 μg/mL)组、LPS(1.0 μg/mL)+原花青素(0.1、0.5、2.5、10.0 μg/mL)组。调零组不含细胞,对照组细胞正常培养,原花青素比LPS预先1 h加入。孵育24 h后,每孔加入5 mg/mL MTT溶液10 μL,继续孵育4 h后,吸弃培养基,每孔加入150 μL DMSO,振荡10 min,酶标仪测定吸光度D(570)值,计算各组细胞存活率。
1.3.4ELISA法测定TNF-α、IL-1β、IL-6水平BV2细胞以5×104/mL的密度接种于24孔板中,每孔500 μL。待细胞贴壁后,设对照组、1.0 μg/mL LPS组和1.0 μg/mL LPS+不同浓度(0.1、0.5、2.5、10.0 μg/mL)原花青素组,孵育24 h后收集上清。具体操作按照ELISA试剂盒说明书进行,酶标仪测定吸光度D(450)值。样品中TNF-α、IL-1β、IL-6含量根据各自的标准曲线计算。
1.3.5Western blot检测 BV2细胞以每皿1×106个接种于6 cm培养皿中,分组同1.3.4。PC提前1 h加入,加入LPS作用1 h后,收集细胞,用RIPA裂解液提取蛋白。高速低温离心机4 ℃、12 000 g离心5 min,取上清液,以碧云天BCA蛋白浓度试剂盒对蛋白含量进行测定。取适量蛋白进行凝胶电泳、转膜、封闭,一抗4℃封闭过夜。TBST洗膜8次,每次5 min。二抗室温孵育2 h,TBST再次洗膜8次,每次5 min。然后加入免疫印迹化学发光剂进行显影、定影,并用Image J软件对成像结果进行分析。
1.4 统计学方法
2 结 果
2.1 LPS诱导BV2细胞炎症损伤模型的建立
不同浓度LPS对BV2细胞释放NO影响的结果如图1所示。与对照组相比,0.1、1.0、10.0、20.0 μg/mL LPS均可增加BV2释放NO水平(p<0.05),且随LPS浓度增大而增加。为确保炎症损伤模型建模成功,同时减少LPS对细胞不良影响,结合文献选择1.0 μg/mL LPS染毒BV2细胞进行后续实验。

图1 不同浓度LPS对BV2细胞释放NO的影响
2.2 原花青素及LPS对BV2细胞活性的影响
如图2所示。与对照组相比,0.1、0.5、2.5、10.0 μg/mL原花青素单独作用或与1.0 μg/mL的LPS共同作用,对BV2细胞存活率的影响差异均无统计学意义(P>0.05)。该结果表明在实验所用剂量范围内,原花青素对静息状态或1.0 μg/mL LPS激活状态下的BV2细胞未产生毒性作用。
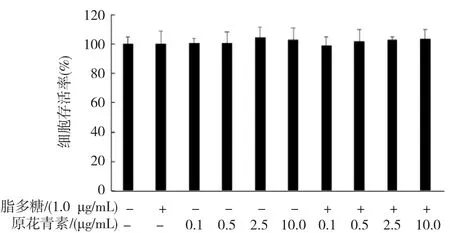
图2 原花青素及LPS对BV2细胞活性的影响
2.3 原花青素抑制LPS激活BV2细胞释放炎性因子
ELISA法检测细胞上清中TNF-α、IL-1β、IL-6浓度的结果如表1所示。与对照组相比,LPS(1.0 μg/mL)处理BV2细胞后TNF-α、IL-1β和IL-6的释放水平明显增加(p<0.05)。与1.0 μg/mL LPS组相比,不同浓度(0.1、0.5、2.5、10.0 μg/mL)的原花青素预处理使TNF-α、IL-1β和IL-6的浓度显著降低且呈剂量-效应关系(r值依次为0.735,0.604,0.736,P均<0.05)。
表1 原花青素对LPS诱导BV2细胞释放TNF-α、IL-1β和IL-6的影响(s)
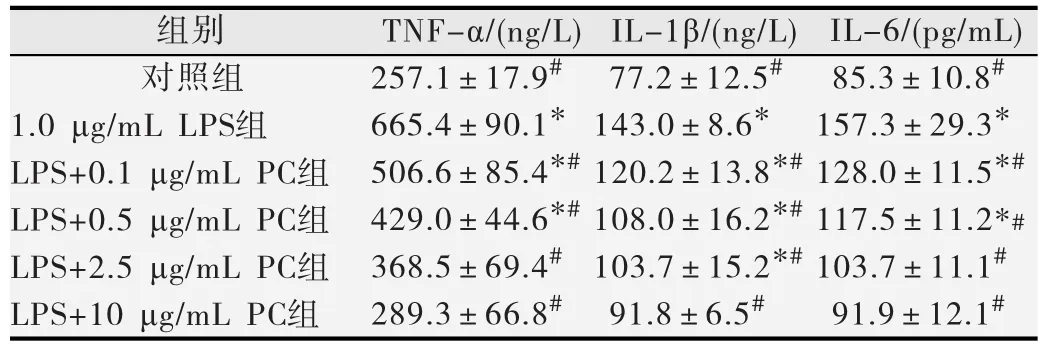
表1 原花青素对LPS诱导BV2细胞释放TNF-α、IL-1β和IL-6的影响(s)
与对照组比较,*p<0.05;与1.0 μg/mL LPS组比较,#p<0.05.
组别 TNF-α/(ng/L)IL-1β/(ng/L) IL-6/(pg/mL)对照组 #257.1±17.9 #77.2±12.5 #85.3±10.8 1.0 μg/mL LPS组 *665.4±90.1 *143.0±8.6 *157.3±29.3 LPS+0.1 μg/mL PC组 #128.0±11.5 LPS+0.5 μg/mL PC组 #*506.6±85.4 #*120.2±13.8 #**429.0±44.6 #*108.0±16.2 117.5±11.2*#LPS+2.5 μg/mL PC组 #368.5±69.4 #103.7±15.2 #103.7±11.1*LPS+10 μg/mL PC组 #289.3±66.8 #91.8±6.5 #91.9±12.1
2.4 原花青素对LPS诱导BV2细胞p38蛋白磷酸化的影响
采用Western blot法检测原花青素对p38 MAPK通路的影响,结果如图3所示。与对照组比较,给予LPS(1.0 μg/mL)刺激,BV2细胞p-p38蛋白表达升高,且差异具有统计学意义(p<0.05)。与1.0 μg/mL LPS组相比,原花青素(0.1、0.5、2.5、10.0 μg/mL)预处理BV2细胞,p-p38蛋白表达下调(p<0.05),且磷酸化水平呈剂量依赖性降低(r=0.710,p<0.05)。
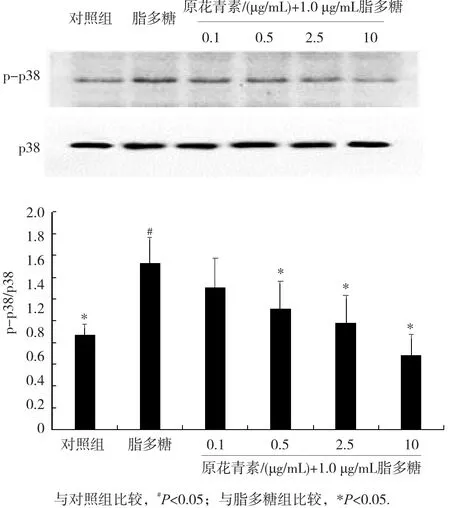
图3 原花青素对LPS诱导BV2细胞p38蛋白磷酸化的影响
2.5 原花青素对LPS诱导BV2细胞TLR4蛋白表达的影响
采用Western blot法检测原花青素对TLR4受体表达水平的影响,结果如图4所示。与对照组相比,LPS刺激BV2细胞后TLR4蛋白表达显著升高(p<0.05)。与1.0 μg/mL LPS处理组相比,原花青素(0.1、0.5、2.5、10.0 μg/mL)干预BV2细胞后,TLR4蛋白表达水平下调且呈剂量-效应关系(r=0.732,p<0.05)。
3 讨论

图4 原花青素对LPS诱导BV2细胞TLR4蛋白表达的影响
近年来神经免疫炎症机制在神经退行性疾病中的作用受到普遍关注。小胶质细胞作为中枢神经系统中最重要的固有免疫细胞,是神经炎症的重要参与者,在大脑的炎症反应中起最为关键的作用[7]。当大脑受到外界环境刺激时,静息的小胶质细胞会被迅速激活为“阿米巴样”,持续释放肿瘤坏死因子α、白细胞介素-1β、白细胞介素-6、一氧化氮等炎症介质,还可释放活性氧、谷氨酸、趋化细胞因子等细胞毒性分子,这些细胞因子大量累积可导致局部细胞生存环境恶化,引发神经炎症反应并损伤周围神经元[8]。受损的神经元反过来又会进一步诱导小胶质细胞的活化,从而形成一个恶性循环的病理过程,导致神经退行性病变持续进展。因此,抑制小胶质细胞的活化有望成为缓解帕金森病等神经退行性疾病进程的有效手段。
本研究首先利用LPS建立体外炎症模型,通过Griess法测定NO浓度选定LPS 1 μg/mL作为造模浓度,原花青素干预,应用ELISA法检测炎症因子分泌水平,结果表明原花青素可呈剂量依赖性抑制LPS激活BV2细胞释放的TNF-α、IL-1β、IL-6炎性因子。因此,原花青素可对小胶质细胞活化引起的炎症因子分泌水平升高起到一定缓解作用。
在小胶质细胞中,NF-κB信号通路是介导炎症的经典通路。我们前期研究已经证实,原花青素可通过下调转录因子NF-κB的活化,抑制炎症介质的释放,从而抑制小胶质细胞活化[9]。但NF-κB途径还需要与其他信号通路相互协调作用,比如受MAPK信号通路的调控,共同调节细胞炎症信号级联。
p38 MAPK信号通路是MAPK信号通路中的一条重要通路,与炎性反应调控密切相关。有研究发现LPS等促炎因子刺激可通过激活小胶质细胞中p38 MAPK通路,诱导NF-κB通路激活,引起小胶质细胞活化,从而释放炎性因子[10-12]。大量文献表明药物通过抑制p38 MAPK信号通路发挥抗炎作用。因此,我们研究在LPS激活的BV2细胞中原花青素是否可以通过抑制p38 MAPK信号通路的磷酸化激活从而发挥其抗神经炎症的作用。本研究证实,LPS显著上调了p38 MAPK的磷酸化水平,而原花青素干预可显著降低p-p38蛋白表达,且随浓度增大抑制作用越明显,说明p38 MAPK信号通路在原花青素抑制脂多糖激活神经小胶质细胞释放炎症因子过程中发挥重要作用,这一结论与相关文献报道一致[13-14]。
TLR4是引起机体炎症反应的关键分子,在小胶质细胞活化引起的神经炎症反应中至关重要。研究表明LPS可被小胶质细胞膜上TLR4受体识别,触发MAPK[15-16]和 NF-κB[17-18]通路,从而启动促炎因子等多种基因转录及表达。本研究采用Western blot检测表明LPS可显著上调TLR4蛋白表达,原花青素干预BV2细胞后,TLR4蛋白表达较LPS刺激组明显下降,提示原花青素可能通过TLR4通路抑制小胶质细胞活化释放的炎性因子。这一结论与相关文献报道一致[19-20]。
综上所述,原花青素可通过TLR4/p38 MAPK信号通路抑制脂多糖激活神经小胶质细胞,抑制炎症因子的分泌,从而为研究原花青素预防和延缓神经退行性疾病的进展提供了理论依据。
[1] ZHOU Q,YIN Z P,MA L,et al. Free radical-scavenging activities of oligomeric proanthocyanidin from Rhodiola rosea L.and its antioxidant effects in vivo[J]. Nat Prod Res,2014,28(24): 2301-2303.
[2] LIMTRAKUL P,YODKEEREE S,PITCHAKARN P,et al.Anti-inflammatory effects of proanthocyanidin-rich red rice extract via suppression of MAPK,AP-1 and NF-kappaB pathways in Raw 264.7 macrophages[J]. Nutr Res Pract,2016,10(3): 251-258.
[3] STRATHEARN K E,YOUSEF G G,GRACE M H,et al.Neuroprotective effects of anthocyanin- and proanthocyanidinrich extracts in cellular models of Parkinsons disease[J]. Brain Res,2014,1555: 60-77.
[4] AID S,LANGENBACH R,BOSETTI F. Neuroinflammatory response to lipopolysaccharide is exacerbated in mice genetically deficient in cyclooxygenase-2[J]. J Neuroinflamm,2008,5(1): 17.
[5] 吴非,罗涛,郭远瑾,等. TLR4-P38 MAPK信号通路在LPS诱导BV2细胞中的表达及意义[J]. 中国实用神经疾病杂志,2013,16(11): 7-9.
[6] 陈金枝,张小强,曲志华,等. 原花青素对脂多糖诱导BV2小胶质细胞炎症介质分泌的影响[J]. 癌变·畸变·突变,2016,28(3): 214-217.
[7] BROWN G C,NEHER J J. Inflammatory neurodegeneration and mechanisms of microglial killing of neurons[J]. Mol Neurobiol,2010,41(2/3): 242-247.
[8] Hughes V. Microglia: The constant gardeners[J]. Nature,2012,485(7400): 570-572.
[9] 陈金枝. 原花青素抑制小胶质细胞活化及其对鱼藤酮诱导多巴胺能神经元损伤的保护作用[D]. 东南大学,2016.
[10] 房艳宇,罗晓光,苏阳,等. 探讨BV2细胞活化中是否存在p38 MAPK及JAK2-STAT通路的磷酸化激活[J]. 中国免疫学杂志,2016,32(5): 629-632.
[11] XING B,BACHSTETTER A D,VAN ELDIK L J. Microglial p38 alpha MAPK is critical for LPS-induced neuron degeneration,through a mechanism involving TNF alpha[J]. Mol Neurodegener,2011,6(1): 84.
[12] JANG S B,LEE K H. p38 MAPK and NF-κB are required for LPS-induced RANTES production in immortalized murine microglia (BV-2)[J]. Korean J Physiol Pharm,2000,4(5):339-346.
[13] LIU D,WANG Z,LIU S,et al. Anti-inflammatory effects of fluoxetine in lipopolysaccharide(LPS)-stimulated microglial cells[J]. Neuropharmacology,2011,61(4): 592-599.
[14] CHOI S S,LEE D H,LEE S H. Blueberry protects LPS-stimulated BV-2 microglia through inhibiting activities of p38 MAPK and ERK1/2[J]. Food Sci Biotechnol,2012,21(4):1195-1201.
[15] CHO K,KIM D,YOON C S,et al. Anti-neuroinflammatory effects of citreohybridonol involving TLR4-MyD88-mediated inhibition of NF-κB and MAPK signaling pathways in lipopolysaccharide-stimulated BV2 cells[J]. Neurochem Internat,2016,95(Sup C): 55-62.
[16] GAIKWAD S,PATEL D,NAVEEN C R,et al. The critical role of JNK and p38 MAPKs for TLR4 induced microgliamediated neurotoxicity[J]. J Exp Biol,2016,5(58): 34-42.
[17] SU X,CHEN Q,CHEN W,et al. Mycoepoxydiene inhibits activation of BV2 microglia stimulated by lipopolysaccharide through suppressing NF-κB,ERK 1/2 and toll-like receptor pathways[J]. Int Immunopharmacol,2014,19(1): 88-93.
[18] HU H,LI Z,ZHU X,et al. Gua Lou Gui Zhi decoction suppresses LPS-induced activation of the TLR4/NF-κB pathway in BV-2 murine microglial cells[J]. Int J Mol Med,2013,31(6): 1327.
[19] 王越,赵鸿飞,林创鑫,等. 连翘苷对LPS刺激的BV2小胶质细胞炎性反应的抑制作用[J]. 中风与神经疾病杂志,2016,33(4): 338-341.
[20] WANG H,WANG H,WANG J,et al. Protocatechuic acid inhibits inflammatory responses in LPS-stimulated BV2 microglia via NF-κB and MAPKs signaling pathways[J].Neurochem Res,2015,40(8): 1655-1660.
