接种AMF对弱光环境及盐胁迫下甜瓜光合特性的影响
2018-04-08许炜萍郁昉斌郭培培谢晓红
黄 志,许炜萍,郁昉斌,郭培培,谢晓红,何 茂,赖 艳
(四川农业大学 园艺学院,成都 611130)
土壤盐渍化对农业的威胁是一个全球性问题。中国约有9 913万hm2土地受到盐碱化侵害[1],土壤盐碱化已成为制约植物生长的主要逆境之一。甜瓜在中国具有悠久的栽培历史,且栽培总面积和产量都居世界首位,是设施栽培的重要蔬菜作物之一。中国设施蔬菜生产中因追求高产而不合理地超量施用化肥和偏施氮肥,造成土壤盐分过量积累,严重影响了设施蔬菜生产的可持续发展。盐渍影响植物细胞渗透势,Na+和Cl-毒害细胞,破坏离子平衡[2],减少叶绿素含量,抑制光合生理过程、减少生物量积累,导致作物减产和质量下降[3]。同时,在设施栽培生产中,经常遇到的弱光胁迫也已成为限制众多设施瓜类蔬菜优质高效栽培的关键因素之一[4]。尤其在寡日照地区弱光胁迫对作物生长的影响更为突出,弱光直接影响植物的物质积累和光合作用。弱光造成植株叶绿体发育不良、排列紊乱,超微结构遭到破坏,且叶绿体数量减少,叶绿素含量降低[5]。
光合作用是植物合成有机物和获得能量的根本源泉,是植物生长发育的基础。许多研究表明,盐胁迫抑制了植物的光合作用[6]。菌根真菌侵染寄主植物改变了植株的碳素循环和光合作用[7,8],促进盐碱土中植物的生长,增加叶面积和叶绿素含量[9],促进盐胁迫下植株对水分和养分吸收,提高光合能力等[10-11]。研究发现接种菌根真菌能显著提高玉米的净光合速率、蒸腾速率和气孔导度,并且接菌植株的最大光化学效率(Fv/Fm)也显著高于未接菌植株[12]。但目前对设施栽培逆境研究大多集中在单一逆境因子方面,对弱光及盐胁迫复合逆境的影响报道较少。因此,本试验通过分析弱光环境接种丛枝菌根真菌(AMF)对盐胁迫下甜瓜幼苗叶绿素含量、气体交换参数和光响应参数等影响,探讨AMF对甜瓜复合逆境下的增抗作用,以期为AMF在设施甜瓜栽培中的推广应用提供理论依据。
1 材料和方法
1.1 材 料
供试AMF菌种为摩西球囊霉菌Glomusmosseae(GM),供试甜瓜品种为‘中蜜3号’,均由中国农业科学院蔬菜花卉研究所提供。取饱满的种子,先将种子浸泡在55 ℃温水中15 min,然后用冷水冷却,再在28 ℃恒温箱中催芽18 h后播种塑料盆内。盆的规格为上口内径15 cm,盆底内径9 cm,盆高10.5 cm。采用蛭石4∶1珍珠岩作为试验基质。每盆装试验基质约300 g,基质预先经过0.11 MPa、121 ℃高压蒸汽灭菌[13]。
1.2 试验设计
试验于2014年7~10月于四川农业大学农场设施大棚内及设施系实验室中进行。经测定当地10:00~16:00平均光照强度约为1 080~1 620 μmol·m-2·s-1,将塑料大棚上覆盖1层黑色遮阳网模拟弱光环境(白天中午最高光强为670 μmol·m-2·s-1,最高温度为30 ℃;夜间最低温度为18 ℃,无光照);根据参考文献[14-16]设置3个盐分级别,NaCl浓度分别为0、60、120 mmol·L-1,分别记为S0、S60、S120;每个逆境组合设接菌和未接菌2个处理(GM和CK),共6个处理,每个处理种植12盆,每盆3株幼苗。接菌处理每盆添加接种物共10 g(经检测约含720个孢子),采用“二层接种法”[17],即首先在试验盆中装入1/3高度的灭菌基质,然后均匀地撒上1层接种体,用量大约是每盆接入量的3/5,之后又撒上1层基质至盆高的3/4处,将剩余的菌根接种体全部施入,后覆上1层基质,种子播于其上,再覆上1层细的基质即可;未接菌处理接入等质量高温灭菌后的接种物。
经过20 d的侵染,幼苗达到“三叶一心”时开始盐胁迫处理,无盐处理的用0.5倍Hoagland营养液浇灌,盐处理则用0.5倍Hoagland营养液配制相应盐浓度溶液浇灌,每隔2 d浇1次盐水,每次各浇100 mL,钵下放盘,为保持盆内盐浓度,如有渗漏,将渗出液反倒回去。盐胁迫0、3、6、9 d后分别取各处理的叶片进行相关指标的测定。每处理取样3株,每株取3~4叶序处的功能叶,重复3次。
1.3 测定指标与方法
1.3.1AM真菌侵染率处理9 d后,取根系30个根段采用苯胺蓝染色镜检后,通过频率标准法计算菌根侵染率[13]。菌根侵染率(%)=丛枝菌根感染的根段长度/检查根段的总长度×100%。
1.3.2叶绿素含量称取剪碎混匀的新鲜叶片0.2 g,共3份,分别放入3支具塞试管并加入95%的乙醇[18]。将试管移至暗处保存,组织呈现白色则表明浸提完全。以95%的乙醇为空白对照,在756 MC型紫外分光光度计上分别测定波长665 nm、649 nm和470 nm(Chl a、Chl b、Car在乙醇中最大吸收峰的波长)下样品提取液的吸光度A665、A649和A470。每次处理重复3次,按下列公式计算各色素的浓度和含量,取平均值。
Ca(Chl a)=13.95 A665-6.88 A649
Cb(Chl b)=24.96 A649-7.32 A665
CX.C(Car)=(1 000 A470-2.05Ca-114.8Cb)/245
色素含量(mg·g-1)=C×V/(1 000×W)
式中Ca、Cb、CX.C分别代表Chl a、Chl b、Car的浓度。A665、A649、A470分别为Chl a、Chl b和Car在波长665 nm、649 nm、470 nm处的吸光度值;V表示提取液体积;W表示叶片组织鲜重。
1.3.3光合气体交换参数采用LI-6400XT便携式光合作用系统(LI-COR,USA),于晴天上午9:30~11:30测定光合气体交换参数,测定时光照强度设为500 μmol·m-2·s-1,温度为(25±1)℃。选取长势一致的3株幼苗的第一片完全展开真叶进行测定,重复3次;测定指标包括气孔导度(Gs)、净光合速率(Pn)、蒸腾速率(Tr)和胞间CO2浓度(Ci),相对气孔限制因子Ls=1-(Ci/Ca)(Ca为空气中CO2浓度)和水分利用率WUE=Pn/Tr。
1.3.4叶绿素荧光参数采用LI-6400XT(LI-COR,USA)便携式光合仪的荧光叶室测定,经过30 min充分暗适应,照射测量光,得到初始荧光(Fo),随后给一个饱和脉冲光后关闭,得到暗适应最大荧光(Fm)。当荧光产量从Fm快降回Fo时,打开作用光,当荧光恒定时,测得稳态荧光(Fs′)并记录,打开饱和脉冲光得到光化学作用下最大荧光(Fm′),随后关闭作用光使叶片暗适应3 s后打开远红光,5 s后测光适应叶片的最小荧光(Fo′),最后计算可变荧光(Fv=Fm-Fo),PSⅡ最大光化学效率(Fv/Fm)和PSⅡ实际光化学效率[ΦPSⅡ=(Fm′-Fs′)/Fm′]。
1.3.5光响应曲线测定测定时间为晴天上午9:30~11:30。使用开放气路,设定空气流速为0.5 L·min-1,CO2摩尔分数为400 μmol·mol-1。根据Pn的日变化曲线,确定其大概的饱和光强,并将待测叶片在接近饱和光强下诱导20 min(仪器自带的红蓝光源)以充分活化光合系统,随后采用0、50、
100、200、300、500、800、1 000、1 200、1 500、2 000 μmol·m-2·s-1光合有效辐射(PAR)梯度进行光合作用光响应动态测定。光合参数计算拟合Pn-PAR[19]曲线依据方程:Pn=Pmax(1-C0e-ΦPAR/Pmax),式中,Pmax为最大净光合速率,Φ为弱光下光化学量子效率,C0为度量弱光下净光合速率趋于0的指标。通过适合性检验,拟合效果良好。然后用公式计算光补偿点(LCP=PmaxlnC0/Φ和光饱和点(LSP=Pmaxln(100C0)/Φ)。假定Pn达到Pmax的99%的PAR为光饱和点(LSP),则表观量子效率(AQE)为Pn-PAR曲线初始部分(0~200 μmol·m-2·s-1)直线回归的斜率。
1.4 数据处理
应用Excel进行数据整理;采用SPSS数据处理软件进行显著性分析(邓肯新复极差法)。
2 结果与分析
2.1 弱光下AMF对盐胁迫甜瓜幼苗的菌根侵染率
由表1可以看出,甜瓜幼苗菌根侵染率在无盐处理(GMS0)下呈现持续增长趋势,在低浓度盐胁迫(GMS60)下呈先升后降的变化趋势,且胁迫至3 d时最高,而在高浓度盐胁迫下(GMS120)呈逐渐降低的趋势。在相同盐胁迫时间内,甜瓜幼苗菌根侵染率随着盐浓度增加而显著降低,即菌根侵染率与盐浓度呈负相关。盐胁迫9 d时,GMS0处理幼苗菌根侵染率比胁迫前增加19.4%,而GMS60、GMS120处理则分别减少16.6%和48.0%。表明盐胁迫对菌根侵染率有显著的影响,随盐浓度及胁迫时间增加,AMF对甜瓜仍有侵染,但侵染率显著下降。
2.2 弱光环境接种AMF对盐胁迫下甜瓜净光合速率(Pn)的影响
由图1可以看出,随盐浓度和胁迫时间增加,接菌株Pn明显高于未接菌株。接种AMF处理6 d时,除S60无显著差异外,其他均显著高于未接菌处理;到9 d时,各处理(GMS0、CKS0、GMS60、CKS60、GMS120、CKS120)较胁迫前降幅分别为44.1%、47.6%、52.8%、76.0%、80.9%、89.1%(图1)。且S120下降最为明显,未接菌株比接菌株下降幅度大,且其Pn始终比接菌株小。因此长时间盐胁迫严重抑制了甜瓜叶片的光合作用,AMF缓和了盐对甜瓜叶片光合的抑制作用。
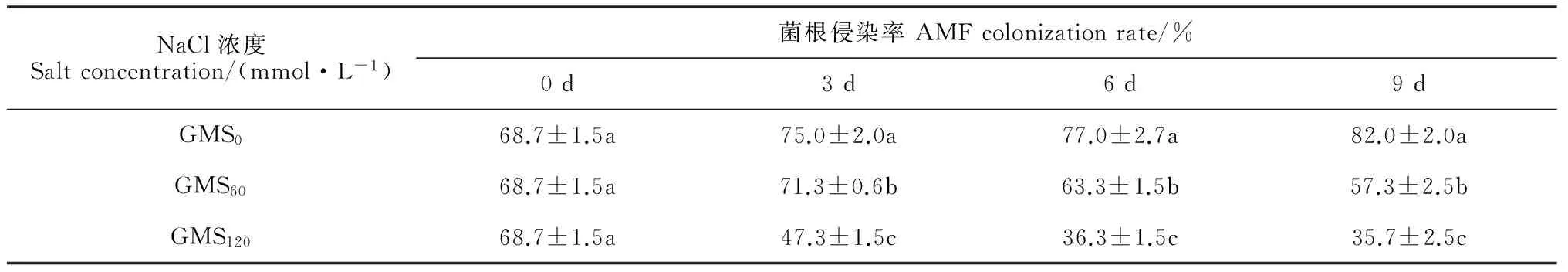
表1 弱光环境下AMF对盐胁迫甜瓜幼苗菌根侵染率的影响
注:数据经邓肯氏新复极差法检验,表中同列不同小写字母表示处理间在0.05水平存在显著性差异(P<0.05);数据均为3次重复均值; S0、S60、S120分别表示0、 60 和120 mmol·L-1NaCl 处理;GM表示接菌处理;下同
Note: The data were tested by Duncan's multiple range. The different normal letters in the same column indicate significant difference among treatments at 0.05 level(P<0.05); Data are the average of three replicates; S0, S60and S120expressed 0, 60 and 120 mmol·L-1NaCl concentrations; GM was treated with the inoculation of AMF. The same as below
2.3 弱光环境接种AMF对盐胁迫下甜瓜叶片光合色素含量的影响
高等植物中的光合色素主要包括叶绿素和类胡萝卜素,它们以色素蛋白复合体的形式存在于叶绿体中。叶片色素含量的下降与捕光色素蛋白复合体受损伤和色素降解加快有关,也与活性氧的伤害有关。由图2可知,胁迫前,接种AMF甜瓜幼苗(GMS0)叶绿素a和叶绿素b含量均显著高于未接菌株(CKS0),而接菌株(GMS0)类胡萝卜素含量却显著低于未接菌株(CKS0)。3 d时,接菌处理和未接菌处理叶绿素a和叶绿素b含量变化趋势基本一致;6 d时,GMS0和GMS120的chl a/chl b值均显著低于未接菌处理(CKS0和CKS120),9 d时,GMS120仍显著低于未接菌处理(CKS120),GMS60却显著高于未接菌处理(CKS60);S60和S120无论接菌与否,类胡萝卜素均呈先降后增再趋于平衡的趋势,且未接菌处理(CKS60和CKS120)3 d时降幅分别约为60%和75%,接菌处理(GMS60和GMS120)降幅分别约为14%和40%。
GM. 接菌处理;CK. 对照(不接菌);不同小写字母表示处理间在0.05水平差异显著。下同图1 弱光环境接种AMF对盐胁迫下甜瓜幼苗净光合速率的影响GM. Inoculation treatment;CK. Control (No inoculation): The different normal letters on each column indicate significant difference among treatments at 0.05 level. The same as belowFig.1 Effect of AMF on net photosynthetic rate of melon under salt stress and low light

图2 弱光环境接种AMF对盐胁迫下甜瓜幼苗叶片光合色素含量的影响Fig.2 Effect of AMF on photosynthetic pigment content in melon under salt stress and low light
2.4 弱光环境接种AMF对盐胁迫下甜瓜光合气体交换参数的影响
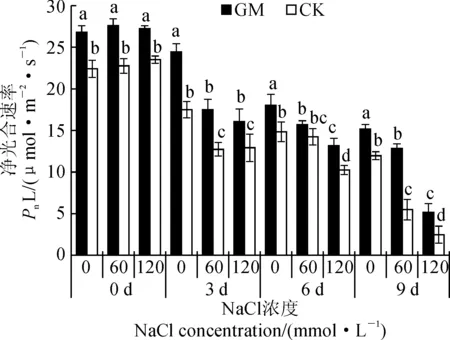
气孔是控制叶片内外水蒸汽和CO2扩散的通道,直接影响植物蒸腾和光合过程。由图3可知,胁迫前,气孔导度(Gs)变化无规律,接菌处理(GMS0)高于未接菌处理(CKS0)但差异较小;胁迫3 d时,接菌处理(GMS0、GMS120)气孔导度(Gs)均显著低于未接菌处理(CKS0、CKS120);胁迫6 d时,接菌处理(GMS0、GMS60、GMS120)Gs均显著低于相同盐浓度下未接菌处理(CKS0、CKS60、CKS120);胁迫9 d时,CKS60、CKS120的Gs均分别显著低于相同盐浓度接菌处理(GMS60、GMS120),且分别较6 d时下降了约70.1%和68.5%。表明未接菌株叶片气孔开闭对盐胁迫反应敏感,随盐浓度和盐胁迫时间延长,接菌株在盐胁迫下仍能较好的维持气孔开放。
胞间CO2浓度(Ci)的变化趋势与Gs相一致。胁迫3 d时,接菌处理(GMS0)Ci降低了9.7%且显著低于未接菌处理(CKS0);S0和S60处理的Ci无论接菌与否第6~9天均无显著差异,9 d时,GMS120显著低于未接菌处理(CKS120)。表明胁迫导致气孔的关闭或者减小,严重阻碍CO2从叶片进入叶绿体,导致Ci下降。
蒸腾作用是植物体内水分以气体的形式,从体内散失到体外的现象,是植物吸收水分和促进水分运输的主要动力,其主要受气孔的调节。蒸腾速率(Tr)在胁迫前期变化幅度均较小;胁迫6 d时,各盐浓度下接种处理的Tr均分别显著低于未接菌处理;9 d时较6 d各处理Tr均有所下降,且GMS0处理的Tr显著低于CKS0,而GMS60和GMS120处理的Tr则分别显著高于CKS60和CKS120。表明接种AMF增加了胁迫下甜瓜叶片的Tr,有效提高了植株的蒸腾拉力带动的吸水能力。
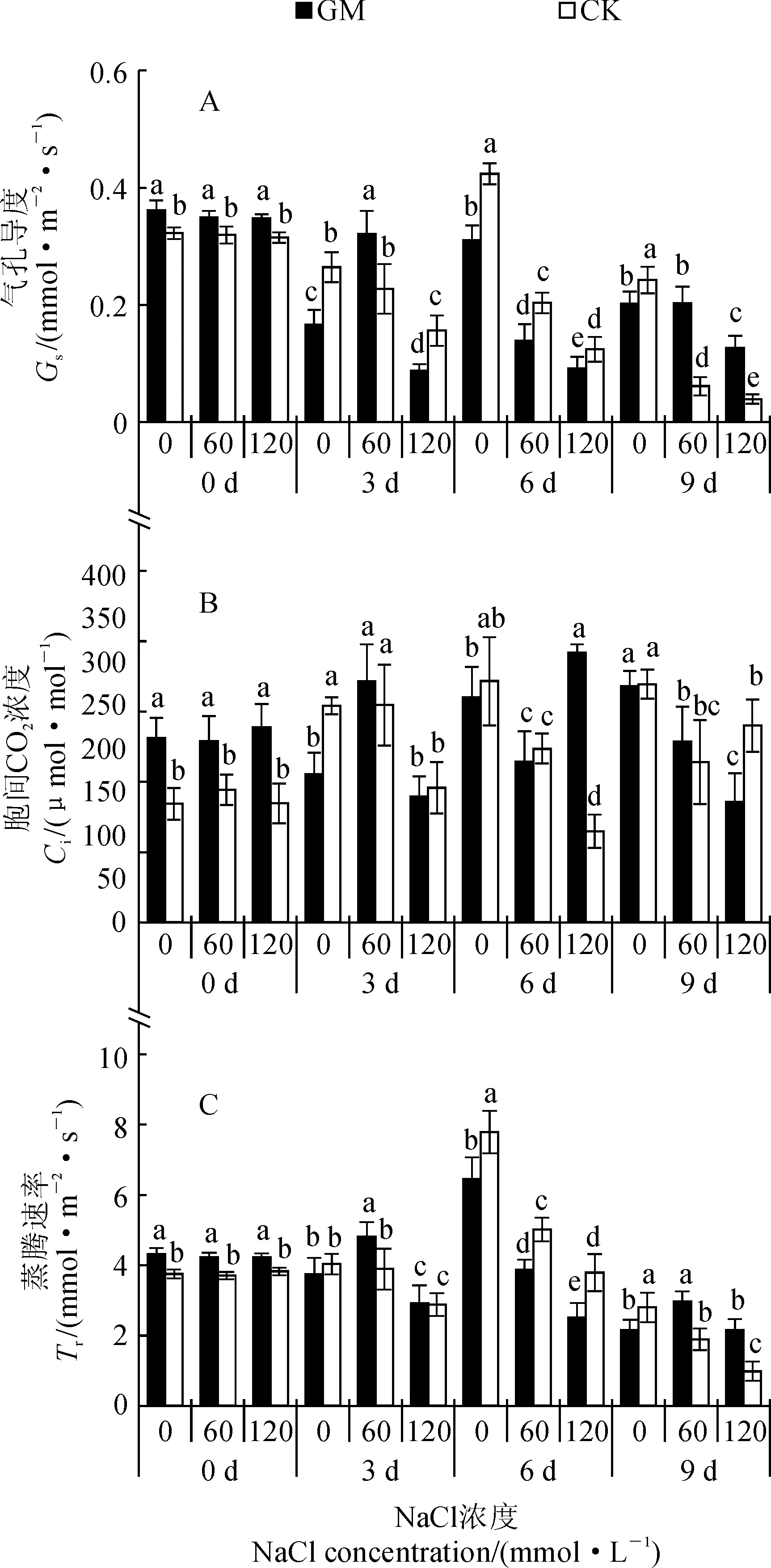
图3 弱光环境接种AMF对盐胁迫下甜瓜幼苗光合气体交换参数的影响Fig.3 Effect of AMF on photosynthetic gas exchange parameters of melon under salt stress and low light
2.5 弱光下接种AMF对盐胁迫下甜瓜叶片水分利用率(WUE)和气孔限制因子(Ls)的影响
由图4可知,胁迫前,接菌处理与未接菌处理的WUE无显著差异;胁迫3 d时,除GMS0外,其余各处理(CKS0、GMS60、CKS60、GMS120、CKS120)的WUE均呈下降趋势,且分别下降了27.9%、42.2%、45.9%、12.5%、26.2%;胁迫6 d时,相同盐浓度下,接菌处理WUE均显著高于未接菌处理;胁迫9 d时,接菌处理(GMS0和GMS60)的WUE同样高于未接菌处理(CKS0和CKS60),而GMS120和CKS120的WUE无明显差异,表明接种AMF后,增加了甜瓜的WUE,有利于植株在盐胁迫下生存。
胁迫前,接菌处理(GMS0)的Ls显著低于未接菌处理(CKS0);胁迫3 d时,S0和S120接菌处理(GMS0、GMS120)的Ls显著高于未接菌处理(CKS0、CKS120)。胁迫6 d时GMS120的Ls较3 d时降低了约59.9%,且显著低于CKS120;到9 d时,GMS120的Ls较6 d时上升了约94.9%,且显著高于CKS120。
2.6 弱光环境接种AMF对盐胁迫下甜瓜叶绿素荧光参数的影响
由图5可知,盐胁迫处理前,接种AMF处理(GMS0)的PSⅡ原初光能转换效率(Fv/Fm)、PSⅡ的光化学量子效率(ΦPSⅡ)和光化学猝灭系数(qP)均显著高于未接菌处理(CKS0),而非光化学猝灭系数(NPQ)则相反。整个盐胁迫期间除第3天时GMS120的Fv/Fm显著高于未接菌处理(CKS120)外,其他处理的Fv/Fm均比较稳定基本无差异。在整个胁迫期间,无盐处理(S0)的ΦPSⅡ和接菌处理(GMS0)均显著高于未接菌处理(CKS0);而S60和S120在胁迫前期和中期均显著低于胁迫前,且接菌处理与未接菌处理差异不大,到后期S60仍保持平衡,而S120呈上升趋势且较6 d时增幅分别约为70%和48%。qP变化趋势与ΦPSⅡ基本一致。0 d时,接菌处理(GMS0)NPQ显著低于未接菌处理(CKS0),并随盐胁迫浓度和时间的增加,接菌处理总体变化趋势低于未接菌处理。总之,接种AMF提高了甜瓜的Fv/Fm、ΦPSⅡ和qP,降低了NPQ。AMF可以提高PSⅡ的活性,增加PSⅡ的光化学效率,有助于提高光合速率。
2.7 弱光环境接种AMF对盐胁迫下甜瓜叶片光合电子传递速率(ETR)的影响
由图6可知,0 d时,无盐胁迫接菌处理(GMS0)的ETR显著高于未接菌处理(CKS0),胁迫3 d时,所有处理均较盐胁迫前有所降低,CKS60最高且较0 d时降低了约24.5%;无盐胁迫和接菌处理(GMS0、GMS120)均显著高于未接菌处理(CKS0、CKS120),且GMS120的ETR最高。表明随胁迫时间延长,接种AMF后甜瓜ETR增加,有利于提高植物的光合速率。
图4 弱光环境接种AMF对盐胁迫下甜瓜幼苗叶片水分利用率(WUE)和气孔限制因子(Ls)的影响Fig.4 Effect of AMF on water utilization ratio and stomatal limit factor of melon under salt stress and low light

图5 弱光环境接种AMF对盐胁迫下甜瓜幼苗叶绿素荧光参数的影响Fig.5 Effect of AMF on chlorophyll fluorescence parameters of melon under salt stress and low light
2.8 弱光环境接种AMF对盐胁迫下甜瓜光响应曲线的影响
如图7所示,从弱光及盐胁迫下接菌与不接菌处理对甜瓜叶片的光响应曲线来看,在光的响应过程中,接菌和未接菌植株在弱光及盐胁迫下的Pn都随着光合有效辐射(PAR)逐渐增大而增加。在0~300 μmol·m-2·s-1范围内,CKS0、CKS60与GMS0、GMS60均呈线性增长,当PAR增加接近光饱和点以后,接菌和未接菌植株的Pn随光强的增加表现出相对平缓的趋势。根据叶片光响应曲线模型,计算出弱光及盐胁迫下接种AMF甜瓜的光响应参数。
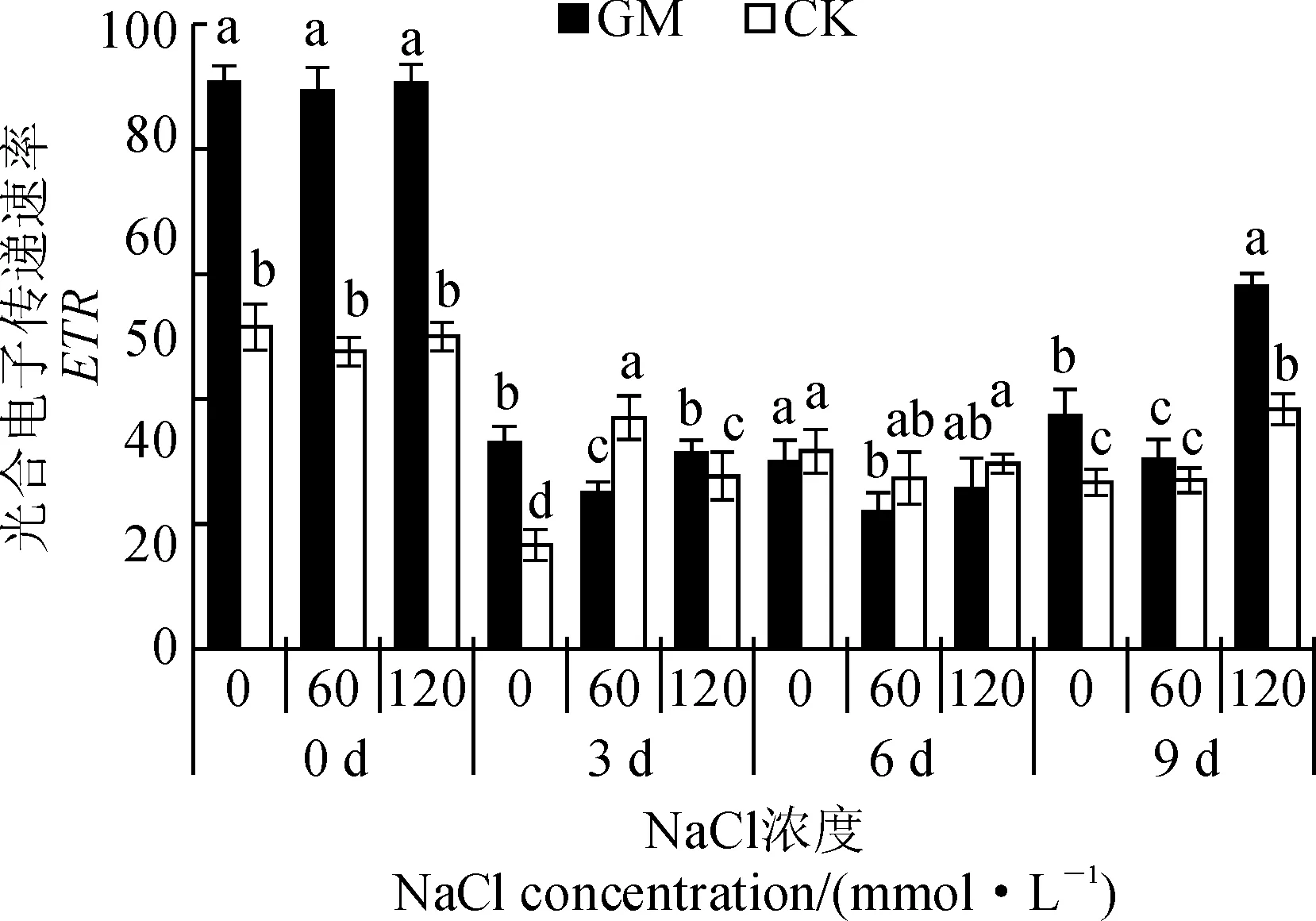
图6 弱光环境接种AMF对盐胁迫下甜瓜幼苗光合电子传递速率(ETR)的影响Fig.6 Effect of AMF on photosynthetic electron transfer rate (ETR) of melon under salt stress and low light
光响应曲线参数拟合结果(表2)表明,同一盐浓度下,接种AMF处理的光补偿点(LCP)和光饱和点(LSP)均高于未接菌处理,而最大羧化速率(Amax)在低盐和无盐(GMS0和GMS60)处理时均低于未接菌处理,高盐浓度(GMS120)胁迫时却高于未接菌处理(CKS120),说明在弱光和盐胁迫共同作用下接种AMF可以提高甜瓜幼苗叶片可用的最大光能辐射和高盐浓度胁迫下的最大羧化速率(Amax),但也会提高在较低光辐射时的光补偿点,而表观量子效率(AQE)在盐胁迫下无论接菌与否无显著差异(P>0.05)。低盐浓度处理无论接菌与否,暗呼吸速率(Rd)均高于无盐处理,但CKS120却显著降低,而GMS120仍保持较高值,说明低盐处理和接菌AMF在提高甜瓜幼苗叶片Rd同样具有协同作用。
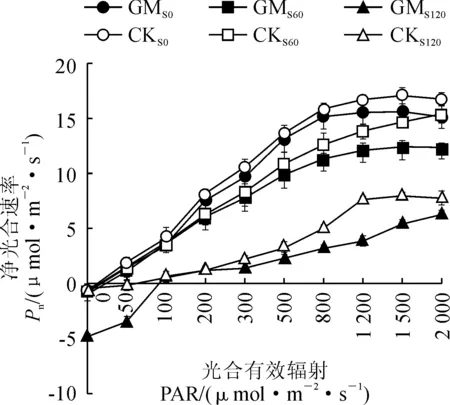
图7 弱光环境接种AMF对盐胁迫下甜瓜幼苗光响应曲线的影响Fig.7 Effects of AMF on light response curve of photosynthesis in melon seedlings under salt stress and low light
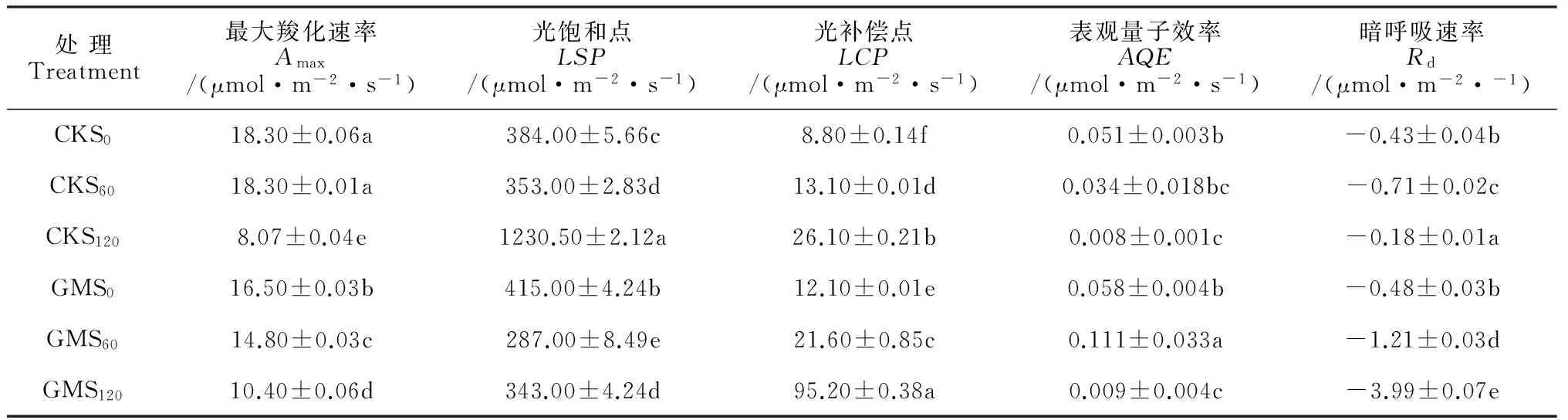
处理Treatment最大羧化速率Amax/(μmol·m-2·s-1)光饱和点LSP/(μmol·m-2·s-1)光补偿点LCP/(μmol·m-2·s-1)表观量子效率AQE/(μmol·m-2·s-1)暗呼吸速率Rd/(μmol·m-2·-1)CKS018.30±0.06a384.00±5.66c8.80±0.14f0.051±0.003b-0.43±0.04bCKS6018.30±0.01a353.00±2.83d13.10±0.01d0.034±0.018bc-0.71±0.02cCKS1208.07±0.04e1230.50±2.12a26.10±0.21b0.008±0.001c-0.18±0.01aGMS016.50±0.03b415.00±4.24b12.10±0.01e0.058±0.004b-0.48±0.03bGMS6014.80±0.03c287.00±8.49e21.60±0.85c0.111±0.033a-1.21±0.03dGMS12010.40±0.06d343.00±4.24d95.20±0.38a0.009±0.004c-3.99±0.07e
注:数据经邓肯氏新复极差法检验,表中小写字母表示P<0.05显著水平;数据均为3次重复均值; S0、S60、S120分别表示0、 60 和120 mmol·L-1NaCl;GM表示接菌;CK表示未接菌
Note: The data were tested by Duncan’s multiple range. Letters in the tables indicate significant level ofP<0.05; Data are the average of three replicates; S0, S60and S120expressed NaCl concentration; GM was treated with the inoculation of AMF; and CK was not inoculated
3 讨 论
叶绿素是高等植物进行光合作用最重要的色素,它是光合作用的光敏催化剂,影响到植物对光能的吸收、传递,与光合作用密切相关[20]。朱先灿等[21]研究表明,接种AMF促进了玉米叶片叶绿体的形成和叶绿素的合成速率,进而提高了菌根植株的光合能力。本研究发现,弱光及盐胁迫下,接种AMF甜瓜幼苗叶绿素a和叶绿素b含量均显著高于未接菌株。类胡萝卜素则呈现先降后增再趋于平衡的趋势,9 d时,接种AMF类胡萝卜素含量达到最大值。
盐胁迫导致植物生理性缺水,从而任何改善植物吸水能力或提高水分利用率的措施都能间接地增加植物的耐盐能力[22]。在盐胁迫条件下,植物的光合系统受到破坏,光合能力下降[23]。许多研究表明,菌根化植株受盐碱胁迫的危害程度能得到减轻[24]。Sheng等[25]研究发现,接种AMF的玉米植株在中等盐胁迫下仍有很好的气体交换状况,表明接种AMF能缓解盐胁迫对玉米植株气体交换能力的影响,提高玉米叶片的气体交换能力,从而减轻盐胁迫对玉米的危害程度。郑舜怡等[26]研究发现,AMF处理显著提高了辣椒植株叶片的Pn、Gs、Tr、WUE,而使Ci显著降低。本研究表明,弱光及盐胁迫下,接种AMF的甜瓜幼苗Pn、WUE、Ls均显著高于未接菌株,Gs、Tr、Ci则随胁迫时间延长不断增强。
叶绿素荧光参数在一定程度上反映了光合机构内部对于光能传递与转化的调控,AMF能够提高植物叶片的Fv/Fm[27]。本研究发现,接种AMF的Fv/Fm显著高于未接菌处理,且各处理间差异不显著,这说明弱光及盐胁迫下,短时间内对植株光吸收具有促进作用,且接种AMF会使得这种效应更加明显,胁迫一段时间后植株会受到一定程度的光抑制,但光合机构并未受损,这与光合色素的变化相吻合。qP反映了PSⅡ初级电子受体(QA)的氧化还原状态,是光反应中心有效应用于光化学反应的程度。qP的降低表明QA受到过度还原,由PSⅡ受损伤导致激发能压力过高,不能顺利传递电子,有效用于光化学反应的光反应中心减少。NPQ表示非光化学猝灭,可以直接反映天线色素热耗散的变化情况,是用于防御光破坏的有效热耗散机制,然而热耗散机制的增加必然降低光能转化效率和光合速率。本研究发现,盐胁迫下NPQ先降低后升高,且在胁迫中后期AMF处理与未接菌处理差异不显著,这说明弱光及盐胁迫共同作用下甜瓜叶片的热耗散方式发生了较为复杂的变化,叶片qP维持在比较平稳的状态。而通过增强NPQ来消耗多余的激发能以适应复合逆境,这与赵霞等[28]的研究结果相似。弱光及盐胁迫下,植株叶片光补偿点升高,光饱和点和最大潜在同化效率(Amax)随盐浓度的升高而降低,而接种AMF会进一步提高甜瓜叶片光饱和点和最大潜在同化效率(Amax),说明短时间的盐处理会刺激弱光下植株对光能的吸收和提高光合效率且接种AMF会使得这种效应更加明显,这与黄志等[17]研究结果相符。低盐浓度处理无论接菌与否,暗呼吸速率(Rd)均高于无盐处理,说明低盐处理和接种AMF在提高甜瓜幼苗叶片Rd同样具有协同作用。
综上所述,弱光环境接种AMF能显著增强盐胁迫下甜瓜幼苗的叶绿素含量、Pn、Tr、Fv/Fm等光合特性,提高甜瓜植株的光合能力,从而促进甜瓜的生长,提高植物对弱光下盐胁迫的耐受性。
参考文献:
[1]范远, 任长忠, 李品芳,等. 盐碱胁迫下燕麦生长及阳离子吸收特征 [J]. 应用生态学报, 2011,22(11):2 875-2 882.
FAN Y, REN C Z, LI P F,etal. Oat growth and cation absorption characteristics under salt and alkali stress [J].ChineseJournalofAppliedEcology, 2011,22(11):2 875-2 882.
[2]TEAKLE N L, TYERMAN S D. Mechanisms of Cl-transport contributing to salt tolerance [J].PlantCell&Environment, 2010,33(4):566.
[3]RUIZ-LOZANO J M, PORCEL R, AZCN C,etal. Regulation by arbuscular mycorrhizae of the integrated physiological response to salinity in plants: new challenges in physiological and molecular studies [J].JournalofExperimentalBotany, 2012,63(11):4 033-4 044.
[4]韩霜, 陈发棣. 植物对弱光的响应研究进展 [J]. 植物生理学报, 2013,49(4):309-316.
HAN S, CHEN F D. Research progress in plant response to weak light [J].PlantPhysiologyJournal, 2013,49(4):309-316.
[5]黄俊, 郭世荣, 吴震,等. 弱光对不结球白菜光合特性与叶绿体超微结构的影响 [J]. 应用生态学报, 2007,18(2):352-358.
HUANG J, GUO S R, WU Z,etal. Effects of weak light on photosynthetic characteristics and chloroplast ultrastructure of non-heading Chinese cabbage [J].ChineseJournalofAppliedEcology, 2007,18(2):352-358.
[6]姜超强, 李杰, 等. 盐胁迫对转AtNHX1基因杨树光合特性与叶绿体超微结构的影响[J]. 西北植物学报, 2010,30(2):301-308.
JIANG C Q, LI J,etal. Photosynthetic characteristics and chloroplast ultrastructure of transgenic poplar under NaCl stress [J].ActaBotanicaBoreali-OccidentaliaSinica, 2010,30(2):301-308.
[7]PIERREEMMANUEL C, MARC B, ABDALAGAMBY D,etal. The role of ectomycorrhizal communities in forest ecosystem processes: New perspectives and emerging concepts [J].SoilBiology&Biochemistry, 2010,42(5):679-698.
[8]张美月, 陶秀娟, 樊建民,等. 磷和丛枝菌根真菌对盐胁迫草莓光合作用的影响 [J]. 河北农业大学学报, 2009,32(4):71-75.
ZHANG M Y, TAO X J, FAN J M,etal. Effects of phosphorus stress and AMF on photosynthesis in strawberry under salt stress [J].JournalofAgriculturalUniversityofHebei, 2009,32(4):71-75.
[9]ZHANG Z, ZHANG J, HUANG Y. Effects of arbuscular mycorrhizal fungi on the drought tolerance ofCyclobalanopsisglauca, seedlings under greenhouse conditions [J].NewForests, 2014,45(4):545-556.
[10]DIATTA I L D, KANE A, AGBANGBA C E,etal. Inoculation with arbuscular mycorrhizal fungi improves seedlings growth of two sahelian date palm cultivars (L. cv. Nakhla hamra and cv. Tijib) under salinity stresses [J].AdvancesinBioscience&Biotechnology, 2014,4(1):64-72.
[11]KHALIL H A. Influence of Vesicular-arbuscula Mycorrhizal Fungi (Glomusspp.) on the response of grapevines rootstocks to salt stress [J].AsianJournalofCropScience, 2013,5(4):393-404.
[12]ZHU X C, SONG F B, XU H W. Arbuscular mycorrhizae improves low temperature stress in maize via alterations in host water status and photosynthesis [J].PlantandSoil, 2010,331(1):129-137.
[13]HUANG Z, ZOU Z,R, HE C,X,etal. Physiological and photosynthetic responses of melon (CucumismeloL.) seedlings to three Glomus species under water deficit [J].PlantandSoil, 2011,339(1):391-399.
[14]朱春燕. 甜瓜品种资源耐盐性及其指标评价 [D]. 上海:上海交通大学, 2011.
[15]许炜萍, 谢晓红, 黄志,等. AMF对弱光及盐胁迫下甜瓜生长和抗氧化酶活性的影响[J]. 西北植物学报, 2017,37(9):1 781-1 788.
XU W P, XIE X H, HUANG Z,etal. Physiological responses of melon (CucumismeloL.) seedlings toGlomusunder low light and salt stress[J].ActaBotanicaBoreali-OccidentaliaSinica, 2017,37(9):1 781-1 788.
[16]徐志然, 赵九洲, 等. 萌发期和幼苗期甜瓜品种耐盐碱性评价 [J]. 西北农林科技大学学报:自然科学版, 2015,43(4):99-107.
XU Z R, ZHAO J Z,etal. Salt-alkaline tolerance of melon (CucumismeloL.) at germinating and seedling stages[J].JournalofNorthwestA&FUniversity, 2015,43(4):99-107.
[17]黄志. 丛枝菌根真菌对甜瓜抗旱性的生理效应及分子机制的研究 [D]. 陕西杨陵: 西北农林科技大学, 2010.
[18]侯福林. 植物生理学实验教程 [M]. 北京:科学出版社, 2015.
[19]BOARDMAN N K. Comparative photosynthesis of sun and shade plants [J].AnnualReviewofPlantPhysiology, 2003,28(1):355-377.
[20]韩婷婷, 王维华, 郭绍霞. AM真菌对彩叶草光合特性的影响 [J]. 青岛农业大学学报(自然科学版), 2011,28(1):9-12.
HAN T T, WANG W H, GUO S X. Effects of arbuscular mycorrhizal fungi on photosynthetic characteristics ofColeusblumei[J].JournalofQingdaoAgriculturalUniversity(Natural Science), 2011,28(1):9-12.
[21]朱先灿, 宋凤斌, 徐洪文. 低温胁迫下丛枝菌根真菌对玉米光合特性的影响 [J]. 应用生态学报, 2010,21(2):470-475.
ZHU X C, SONG F B, XU H W. Effects of arbuscular mycorrhizal fungi on photosynthetic characteristics of maize under low temperature stress [J].ChineseJournalofAppliedEcology, 2010,21(2):470-475.
[22]揣泽尧, 王冬梅. 菌根真菌增强植物抗盐碱胁迫能力的研究进展 [J]. 华北农学报, 2010,25(b12):254-258.
CHUAI Z Y, WANG D M. Resource status of mycorrhizal fungi increase plant saline-alkaline tolerance [J].ActaAgriculturaeBoreali-Sinica, 2010,25(b12):254-258.
[23]严蓓, 孙锦, 束胜,等. 外源钙对NaCl胁迫下黄瓜幼苗叶片光合特性及碳水化合物代谢的影响 [J]. 南京农业大学学报, 2014,37(1):31-36.
YAN B, SUN J, SHU S,etal. Effects of exogenous calcium on photosynthetic characteristics and carbohydrate metabolism in leaves of cucumber (CucumissativusL.) seedlings under NaCl stress [J].JournalofNanjingAgriculturalUniversity, 2014,37(1):31-36.
[24]WU Q S, ZOU Y N,etal. Alleviation of salt stress in citrus seedlings inoculated with mycorrhiza: changes in leaf antioxidant defense systems [J].PlantSoil&Environment, 2010,56(10):470-475.
[25]SHENG M, TANG M, CHEN H,etal. Influence of arbuscular mycorrhizae on photosynthesis and water status of maize plants under salt stress [J].Mycorrhiza, 2008,18(6):287-296.
[26]郑舜怡, 郭世荣, 张钰,等. 丛枝菌根真菌对辣椒光合特性及根际微生物多样性和酶活性的影响[J]. 西北植物学报, 2014,34(4):800-809.
ZHENG S Y, GUO S R, ZHANG Y,etal. Effects of arbuscular mycorrhiza fungi on characteristics of photosynthesis microbial diversity and enzymes activity in rhizosphere of Pepper Plants Cultivated in Organic Substrate[J].ActaBotanicaBoreali-OccidentaliaSinica, 2014,34(4):800-809.
[27]曹岩坡, 戴鹏, 戴素英. 丛枝菌根真菌(AMF)对低温胁迫下黄瓜幼苗生长及叶绿素荧光参数的影响[J]. 河北农业科学, 2016,20(1):34-37.
CAO Y P, DAI P, DAI S Y. Effects of arbuscular mycorrhiza fungi on seedlings growth and chlorophyll fluorescence Parameters in cucumber under low temperature stress[J].JournalofHebeiAgriculturalSciences, 2016,20(1):34-37.
[28]赵霞, 杨华伟, 刘然方,等. 水稻热耗散对逆境的响应 [J]. 中国水稻科学, 2016,30(4):431-440.
ZHAO X, YANG H W, LIU R F,etal. Responses of heart dissipation in rice to stress [J].ChineseJournalofRiceScience, 2016,30(4):431-440.
