施氮时期对酿酒葡萄叶片氮代谢酶及相关基因表达的影响
2018-04-08马宗桓陈佰鸿胡紫璟李文芳
马宗桓,陈佰鸿,毛 娟,胡紫璟,李文芳
(甘肃农业大学 园艺学院,兰州 730070)
氮素是葡萄生长发育中必需元素之一,施用氮素可直接影响到葡萄的正常生长和产量形成。目前,在生产中存在施氮过量、施肥方式不合理等问题。当前,一次性基施氮肥是生产中普遍的施肥方式,造成了前期氮肥的严重流失和后期的氮素亏缺。因此,合理施肥技术是提高作物产量和品质的重要途径,目前施肥技术主要是指在施肥量、施肥时期和施肥种类等方面的调控。由于作物不同生育时期需肥规律不同,按照时期进行施肥对提高作物产量和品质具有重要的影响。氮肥合理施用能够使葡萄生长迅速,促进葡萄萌发和花芽分化,提高座果率,增加产量,改善果实品质[1]。研究表明,在葡萄生长后期过多的氮素会使浆果着色差,香气成分少,含糖量低,含酸量高,导致果实品质差[2]。张志勇等[3]实验结果表明,氮肥应重点施于葡萄花期之前,浆果膨大期至着色期可再适当补施。而冯国明[4]认为在葡萄生长周期中,花期至幼果膨大期对氮素的需求量最大,从果实着色期开始逐渐减少,果实成熟期吸收最少,待葡萄收获后,在葡萄再次生根时进一步吸收氮素。在新梢旺长期和浆果膨大期,葡萄吸收氮素量分别占其年周期内吸收氮素总量的24.5%和34.9%[5]。葡萄采收后,结合施基肥适当施一些速效性氮肥,有利于其后期叶片的光合作用、树体贮藏养分的积累。
植物对氮的同化方式是将NO3-转化为NH4+,然后经过一系列复杂的酶促反应将NH4+同化吸收,而在这一过程中,硝酸还原酶(NR)、谷氨酰胺合成酶(GS)、谷氨酸合成酶(GOGAT)和谷氨酸脱氢酶(GDH)是关键的调节酶,在氮素同化过程中扮演重要角色[6]。关于酿酒葡萄氮代谢酶和相关基因的表达已经有较为广泛的研究[7-10]。初建青等[11]利用Vitis EST 数据库中EST序列片段结合RT-PCR方法克隆了与氮代谢相关的NR、亚硝酸还原酶(NiR)、GS、GDH和天冬酰胺合成酶(AS)的基因,发现以0.3%和0.5%浓度的尿素对5个基因的表达水平影响明显,5个基因在幼叶的表达水平显著高于老叶,并且在不同时间段的表达水平差异不一致。王剑等[12]以‘夏黑’葡萄(Vitislabruscana‘Black Summer’)为试材,对5个氮代谢基因(VvGHD、VvNiR、VvNR、VvGS和VvAS)在叶面喷施不同氮肥处理后的表达情况进行了分析,认为喷施氮肥后5个氮代谢基因的表达水平均上调,喷施氮肥不同,同一基因在响应强度和时间上存在差异。王添民[13]以日光温室中盆栽扦插幼苗为材料,研究了不同硝铵比条件下葡萄叶片中氮代谢酶活性及其基因表达水平,研究表明,较高的硝态氮比例促进整个生育期VvNR的表达水平上调,反之,则有利于VvGS上调表达。前人的研究主要集中在对成龄树叶面喷施尿素水溶液和盆栽幼苗根施氮肥以探讨外源氮素对叶片氮代谢分子调控的影响,对成龄树土壤施入氮肥对叶片氮代谢酶相关基因表达水平的影响还未见报道。且在葡萄生产中氮肥主要以土壤施入为主,准确掌握施肥时期对葡萄生产尤为重要,传统的技术理论已不能满足现代农业生产的要求。因此,本研究以生长势较好,产量稳定的10年生‘蛇龙珠’酿酒葡萄自根苗为试材,通过连续3年按照试验设计进行田间管理后,在第3年取样测定相关指标,以期在生理及分子水平上阐明不同时期施入尿素对不同生育期葡萄叶片氮代谢的影响,为葡萄园合理施肥,提高N素利用率提供一定的理论依据。
1 材料和方法
1.1 试验材料与设计
田间试验于2013~2015年在甘肃武威市黄羊镇莫高葡萄酒原料基地进行,连续3年在试验区按照试验设计进行水肥管理,于2015年田间取样测定各项指标,指标测定于甘肃农业大学园艺学院果树生理与生物技术实验室完成。原料基地土壤为中性到弱碱性的砾质沙壤土,土层深厚,透气好,土壤有机质为0.62%,pH值为7.8,速效氮为0.9 g·kg-1,速效磷为22 mg·kg-1,速效钾为123 mg·kg-1。年降雨量191 mm,蒸发量2 130.8 mm,年平均日照时数为2 724.8 h,≥10 ℃的有效积温在2 800 ℃~3 200 ℃,年平均温度6.9 ℃,气候凉爽,无霜期160 d,生产期光照充足,昼夜温差大。
试验所用材料为10年生‘蛇龙珠’葡萄,其在该地区的主要物候期为萌芽期4月25日、盛花期6月5日、转色期8月17日、采收期10月1日。基地葡萄采用单篱架,株行距为1 m×3 m。采用滴管灌溉,尿素随水施入,磷钾肥在葡萄植株两侧开沟施入,磷肥在出土灌水前施入,钾肥在果实转色期施入。滴灌带为大禹节水有限公司生产,壁厚0.2 mm,滴孔间距30 cm,单孔出水量3 L·h-1,灌水量及时间参照“武威莫高酿造葡萄滴灌配水定额表”,在试验中根据实际情况有所调整。实验中反转录试剂盒、荧光定量染料SYBR Premix Ex Taq kit 购自大连TaKaRa 公司。引物合成由生工生物工程(上海)股份有限公司完成。
试验共设置6个氮肥施用时期,即在萌芽期(S1,4月25日)、新梢旺长期(S2,5月15日)、开花期(S3,6月5日)、果实第一次膨大期(S4,6月25日)、副梢生长旺期(S5,7月20日)和果实第二次膨大期(S6,8月25日)分别施入尿素300 kg·hm-2,其他时期均不再施入氮肥,以整个生育期不施氮肥为对照(CK)。试验每小区为一个处理,每处理设置3个生物学重复,各处理随机分布,共设置21个小区。为提高试验的可信度,小区面积设置为240 m2,每个小区定植40株葡萄,取样时在同一棵葡萄树上不重复取样。之后,分别于5月31日(花前5 d,DBF5)、6月30日(花后25 d,DAF25)、7月31日(花后55 d,DAF55)和8月31日(花后85 d,DAF85)采取叶片测定相关指标。
1.2 测定指标及方法
按照设计时间选取新梢中部功能叶片,每重复摘取4片叶,每处理3个重复,共计12片叶,采样后置于冰盒带回实验室测定总氮、蛋白及酶活性。选取新梢顶部新叶,置于液氮中带回实验室,保存在超低温冰箱用于RNA提取。
1.2.1相关生理指标叶片总氮含量采用凯氏定氮法测定[14],蛋白质含量采用考马斯亮蓝G-250法(Boradford法)[15]进行测定。NR活性采用磺胺比色法[16]测定;GS活性使用[16]FeCl3络合显色比色法测定;GDH活性采用南京建成生物研究所GDH测定试剂盒测定,以每克组织每分钟消耗1 nmol NADH定义为一个酶活力单位;GOGAT活性参照赵鹏[17]的方法进行测定。
1.2.2总RNA提取及VvNR、VvGS、VvGDH、VvGOGAT表达分析RNA 提取采用改良CTAB 法[18]。以提取的总RNA 为模板,用 Reverse Transcriptase M-MLV(RNase H-)试剂盒进行cDNA 第1 链的合成,将0.5 ~ 2 μg 纯化的总RNA 反转录成第1 链cDNA,作为基因扩增及实时荧光定量PCR(Real-time quantitative PCR,qRT-PCR)的模板。其中,实验中应用实时荧光定量PCR 仪(LightCycler®96 Real-Time PCR System,Roche,瑞士),使用SYBR GreenⅠ(TaKaRa)试剂盒。内参基因为UBI(GenBank accession number:XM_002266714),扩增体系含2 μL cDNA,0.8 μL上、下游引物[13,18](表1),10 μL 反应MIX,6.4 μL ddH2O,总体积20 μL。反应程序为:95 ℃下变性30 s,95 ℃变性5 s,60 ℃下退火30 s,40 个循环;95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。反应结束后分析荧光值变化曲线及熔解曲线。基因的相对表达量采用2-ΔΔCT计算。
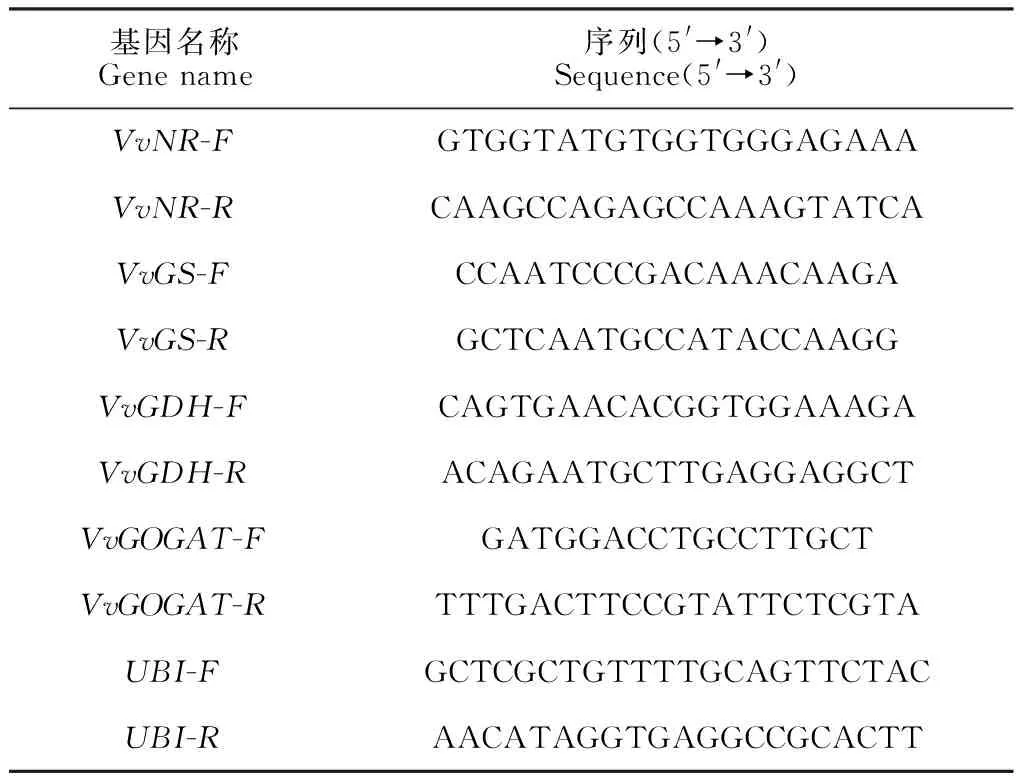
表1 qRT-PCR引物
1.3 数据分析
用Origin8.5 软件对数据进行整理和作图,用SPSS17.0 统计软件对数据进行统计分析,采用最小显著差异法(LSD)检测不同数据组间的差异显著性,显著性水平设定为α = 0.05,线性相关性分析采用Pearson分析法。
2 结果与分析
2.1 施氮时期对葡萄叶片可溶性蛋白及总氮含量的影响
各时期施氮处理(S1~S6)葡萄叶片可溶性蛋白含量在各取样时期均显著高于同期对照(图1,A)。其中,在DBF5时,S1和S2处理分别显著高于对照21.2%和13.0%,S1又显著高于S2处理;在DAF25时,S1~S4处理显著高于对照12.3%~33.4%,表现为S1 >S2 >S4 >S3,但S3、S4处理间无显著差异;在DAF55时,S1~S5处理间无显著差异,它们显著高于对照25.5%~26.3%;在DAF85时,叶片可溶性蛋白含量在S5和S6处理下显著高于其他处理,并在S4、S3、S2和S1处理下依次降低,而S4和S3间无显著差异,各处理显著高于对29.7%~37.8%。同时,各时期施氮处理叶片总氮含量表现出与可溶性蛋白含量相似的变化趋势,均显著高于同期对照,并总体上随生育期呈先升高后降低的变化趋势,且在花后25d时最高(图1,B)。其中,在DBF5时,S1和S2叶片氮含量分别显著高于对照27.0%和12.8%;在DAF25时,各处理显著高于对照19.9%~38.6%,S1和S2显著高于S3和S4处理;在DAF55时,S3叶片氮含量(9.8 mg·kg-1)显著高于其他处理,S2、S1和S4处理次之,S5显著较低;在DAF85时,叶片总氮含量在S3、S4、S5和S6处理下显著高于S1和S2处理,而前四者间及后两者间均无显著差异,各处理显著高于对照28.4%~39.9%。以上结果说明:施入氮素后显著促进了叶片中可溶性蛋白和全氮含量的增加,花前施入氮素有利于葡萄生育前期叶片可溶性蛋白及总氮含量的积累,花后施氮延缓了葡萄生育后期可溶性蛋白和总氮的降低。
2.2 施氮时期对葡萄叶片氮代谢关键酶活性的影响
首先,葡萄叶片硝酸还原酶(NR)活性随着叶片发育逐渐增大,且各施氮处理均显著高于同期对照(图2,A)。其中,在DBF5时,S1和S2分别显著高于对照6.7%和7.2%;在DAF25时,S1处理NR活性(5.4 mg·g-1·h-1)显著高于其他处理,其他处理表现为S3>S2>S4,且各处理差异显著;在DAF55时,S3和S4处理NR活性显著较高,S1和S2处理居中,S5处理显著较低;在DAF85时,所有处理NR活性均比DAF55时大幅度提高,显著高于对照37.9%~61.1%,S3处理NR活性(15.6 mg·g-1·h-1)显著高于其他处理,其余处理从高到低依次为S4、S5、S1、S2和S6,且各处理间均存在显著性差异。

图中数据为均值±标准误差,同期不同字母表示不同处理间在0.05水平存在显著性的差异(P<0.05)。S1.萌芽期施氮;S2.新梢旺长期施氮;S3.开花期施氮;S4.果实第一次膨大期施氮;S5.副梢生长旺期施氮;S6.果实第二次膨大期施氮;CK.不施氮肥。DBF5.花前5 d;DAF25.花后25 d;DAF55.花后55 d; DAF85.花后85 d。下同图1 各施氮时期处理葡萄叶片可溶性蛋白及总氮含量的变化Data are presented as the means±standard error. The different letters in each sampling time indicate significant differences in different treatments at 0.05 level (P<0.05).S1. Supplied nitrogen in budding. S2. Supplied nitrogen in the new shoot growing stage. S3. Supplied nitrogen in the flowering stage. S4. Supplied nitrogen in the first enlargement of the fruit. S5. Supplied nitrogen in the sublateral shoot growth period. S6. Supplied nitrogen in the second enlargement of the fruit; CK.No nitrogen fertilizer.DBF5. Before flowering 5 days. DAF25. After flowering 25 days. DAF55. After flowering 55 days. DAF85. After flowering 85 days. The same as belowFig.1 The soluble protein and total nitrogen contents in leaves of Vitis vinifera with different nitrogen application periods
其次,叶片谷氨酰胺合成酶(GS)活性也基本上随叶片发育逐渐增大,各施氮时期处理均显著高于同期对照(图2,B)。其中,在DBF5时,S1和S2处理叶片GS活性分别显著高于对照8.9%和28.2%;在DAF25时,各处理GS活性比DBF5时均大幅度增加,且以S2最高,它们显著高于同期对照35.0%~40.6%;在DAF55时,各处理GS活性比DBF25时有所降低,其中的S5处理又显著低于同期其余处理;在DAF85时,各处理GS活性比DAF55大幅升高,其中的S3处理(0.73 μmol·mg-1·h-1)显著高于其他处理,S4处理次之,再次为S2、S5和S6处理,各处理比对照显著提高7.4%~28.8%。
再次,叶片谷氨酸合成酶(GOGAT)活性在不同施氮时期处理下也均显著高于同期对照(图2,C)。其中,S1和S2处理GOGAT活性随生育期波动变化,并在DAF25时达到最高值,随后在DAF55时大幅降低58.6%和66.7%,保持在较低水平;S3和S4处理GOGAT活性在DAF55和DAF85时均高于其他处理,并在DAF85时达到最高值; S5处理GOGAT活性在DAF55时与S1和S2处理相近,在DAF85时与S4处理接近;S6处理在DAF85时低于其他处理,但与S1和S2处理无显著差异。
此外,叶片谷氨酸脱氢酶(GDH)活性在不同时期施氮处理下均不同程度地高于同期对照,并在DAF25时升至最高水平,而在DBF5和DAF85时均较低(图2,D)。其中,在DBF5时,S1处理叶片GDH活性显著高于对照22.6%,S2与对照相近;在DAF25时,S1和S2处理GDH活性(184.5和204.8 U·g-1)分别比DBF5提高了62.2%和71.4%,但仍低于S3和S4处理(225.0和227.3 U·g-1),各处理比对照显著增加44.8%~55.1%;在DAF55时,各施氮处理间GDH活性均无显著差异;在DAF85时,S3、S4和S5处理GDH活性均高于其他处理,其次为S1处理,最低为S2、S6处理和CK。

图2 各施氮时期处理葡萄叶片氮代谢酶活性的变化Fig.2 The activities of nitrogen metabolism enzymes in leaves of V. vinifera with different nitrogen application periods
以上结果说明施氮可以显著促进叶酿酒葡萄片中NR、GS、GDH和GOGAT活性的增加,S3和S4处理下叶片中4个酶活性均保持较高的水平,尤其在葡萄生育后期,S3和S4处理叶片NR、GS、GDH和GOGAT活性相比其他处理显著升高,有利于叶片中氮素的转化和转移。
2.3 施氮时期对葡萄叶片氮代谢关键酶基因表达的影响
首先,各时期施氮处理葡萄硝酸还原酶基因(VvNR)表达量在各取样时期均比对照上调(图3,A)。其中,S1和S2处理VvNR表达水平在DBF5时一致,两者在DAF25、DAF55和DAF85时表达水平均显著低于其他施肥处理;S3和S4处理VvNR表达在DAF25时显著上调,分别为对照的3.4和3.2倍;S3、S4和S5处理表达水平在DAF55时分别为对照的3.2倍、3.0倍和3.0倍;S5和S6处理表达水平在DAF85时无显著差异,均对照的2.8倍,此时S2处理表达水平最低,为对照的1.4 倍。
其次,葡萄叶片谷氨酰胺合成酶基因(VvGS)表达水平在各施氮处理下均不同程度地高于同期对照(图3,B)。其中,S1和S2处理VvGS表达量在DBF5时差异显著,分别为对照的3.2倍和2.8倍;在DAF25时,S1、S2和S3 处理VvGS表达量均上调,其中以S3表达水平最高,为对照的1.7倍,此时S4处理的VvGS表达水平与对照无显著差异;在DAF55时,S3、S4和S5 处理VvGS表达水平差异显著,其中也以S3处理表达水平最高,为对照的4.7倍,此时S2处理表达水平为对照的1.5倍,而S1处理表达水平与对照无显著差异。在DAF85时,S1和S2处理VvGS表达水平与对照无差异,S3和S4处理显著上调表达,分别为对照的4.5倍和5.5倍。
再次,葡萄叶片谷氨酸合成酶基因(VvGOGAT)表达水平在各施氮处理下也得到不同程度促进(图3,C)。其中,在DBF5时,S1和S2处理VvGOGAT表达水平均显著高于对照,而两者间无显著差异;在DAF25时,S2处理的VvGOGAT表达水平显著高于其他处理,为对照的3.9倍,S1和S3处理分别为对照的1.2和2.0倍,S4处理与对照无显著差异;在DAF55时,S1、S2、S3和S4处理叶片VvGOGAT表达量分别为对照的2.5倍、1.8倍、3.3倍和2.0倍,S5处理与对照无显著差异;在DAF85时,S3 处理叶片的VvGOGAT表达水平最高(对照的3.7倍),其次为S4和S5处理(对照的3.0倍),S1和S2处理VvGOGAT表达水平无差异,为对照的1.9倍,S6处理与对照无显著差异。
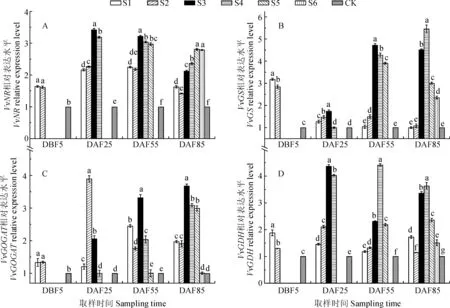
图3 各施氮时期处理葡萄叶片氮代谢关键酶基因表达水平Fig.3 The gene expression of key enzymes involved in nitrogen metabolism in leaves of V. vinifera with different nitrogen application periods
另外,施氮肥后葡萄叶片谷氨酸脱氢酶基因(VvGDH)表达水平在各个时期均显著上调(图3,D)。其中,在DBF5时,S1和S2处理叶片VvGDH表达水平差异显著,它们分别为对照的1.9和1.3倍;在DAF25时,叶片VvGDH的表达水平由高到低依次为S3、S4、S2和S1处理,分别为对照的4.4倍、4.0倍、2.1倍和1.5倍;在DAF55时,不同处理叶片VvGDH表达量差异显著,并以S4处理表达水平最高(对照的4.4倍),S1、S2、S3和S5 处理则分别为对照的1.2倍、1.3倍、2.3倍和2.2倍;在DAF85时,不同处理叶片VvGDH表达水平差异显著,其中的S4处理表达水平最高(对照的3.6倍),其次为S3处理(对照的3.4倍),S2处理表达水平最低,仅为对照的1.1倍。
以上结果说明不同生育期施入氮素均促进了VvNR、VvGS、VvGDH和VvGOGAT的表达,尤其是花期以后施入氮素叶片中VvNR表达水平维持在较高水平,其中S3和S4处理显著促进了不同时期叶片的VvGS和VvGDH表达水平,S3处理对生育后期叶片VvGOGAT表达水平促进效果显著。
3 讨 论
氮素被称为“生命元素”,是果树生长发育过程所必需矿质营养元素中的核心元素,氮素的营养调控是果树获得最佳果实产量和品质的必需手段。研究认为氮素对果树的干物质积累量的影响最大,施用氮肥能使树体的氮素含量显著增加,各器官干物质含量均有增加,从而促进植株的快速生长[19]。氮素对作物的生殖生长影响重大,徐海英[20]认为葡萄是需氮量较高的树种,在所有必需营养元素中,氮素是形成葡萄产量的首要因素。本研究发现,不同时期施入尿素均增加了叶片中可溶性蛋白和总氮含量,同时,氮代谢酶(NR、GS、GDH和GOGAT)活性显著升高,在DAF85时,随施肥时期的延后,叶片中可溶性蛋白含量随之增加,S5和S6处理可溶性蛋白含量增加最为明显,但二者之间无显著差异。在甘蔗中研究发现,施氮时期延后甘蔗中蛋白质的含量随之增加[21],与本研究基本一致。S1处理叶片中可溶性蛋白含量在DBF5和DAF25时均显著高于其他处理,S1处理总氮含量在DAF25前最高,在DAF25时与S2处理总氮含量无差异,并显著高于其他处理。这两个时期叶片中氮素含量较高可能与该时期植株氮素主要来源于葡萄多年生器官贮藏的氮素有关。同时,NR是植物吸收利用氮素的第一个关键酶[22],而两个时期NR活性较低,也可说明这两个时期葡萄叶片氮素只有少量来源于土壤。有研究表明,葡萄果实膨大期至果实成熟期为氮素的最大需求期和最大效率期,在生产上氮肥施用时期应适当后移[23]。对冬小麦研究发现,施氮时期的后移可提高开花后功能叶片的NR活性[24],玉米花后施氮使灌浆期叶片GS、GOGAT和GDH活性较高,同时能够延长酶活性保持较高活性的时期[25]。本研究中S3、S4和S5处理叶片中NR、GS、GOGAT和GDH活性在DAF85时保持较高的水平,并且以S3处理叶片中酶活性最高,其中NR活性在该时期不仅显著高于同期其余处理,而且远高于各处理其余生育时期的NR活性。同时,花后施氮肥葡萄叶片中总氮含量在DAF85时增加显著,因此,S3、S4和S5施氮处理可能通过改变氮素调控酶的活性从而延长了氮素的吸收和转化过程。
施肥是葡萄生产中重要的农事操作,葡萄施肥时间的选择往往都是根据作物的生长情况或物候期,是一种经验性的操作,难以做到指导当年精确施肥的水平。另外,由于不同年份环境与气候等外界因素的差异,当年的调查信息用于来年的田间管理也是不够理想与科学的[12]。本研究对葡萄新叶4个氮代谢关键基因在不同处理下的表达水平进行了分析,发现各处理VvNR表达水平在不同时期均高与相应对照,S3处理VvNR表达水平在DAF25时为对照的3.4倍,在DAF85仍为对照的2.7倍;S3和S4处理VvGS表达水平分别在DAF55和DAF85时达到最高;S3处理VvGOGAT和S4处理VvGDH表达水平在DAF55和DAF85均显著高于其他处理,S3处理VvGDH表达水平在DAF55和DAF85仅次于S4处理。葡萄在成花期叶面喷施0.2%尿素后,叶片中VvNR、VvGS和VvGDH的相对表达水平均会上调,但不同基因的响应时间不同[12]。施氮可增加花生各器官中可溶性蛋白质和游离氨基酸的含量,同时提高NR、GS和GDH的活性[26]。本研究中,施氮后叶片中总氮、可溶性蛋白含量、氮素代谢酶和对应基因的表达水平同步增加,S3和S4两个时期施氮显著促进了4个氮代谢基因表达水平升高。施入氮素后,氮素可能诱导了叶片中氮代谢相关基因的上调表达,从而调控对应酶的活性,增加了叶片中总氮及蛋白的含量。因此,通过检测叶片4个氮素代谢基因的表达水平可以间接反映树体氮素营养水平是可行的。S3和S4两个时期VvNR、VvGS、VvGDH和VvGOGAT表达水平相比其他处理上调显著,更有利于叶片氮素的积累和转化,从而为进一步促进叶片的碳同化,增强源(叶)库(果)间同化产物的转移,进而改善果实品质提供了可能。后期将主要以此为切入点,分析氮素施用时期如何影响源库间的关系。
参考文献:
[1]于坤, 郁松林, 许雯博, 等. 干旱区膜下滴灌不同灌水和施氮水平对‘赤霞珠’葡萄幼苗氮素代谢和根系发育的影响[J]. 果树学报, 2013,30(6):975-982.
YU K, YU S L, XU W B.etal. Effects of water and nitrogen treatments on nitrogen metabolism and root development ofVitisvinifera‘Cabernet Sauvignon’ seedlings under mulched drip irrigation in the arid area[J].JournalofFruitScience, 2013,30(6):975-982.
[2]RAATH/L P J. Effect of varying levels of nitrogen, potassium and calcium nutrition on table grape vine physiology and berry quality[D].Stellenbosch.StellenboschUniversity, 2012.
[3]张志勇, 马文奇. 酿酒葡萄‘赤霞珠’养分累积动态及养分需求量的研究[J]. 园艺学报, 2006,33(3):466-470.
ZHANG Z Y, MA W Q. Studies on the requirement and accumulative trend of nutrients in wine grape‘Cabernet Sauvignon’[J].ActaHorticulturaeSinica, 2006,33(3):466-470.
[4]冯国明. 成龄葡萄施肥要点[J]. 河北果树, 2007,(6):50-51.
FENG G M. Fertilization points of mature grape[J].HebeiFruits, 2007,(6):50-51.
[5]马文娟, 同延安, 高义民. 葡萄氮素吸收利用与累积年周期变化规律[J]. 植物营养与肥料学报, 2010,16(2): 504-509.
MA W J, TONG Y A, GAO Y M. Study on nitrogen absorption, utilization and accumulation in grape tree[J].PlantNutritionandFertilizerScience, 2010,16(2): 504-509.
[6]孙园园, 孙永健, 吴合洲, 等. 水分胁迫对水稻幼苗氮素同化酶及光合特性的影响[J]. 植物营养与肥料学报, 2009,15(5):1 016-1 022.
SUN Y Y, SUN Y J, WU H Z.etal. Effects of water stress on activities of nitrogen assimilation+ enzymes and photosynthetic characteristics of rice seedlings[J].PlantNutritionandFertilizerScience, 2009,15(5):1 016-1 022.
[7]周月琴, 庞磊, 李叶云, 等.茶树硝酸还原酶基因克隆及表达分析[J].西北植物学报, 2013,33(7):1 292-1 297.
ZHOU Y Q, PANG L, LI Y Y,etal. Cloning and expression analysis of nitrate reductase gene inCamelliasinensis[J].ActaBotanicaBoreali-OccidentaliaSinica, 2013,33(7):1 292-1 297.
[8]EICHELBERGER K D, LAMBERT R J, BELOW F E.etal. Divergent phenotypic recurrent selection for nitrate reductase activity in maize. II. Efficient use of fertilizer nitrogen[J].CropScience, 1989,29(6):1 398-1 402.
[9]DE-BASHAN L E M P, ANTOUN H, BASHAN Y. Role of glutamate dehydrogenase and glutamine synthetase in chlorella vulgaris, during assimilation of ammonium when jointly immobilized with the microalgae-growth-promoting bacterium azospirillum brasilense 1[J].JournalofPhycology, 2008,44(5):1 188.
[10]汤玉玮, 林振武, 陈敬祥. 硝酸还原酶活力与作物耐肥性的相关性及其在生化育种上应用的探讨[J]. 中国农业科学, 1985,18(6):39-45.
TANG Y W, LIN Z W, CHEN J X. Study on the correlation between nitrate reductase activity and nitrogen response in crop plant and its application in biochemical plant breeding[J].ScientiaAgriculturaSinica, 1985,18(6):39-45.
[11]初建青, 岳林旭, 房经贵, 等. 尿素对葡萄5个氮代谢相关基因表达的影响[J]. 园艺学报, 2013,40(2):221-230.
CHU J Q, YUE L X, FANG J G.etal. Effects of fertilizer application on expression of genes related to nitrogen metabolism in Fujiminori Grapevine[J].ActaHorticulturaeSinica, 2013,40(2):221-230.
[12]王剑, 李炳锐, 李晓鹏, 等. 利用葡萄氮代谢基因的表达评价不同氮肥肥效[J]. 园艺学报, 2016,43(1):1-14.
WANG J, LI B R, LI X P,etal. Evaluation of N fertilizers effects based on the expression of N metabolic genes[J].ActaHorticulturaeSinica, 2016,43(1):1-14.
[13]王添民. 不同硝铵比对赤霞珠葡萄幼苗碳氮同化及氮代谢相关酶基因表达的影响[D]. 陕西杨陵:西北农林科技大学, 2014.
[14]熊炳霖, 王鑫月, 陈道钳. 苗期玉米叶片碳氮平衡与干旱诱导的叶片衰老之关系[J].西北植物学报, 2016,36(3):534-541.
XIONG B L, WANG X Y, CHEN D Q. Carbon/nitrogen balance associate with drought-induced leaf senescence in maize(Zeamays)seedling[J].ActaBotanicaBoreali-OccidentaliaSinica, 2016,36(3):534-541.
[15]田晓涵, 张梦丹, 庞学兵, 等. 陆地棉GhCDPK1基因响应干旱胁迫的功能初探[J].西北植物学报, 2016,36(8):1 515-1 521.
TIAN X H, ZHANG M D, PANG X B.etal. Preliminary exploration for function of cottonGhCDPK1 gene under drought stress[J].ActaBotanicaBoreali-OccidentaliaSinica, 2016,36(8):1 515-1 521.
[16]施晟璐, 叶冰竹, 张润枝. 缺氮和复氮对菘蓝幼苗生长及氮代谢的影响[J].西北植物学报, 2015,35(3):523-529.
SHI S L, YE B Z, ZHANG R Z. Effect of N deficiency and N recovery on growth and nitrogen metabolism of isatis indigotica seedlings[J].ActaBotanicaBoreali-OccidentaliaSinica, 2015,35(3):523-529.
[17]赵鹏, 何建国, 熊淑萍, 等. 氮素形态对专用小麦旗叶酶活性及籽粒蛋白质和产量的影响[J]. 中国农业大学学报, 2010,15(3): 29-34.
ZHAO P, HE J G, XIONG S P.etal. Studies on the effects of different nitrogen forms on enzyme activity in flag leaves in wheat and protein and yield of grain for specialized end-uses[J].JournalofChinaAgriculturalUniversity, 2010,15(3): 29-34.
[18]马宗桓, 毛娟, 李文芳, 等. 葡萄SnRK2家族基因的鉴定与表达分析[J]. 园艺学报, 2016,43(10):1 891-1 902.
MA Z H, MAO J, LI W F.etal. Identification and expression profile of the SnRK2 family genes in grapevine[J].ActaHorticulturaeSinica, 2016,43(10):1 891-1 902.
[19]JORDAN M O, VERCAMBRE G, BOT J L,etal. Autumnal nitrogen nutrition affects the C and N storage and architecture of young peach trees[J].Trees, 2011,25(2):333-344.
[20]徐海英, 张国军, 闫爱玲. 葡萄标准化生产与施肥[J]. 中外葡萄与葡萄酒, 2007,(3):19-24.
XU H Y, ZHANG G J, YAN A L. Standardized production and fertilization of grape[J],Sino-OverseasGrapevine&Wine,2007,(3):19-24.
[21]杨声澉. 不同施氮时期和施氮终止期对甘蔗氮素吸收分布影响的研究[D]. 南宁:广西大学, 2008.
[22]李磊, 王锐, 纪立东, 等. 氮肥施用量对酿酒葡萄初果期生长及产量品质的影响[J]. 北方园艺, 2016,(21):32-36.
LI L, WANG R, JI L D.etal. Effects of nitrogen fertilizer application on Beginning growth, yield and quality of wine grape[J].NorthernHorticulture, 2016,(21):32-36.
[23]史祥宾, 杨阳, 翟衡,等. 不同时期施用氮肥对巨峰葡萄氮素吸收、分配及利用的影响[J]. 植物营养与肥料学报, 2011,17(6):1 444-1 450.
SHI X B, YANG Y, ZHAI H.etal. Effects of N fertilization on nitrogen absorption, distribution and utilization of Kyoho grape[J].PlantNutritionandFertilizerScience, 2011,17(6):1 444-1 450.
[24]岳寿松, 于振文. 不同生育时期施氮对冬小麦氮素分配及叶片代谢的影响[J]. 作物学报, 1998,24(6):811-815.
YUE S S, YU Z W. Effects of nitrogen distribution and leaf metabolism on nitrogen application of winter wheat at different growth stages[J].ActaAgronomicaSinica, 1998,24(6):811-815.
[25]刘淑云, 董树亭, 赵秉强, 等. 长期施肥对夏玉米叶片氮代谢关键酶活性的影响[J]. 作物学报, 2007,33(2):278-283.
LIU S Y, DONG S T, ZHAO B Q.etal. Effects of long-term fertilization on activities of key enzymes related to nitrogen metabolism(ENM)of maize leaf[J].ActaAgronomicaSinica, 2007,33(2):278-283.
[26]张智猛, 万书波, 宁堂原,等. 氮素水平对花生氮素代谢及相关酶活性的影响[J]. 植物生态学报, 2008,32(6):1 407-1 416.
ZHANG Z M, WAN S B, NING T Y,etal. Effects of nitrogen level on nitrogen metabolism and cor-relating enzyme activity in peant[J].ActaPhytoecologicaSinica, 2008,32(6):1 407-1 416.
