密旋链霉菌Act12遗传转化系统的建立与优化
2018-04-08李晓霞马怡茗文冰洁舒伟学薛泉宏贾良辉
李晓霞 ,马怡茗,文冰洁,舒伟学,薛泉宏,贾良辉 ,颜 华
(1.西北农林科技大学 生命科学学院,陕西杨凌 712100; 2.西北农林科技大学 环境资源学院,陕西杨凌 712100)
链霉菌(Streptomyces)是一类高G+C 含量的革兰氏阳性细菌,能够产生种类繁多的次级代谢产物,如抗生素、色素、酶抑制剂、免疫调节剂等。目前所发现的12 000 余种天然抗生素中约2/3由链霉菌产生,其中许多已在人类医药(如抗肿瘤等)、农业和畜牧业中体现出重要的应用价值[1-2]。
密旋链霉菌(Streptomycespactum)Act12是西北农林科技大学资源环境学院薛泉宏教授从青藏高原土壤中分离到的1株链霉菌[3]。前期研究表明,Act12对6种土传病原真菌木贼镰刀菌、接骨木镰刀菌、尖孢镰刀菌西瓜专化型、芬芳镰刀菌、尖孢镰刀菌棉花专化型、尖孢镰刀菌黄瓜专化型均有拮抗作用[4];对苹果腐烂菌、油菜菌核菌等多种植物病原菌也有很强的抑制作用,具有良好的生防应用潜质。同时,Act12对草莓[3]、甜瓜[5]、魔芋[6]等作物有良好的促生作用,并能增强魔芋的抗病能力。目前的研究主要集中在Act12的生防及促生的理化试验方面,对其具体的分子机理研究甚少。而要研究其分子机理并进一步开发利用,首要条件则是建立合适的遗传转化系统。
链霉菌中常用的外源遗传物质导入的方法有原生质体转化、电转化以及接合转移。链霉菌通常有很强的限制修饰系统[6],接合转移由于操作相对简便,外源基因不易受到宿主的限制性修饰[7],较常用于链霉菌的遗传转化。大肠杆菌-链霉菌属间接合转移的方法在1989年首次报道[8],特别是在使用甲基化缺陷型大肠杆菌作为供体以及大量大肠杆菌链霉菌穿梭质粒被成功构建后[9],该方法被进一步优化,广泛应用于链霉菌的遗传转化操作。由于接合转移过程中涉及多种因素,而不同的链霉菌种又有不同的特性,所以针对不同的链霉菌种,甚至链霉菌株,往往需要对接合转移条件进行改进与优化,达到将外源遗传物质高效导入的目的。近年来,仍有大量链霉菌通过接合转移的方法成功构建遗传转化体系,如xinaomycins产生菌诺尔斯链霉菌(Streptomycesnoursei)[10],Toyocamycin产生菌淀粉产色链霉菌1628(Streptomycesdiastatochromogenes1628)[11],Streptovaricin产生菌壮观链霉菌NRRL2994(StreptomycespectabilisNRRL2994)[12],以及Azalomycin F产生菌链霉菌211726[13]遗传转化系统的构建。
在对Act12进行全基因组测序的基础上,通过生物信息学分析发现其中有大量可能的次级代谢产物基因簇,包括:PKSⅠ(Ⅰ型聚酮合酶)、PKSⅡ(Ⅱ型聚酮合酶)、NRPS(非核糖体肽)、Lassopeptide(套索肽)、Terpene(萜类)生物合成基因簇等。为了对其展开研究,进而探讨其活性机理,本试验通过对接合转移过程涉及的多个因素进行优化,建立了Act12的高效遗传操作系统。
1 材料与方法
1.1 材 料
1.1.1菌株与质粒试验所用菌株:受体菌为密旋链霉菌Act12,供体菌为大肠杆菌S17-1,质粒克隆宿主菌为DH5a。
本研究所用质粒:pSET152为大肠杆菌-链霉菌穿梭整合型质粒,带有阿普霉素抗性基因[9];pMD18-T载体带有Amp抗性,购于TAKARA公司; pKC1139温敏穿梭质粒,带有Apr抗性,在大肠杆菌中39 ℃不能自主复制[9]。
1.1.2培养基和抗生素Act12的固体培养为高氏一号,液体培养为TSB[14];接合转移使用的培养基有:高氏一号、2CMY,改良2CMY、GSY、MS、MS(+质量分数0.1%的KNO3)以及MS(质量分数0.05% 的MgSO4)[15];孢子预萌发培养基为2×YT[15];接合子传代和筛选使用的培养基分别为高氏一号和TSB[15];发酵培养基为SPY(胰蛋白胨质量分数0.2%,酵母提取物质量分数0.4%,淀粉质量分数1%,氯化钠质量分数0.8%,pH=7.2);大肠杆菌培养基为LB。
抗生素使用的质量浓度为:卡那霉素(Kan) 50 mg/L, 阿普霉素(Apr) 50 mg/L ,萘啶酮酸25 mg/L,氨苄青霉素(Amp)100 mg/L。
1.2 方 法
1.2.1抗生素耐受测定选取卡那霉素、阿普霉素、红霉素、潮霉素以及萘啶酮酸5种抗生素分别加入固体高氏一号培养基中,至质量浓度分别为0、1、2、4、6、8、10 mg/L。划线接种Act12孢子在28 ℃培养10 d。观察菌种生长情况。
1.2.2常用的分子生物学方法大肠杆菌转化和质粒提取参照分子克隆指南[16];链霉菌基因组DNA提取参考链霉菌操作手册[15]。
1.2.3接合转移将穿梭整合型质粒pSET152通过热激法转入大肠杆菌S17-1中,得到供体菌S17-1/pSET152。挑取单克隆接种于5 mL LB液体试管中(含Apr 50 mg/L、Kan 50 mg/L),37 ℃ 过夜培养后按照体积比1∶100的比例接种于40 mL的 LB液体培养基,37 ℃、180 r/min至OD600为0.4~0.6,离心收集菌体,并用等体积的新鲜LB液体清洗菌体2次,然后将菌体悬浮于0.5 mL的LB培养基中备用。同时刮取在高氏一号培养基上生长8 d的新鲜Act12孢子,放入加有玻璃珠及10 mL无菌水的100 mL锥形瓶中,28 ℃摇床上振摇30 min破碎孢子,然后用无菌脱脂棉过滤后7 000 r/min离心10 min后倒掉上清,用0.5 mL的2×YT重悬孢子,45~55 ℃热激10 min预萌发后,37 ℃、150 r/min萌发2~3 h。将备用的大肠杆菌和萌发好的Act12孢子按照体积比1∶1的比例混合,每150 μL涂布于接合转移培养基上,28 ℃培养16~20 h后涂布萘啶酮酸(质量浓度25 mg/L)和阿普霉素(质量浓度1~10 mg/L), 28 ℃继续培养3~5 d后可观察接合子。本试验中供体大肠杆菌数量保持108不变,受体Act12孢子量从105~108以10倍递增。以肉眼可分辨的接合子为准,接合效率用接合子数除以孢子量表示,数据取3次试验平均值。
1.2.4PCR验证接合子长出的接合子在带有抗性的高氏一号培养基上抗性交替传代4次后接种于TSB液体培养基中培养3 d,提取基因组DNA作为PCR模版。根据pSET152质粒上带有的Apr抗性基因设计上下游引物,以Act12基因组DNA为阴性对照模版,pSET152质粒DNA为阳性对照模版,扩增Apr抗性基因。PCR反应程序为:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,33个循环;72 ℃ 7 min。
引物由上海生工生物工程技术服务有限公司合成,引物序列如下:AMF 5′-3′ GGTTCATGTGCAGCTCCATCAGC;AMR 5′-3′ ATGAGCTCAGCCAATCGACTGG[17]。
1.2.5 敲除突变株 Δspa0520的获得与筛选通过antiSMASH网站分析Act12全基因组草图序列,找到一个预测为Lassopeptide的基因簇,对该基因簇内的基因进行分析,推测其中的TetR家族调控基因 spa0520可能为负调控基因,尝试用同源重组的方法将该基因阻断使其不能表达,看能否激活这个基因簇,从而产生新的次级代谢产物。
从pET28a载体上扩增得到kanamycin抗性基因片段,连入pMD18-T载体测序正确后得到pMD18-T-Kan质粒载体。
设计上游同源片段引物:
spa0520-U-F(p1)(EcoRI) 5′-3′GGAATTCCCGGGAAGATCAACCTCGA;
spa0520-U-R(p2)(XbaI) 5′-3′ GCTCTAGAGCCGCTTACAGCGCCTTTG。
PCR扩增得到 spa0520基因上游同源片段即为U,用EcoRⅠ和XbaⅠ分别双酶切pMD18-T-Kan质粒和PCR扩增得到的片段U,得到带有EcoRⅠ和XbaⅠ粘性末端的线性pMD18-T-Kan和U片段,使用T4连接酶将其进行连接,得到pMD18-T-Kan-U质粒。
设计下游同源片段引物:
spa0520-D-F(p3)(PstⅠ)5′-3′ AACTGCAGGACGGGAGGGGAGCCCCTT; spa0520-D-R(p4)(HindⅢ)5′-3′ CCCAAGCTTGACACCGTCGTCGTCTGCT。
PCR扩增得到 spa0520基因下游的同源片段即为D,用PstⅠ和HindⅢ分别双酶切pMD18-T-Kan-U质粒和PCR扩增得到的片段D,得到带有PstⅠ和HindⅢ粘性末端的线性pMD18-T-Kan-U和D片段,使用T4连接酶连接得到pMD18-T-Kan-U-D质粒。使用EcoRⅠ和HindⅢ双酶切pMD18-T-Kan-U-D和pKC1139质粒,得到线性的pKC1139和U-Kan-D片段,连接后即得用于基因敲除的质粒pKC1139-U-Kan-D,命名为pKT0520质粒。
将转入质粒pKT0520的大肠杆菌S17-1与Act12通过大肠杆菌-链霉菌之间的接合转移技术,成功地将重组质粒pKT0520转至Act12中,获得相关接合子,该接合子可在含有卡那霉素(质量浓度为10 mg/L)、阿普霉素(质量浓度为10 mg/L)和萘啶酮酸(质量浓度为25 mg/L)的高氏一号固体培养基上筛选获得,培养温度为28 ℃。刮取长势良好的接合子孢子,利用划线稀释法涂布于含有卡那霉素和萘啶酮酸的高氏一号固体培养基上,置于40 ℃培养。由于pKC1139的温敏型复制子在高于39 ℃时不能复制,迫于选择压力重组质粒pKT0520依靠同源臂与宿主染色体发生同源重组整合到宿主Act12染色体上(图1),从而获得相关双交换敲除突变菌株。
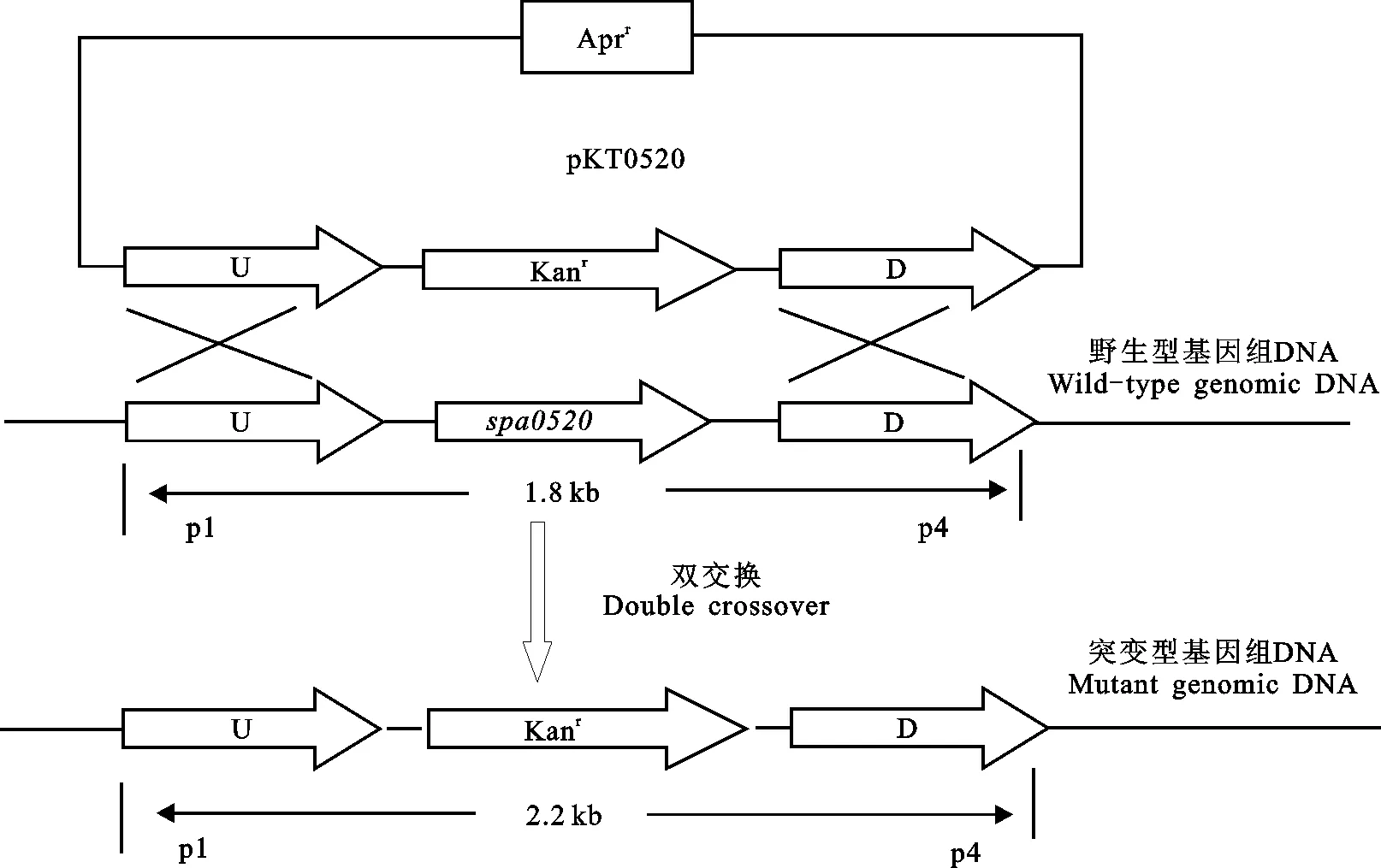
图1 敲除质粒pKT0520 与Act12染色体同源区域发生双交换的示意图Fig.1 Schematic diagram of gene replacement between plasmid pKT0520 and chromosomes of Act12
将温敏筛选获得的单克隆敲除子传代至含有卡那霉素的高氏一号固体培养基上进行扩大培养,随后将长势良好的敲除子印记到安普霉素抗性平板上,筛选获得安普霉素敏感的双交换突变株 Δspa0520,最后用相关引物进行PCR扩增验证。
1.2.6菌株发酵与代谢产物分析收集Act12及突变株 Δspa0520的新鲜孢子接种于100 mL的TSB种子培养基,28 ℃振荡培养48 h;按体积比1∶10的比例转种于200 mL的SPY发酵培养基,28 ℃振荡培养7 d后。将发酵物按体积比1∶1的比例用乙酸乙酯萃取3次,收集上层有机相并将上层有机相利用旋转蒸发仪蒸发浓缩至干,浓缩获得的萃取物溶于1 mL甲醇,并用0.22 μm的有机滤膜过滤除菌,用于后续的HPLC检测。HPLC条件:C18反向柱; 流动相A为水,B为甲醇,梯度洗脱(0~5 min,10% B;5~35 min,10%~100% B;35~45 min,B;45~50 min,100%~10% B)(体积比);流速1 mL/min;进样量25 μL;检测波长210 nm。
2 结果与分析
2.1 密旋链霉菌Act12对抗生素的敏感性测试
为了确定可用于密旋链霉菌Act12遗传转化操作的抗性选择标记,分别检测Act12对卡那霉素、阿普霉素、红霉素、潮霉素的耐受度。另外,为保证萘啶酮酸在抑制大肠杆菌时不会对Act12的生长有影响,同时测定Act12对萘啶酮酸的耐受度。结果如表1所示,Act12对阿普霉素和卡那霉素非常敏感,在质量浓度为1.0 mg/L的阿普霉素和卡那霉素平板上不能生长;对潮霉素比较敏感,在质量浓度为4.0 mg/L的潮霉素平板上不能生长;对红霉素和萘啶酮酸不敏感,在质量浓度为25.0 mg/L的红霉素和萘啶酮酸平板上可以生长。表明阿普霉素和卡那霉素抗性基因可以用来作为Act12遗传操作的抗生素选择标记。
2.2 接合转移培养基的选择
试验选择7种不同的接合转移培养基,分别是高氏一号、2CMY,改良2CMY(+质量分数0.1% KNO3)、GSY、MS、MS(+质量分数0.1%KNO3)以及MS(质量分数0.05%MgSO4)。其中高氏一号是Act12生长的最适培养基,而2CMY、GSY和MS是3种比较经典的接合转移培养基,其余几种培养基则是根据文献报道对其进行了适当改良。
结果(表2)表明,无论是原始的MS培养基,还是2种改良后的MS培养基,均没有接合子长出。在改良2CMY、GSY、高氏一号培养基上可以长出接合子,其中改良2CMY的接合子数量最多;GSY接合子生长旺盛与大肠杆菌混在一起,难以挑取单菌落;高氏一号上面接合子数量较少。因此,选择改良2CMY培养基作为接合转移培养基。

表1 密旋链霉菌Act12对不同抗生素的敏感性Table 1 Sensitivity of Streptomyces pactum Act12 to antibiotics
注:“-” Act12不生长;“+”Act12生长微弱;“++”Act12生长良好。
Note:“-” Act12 don’t grow;“+”Act12 growth is weak;“++”Act12 grows well.
2.3 热激温度及时间对接合转移效率的影响
热激处理的目的是为了促进孢子预萌发,孢子预萌发是影响接合效率的一个重要因素。试验中选取45 ℃、50 ℃、55 ℃,每个温度分别热激处理5 min、10 min、15 min,然后在37 ℃摇床上萌发2.5 h。结果见表3~4:在50 ℃ 热激10 min的预萌发条件下接合效率最高为2.079×10-5。当温度在55 ℃时并没有接合转化子出现。因此,确定孢子最佳预萌发条件为50 ℃热激10 min。

表2 密旋链霉菌Act12在不同培养基上的接合转移效率Table 2 Conjugation transfer efficiency of Streptomyces pactum Act12 on different media
2.4 接合转移时间和抗生素浓度对接合转移效率的影响
接合转移时间选择3个时间段(表5),分别为16 h、18 h和20 h。将供体大肠杆菌和受体孢子等体积混合涂布在接合转移培养基之后,在28 ℃培养箱中分别培养16 h、18 h和20 h,然后涂布萘啶酮酸(质量浓度25 mg/L)和适量的阿普霉素。阿普霉素质量浓度选择4个梯度,分别为0、3 mg/L、6 mg/L、10 mg/L。涂布抗生素后继续在28 ℃培养箱中培养3~5 d。不同接合转移时间和抗生素浓度下的接合转移结果分别见表5和表6。
由结果可知,Act12的接合转移最适时间是18 h。最适Apr抗生素质量浓度是10 mg/L。

表3 热激温度对接合转移效率的影响Table 3 Influence of heat temperature on conjugation frequency

表4 热激时间对接合转移效率的影响Table 4 Influence of heat time on conjugation frequency

表5 接合转移时间对接合转移效率的影响Table 5 Influence of conjugate transfer time on conjugation frequency

表6 抗生素质量浓度对接合转移效率的影响Table 6 Influence of antibiotics mass concentration on conjugation frequency
2.5 接合子的验证
通过优化后的方法,质粒pSET152能以较高的效率转入Act12中。由于pSET152是整合型质粒,需要整合到Act12的基因组上才能获得稳定的接合子。随机挑选接合子,在TSB液体培养基中培养3 d后收集菌丝体,提取基因组DNA,用阿普抗性基因的引物进行PCR扩增。以野生型Act12基因组DNA为阴性对照模版,pSET152质粒DNA为阳性对照模版。PCR结果如图2所示。
由图2可以看出,质粒pSET152和接合子DNA均扩增出Apr抗性基因的条带,而野生型Act12基因组DNA未扩增出条带,由此可以证明pSET152已成功转入Act12中。
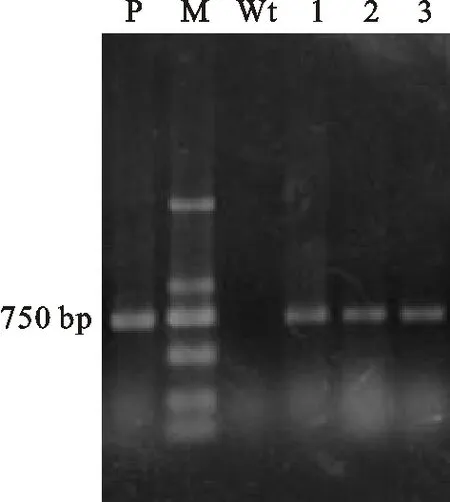
P.质粒pSET152的PCR验证产物PCR-amplified bands of plasmid pSET152;Wt.野生型Act12基因组DNA的PCR验证产物PCR-amplified bands of wild-type Act12 genetic DNA;M.DL2000 maker;1~3.接合子的PCR验证产物PCR-amplified bands of exconjugants
图2接合子的PCR验证
Fig.2PCRidentificationofexconjugants
为了验证接合子的遗传稳定性,随机挑选100个接合子在只加入萘啶酮酸和加入萘啶酮酸以及阿普霉素的高氏一号培养基上进行抗性交替传代,传代4次后接合子仍生长良好,没有出现抗性消失的菌落。再挑取10个接合子接入加有萘啶酮酸和阿普霉素的TSB液体培养基中培养,均可以生长,提取总DNA,经PCR验证后与之前的接合子验证结果一致。表明pSET152质粒可以在Act12中稳定遗传。
2.6 spa0520基因的敲除与验证
通过温敏筛选得到双交换的 spa0520基因缺失突变株 Δspa0520。提取相关基因组DNA,使用引物 spa0520-U-F(p1)和 spa0520-D-R(p4)进行PCR验证。PCR相关验证表明 spa0520基因的双交换缺失突变株构建成功。
图3中,Act12对应的PCR扩增条带大约为1.8 kb,而 spa0520基因缺失突变株 Δspa0520对应的PCR扩增条带大约为2.2 kb,PCR试验结果与预期相符(图1),证实 spa0520基因缺失突变株 Δspa0520构建成功。

图3 PCR扩增验证 spa0520基因缺失突变株Fig.3 PCR amplification of spa0520 deleted mutant
2.7 突变株次级代谢产物变化分析
野生型Act12和突变株 Δspa0520的发酵液HPLC分析结果见图4。HPLC检测结果表明:在出峰时间30 min的位置,突变株 Δspa0520对应的吸收峰显著增强,对应的化合物命名为X;通过积分面积求得X的产量较之于野生型Act12的产量提高了6倍。基因敲除试验结果表明,在Act12中 spa0520基因对化合物X的生物合成起负调控作用。
此外,利用滤纸片法对Act12和 Δspa0520的发酵萃取液的抑菌活性进行相应检测。试验结果表明,突变株 Δspa0520较之于野生型Act12对苹果腐烂病菌、核桃溃疡病菌、油菜菌核病菌和小麦根腐病菌的拮抗活性明显增强,本试验结果预示着化合物X可能具有抗真菌活性;为此笔者将化合物X进行分离纯化,最后鉴定化合物X为寡霉素D。已有研究表明寡霉素D具有良好的抗真菌活性,这与本试验所涉及的有关发酵产物抑菌活性检测的试验结果相吻合(该部分试验结果另文发表)。

图4 Act12和 Δspa0520发酵产物的HPLC检测结果Fig.4 HPLC chromatograms of fermentation broth from Act12 and Δspa0520
3 讨 论
本试验以密旋链霉菌Act12为出发菌株,建立其遗传转化系统并进行了优化,为后期研究其机理并进一步开发其应用价值奠定了基础。鉴于接合转移具有操作相对简便等优点,本试验优先利用接合转移法建立其遗传转化系统。
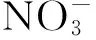
Act12遗传转化系统的建立,促使对其进行遗传操作成为可能,这为后续对Act12进行机理研究以及进一步开发利用奠定了坚实的基础。
参考文献Reference:
[1]徐丽华,李文均,刘志恒,等.放线菌系统学——原理、方法及实践[M].北京:科学出版社,2007:6-30.
XU L H,LI W J,LIU ZH H,etal.Actinomycetes Systematics-Principle,Method and Practice [M].Beijing:Science Press,2007:6-30.
[2]CHATER K F.Genetics of differentiation inStreptomyces[J].AnnuReviewMicrobiology,1993,47:685-713.
[3]许英俊,薛泉宏,邢胜利,等.3株放线菌对草莓的促生作用及对PPO活性的影响[J].西北农业学报,2008,17(1):129-136.
XU Y J,XUE Q H,XING SH L,etal.The growth promoting effect and induced endurance of three actinomyces strains to strawberry[J].ActaAgriculturaeBoreali-occidentalisSinica,2008,17(1):129-136.
[4]赵娟,薛泉宏,王玲娜,等.多功能放线菌Act12对土传病原真菌的拮抗性及其鉴定[J].中国生态农业学报,2011,19(2):394-398.
ZHAO J,XUE Q H,WANG L N,etal.Antagonistic effect of multifunctional actinomycete strain Act12 on soil-borne pathogenic fungi and its identification [J].ChineseJournalofEco-Agriculture,2011,19(2):394-398.
[5]何斐,张忠良,崔鸣,等.链霉菌剂对魔芋的促生防病作用[J].应用与环境生物学报,2015,21(5):866-871.
HE F,ZHANG ZH L,CUI M,etal.Growth promotion and disease prevention effects of streptomyces onAmorphophalluskonjacK.Koch ex N.E.Br[J].ChineseJournalofApplied&EnvironmentalBiology,2015,21(5):866-871.
[6]FLETT F,MERSINIAS V,SMITH C P.High efficiency intergeneric conjugal transfer of plasmid DNA fromEscherichiacolito methyl DNA-restricting streptomycetes[J].FEMSMicrobiologyLetters,1997,155(2):223-229.
[7]MAZODIER P,DAVIES J.Gene transfer between distantly related bacteria [J].AnnualReviewofGenetics,1991,25(1):147-171.
[8]MAZODIER P,PETTER R,THOMPSON C.Intergeneric conjugation betweenEscherichiacoliandStreptomycesspecies[J].Bacteriol,1989,171:3583-3585.
[9]BIERMAN M,LOGAN R,O′BRIEN K,etal.Plasmid cloning vectors for the conjugal transfer of DNA fromEscherichiacolitoStreptomycesspp[J].Gene,1992,116:43-49.
[10]SUN FH,LUO D,SHU D,etal.Development of an intergeneric conjugal transfer system for xinaomycins-producingStreptomycesnourseiXinao-4 [J].InternationalJournalofMolecularSciences,2014,15(7):12217-12230.
[11]MA Z,LIU J,BECHTHOLD A,etal.Development of intergeneric conjugal gene transfer system inStreptomycesdiastatochromogenes1628 and its application for improvement of toyocamycin production[J].CurrentMicrobiology,2014,68(2):180-185.
[12]宋姣姣,康前进,张连茹,等.曲张链菌素产生菌壮观链霉菌NRRL2494菌株遗传操作体系的建立[J].厦门大学学报(自然科学版),2016,55(1):60-66.
SONG J J,KANG Q J,ZHANG L R,etal.Gene manipulation on system for streptovaricin producerStreptomycesspectabilisNRRL2494[J].JournalofXiamenUniversity(NaturalScienceEdition),2016,55(1):60-66.
[13]马艳玲,刘富来,张敏,等.阿扎霉素F产生菌链霉菌211726基因转移系统的建立[J].生物技术通报,2016,32(4):198-202.
MA Y L,LIU F L,ZHANG M,etal.The construction of the gene transfer system of strainStreptomycessp.211726 producing Azalomycin F [J].BiotechnologyBulletin,2016,32(4):198-202.
[14]咸洪泉.微生物学实验教程[M].北京:高等教育出版社,2010:376-391.
XIAN H Q.Experimental Technique of Microbiology[M].Beijing:Higher Education Press,2010:376-391.
[15]KIESER T,BIBB M J,BUTTNER M J,etal.Practical Streptomyces Genetics:a Laboratory Manual [M].Norwich:The John In-nes Foundation,2000:3-11.
[16]GREEN M R,SAMBROOK J.Molecular Cloning:a Laboratory Manual[M].4th ed.New York:Cold Spring Harbor Laboratory Press,2012:26-99.
[17]PETZKE L,LUZHETSKYY A.In vivo Tn5-based transposon mutagenesis ofStreptomycetes[J].AppliedMicrobiologyandBiotechnology,2009,83(5):979-986.
