铜尾矿库剑叶金鸡菊根际尾矿和植株的重金属元素含量及相关性分析
2018-04-08徐德聪孙庆业沈章军陈延松
徐德聪, 孙庆业, 沈章军, 陈延松
(1. 合肥师范学院生命科学学院, 安徽 合肥 230601; 2. 安徽大学资源与环境工程学院, 安徽 合肥 230601)
尾矿库是由矿石选别后排出的尾矿砂或其他工业废渣被筑坝拦截后形成的场所,结构松散、持水力差、养分匮乏、富含重金属,植物定居困难。在尾矿库扬沙沉降和地表径流过程中,重金属严重污染了周边的土壤和下游水体[1-3],并破坏了周边环境,因此,亟待对尾矿库进行复垦,修复其生态环境。
目前,关于尾矿库复垦的技术较多[4-6],植物修复技术为尾矿库复垦的常用方法之一,具有安全、廉价等优点。根据植物修复的作用过程和机制,植物修复技术可分为植物提取(phytoextraction)和植物固定(phytostabilization)2种类型[7],其中,植物提取技术要求植物生物量大且根系发达,能够将土壤中大量的重金属元素转移至植物的地上部;植物固定技术是利用植物将土壤中的重金属元素吸收并固定在植物的根部。为了提高尾矿库植物修复的成功率,人们对植物吸收和积累重金属元素的特征进行了大量研究[8-12],从而发现一些重金属元素的耐性植物和超积累植物,但是,这些植物大多具有生长缓慢、生物量小、地域性强、机械化操作困难及不能适应尾矿库的恶劣环境等特性,严重制约了植物修复技术在尾矿库复垦方面的应用。
相关研究结果[13-15]表明:野生的乡土植物大多较重金属积累植物更适于作为当地尾矿库的植物修复材料。剑叶金鸡菊(CoreopsislanceolataLinn.)为多年生宿根花卉,根系发达,易栽培,常可通过根部大量繁殖,地上部可多次收获,不必每年播种[16-17];2年生剑叶金鸡菊在4月底至5月初开花,花期至10月中旬,具有很高的观赏价值[17-18]。根据作者对安徽省铜陵市杨山冲铜尾矿库区及周边生境的野外调查结果,剑叶金鸡菊在岭地、坡地、石缝、石窝和砂粒中均生长发育良好并形成了优势种群。人工种植的剑叶金鸡菊在杨山冲铜尾矿库复垦区生长旺盛并开花结果,且自然定居到尾矿库的未复垦区。
为了探明剑叶金鸡菊对重金属的吸收和积累特征,作者对安徽省铜陵市杨山冲铜尾矿库复垦区和未复垦区剑叶金鸡菊根际尾矿的基本理化性质和重金属元素含量及不同器官的重金属元素含量进行了比较,并对剑叶金鸡菊重金属元素的转移和富集能力进行了分析,以期了解剑叶金鸡菊对尾矿库的生态修复潜力,为利用乡土植物进行尾矿库的生态修复提供科学依据和实践参考。
1 研究区概况和研究方法
1.1 研究区概况
实验地位于安徽省铜陵市的杨山冲铜尾矿库(北纬30°46′05″~31°08′43″、东经117°42′18″~ 118°11′46″),主导风向为东北风,海拔60~100 m。该区域属亚热带湿润季风气候,光热资源丰富、降水充沛,光、热、水分配较均衡;年均温17.4 ℃,1月份均温3.2 ℃,7月份均温28.8 ℃;年均降水量1 346 mm,且主要集中在夏季;无霜期237~258 d,日均温大于等于10 ℃的年积温为4 944.4 ℃~5 463.9 ℃,年均日照时数2 050 h;年均空气相对湿度75%~81%。该尾矿库已经被弃置约25 a,属于山谷型尾矿库,总面积约20 hm2,其东北角有1个面积约2 000 m2并人工种植剑叶金鸡菊的复垦区(采用覆土复垦技术在尾矿上覆盖厚度5 cm的土层),并且,剑叶金鸡菊已经自然定居到复垦区周边的未复垦区,定居面积约1 500 m2,复垦区和未复垦区剑叶金鸡菊的盖度分别为90%和50%。尾矿库周围山坡上的植被主要为人工马尾松(PinusmassonianaLamb.)林和灌木-高草群落,尾矿库内现存的天然植物群落主要有白茅〔Imperatacylindrica(Linn.) Beauv.〕群落、中华结缕草(ZoysiasinicaHance)群落及木贼(EquisetumhyemaleLinn.)群落。尾矿库的基质主要为直径35 μm的细粉砂粒,呈赤色或褐色,主要矿物成分为钙铁榴石、石英和辉石。
1.2 方法
1.2.1样品采集及处理方法采用蛇形法[19]在尾矿库的复垦区和未复垦区分别设置5个采样点,每个采样点随机采集3株完整的剑叶金鸡菊植株,将每个样点的样株混合在一起,总质量约1.5 kg;在样株根周围采集深度20 cm的根际尾矿样品,每个样株采集2个根际尾矿样品,将同一采样点的6个根际尾矿样品混匀,总质量约2.5 kg。将样株和根际尾矿样品按照采样点分别装入无菌塑料袋中,复垦区和未复垦区的样株和根际尾矿样品各5份。
用自来水将采集的剑叶金鸡菊样株冲洗干净并分成茎叶、主根和须根3个部分;用浓度20 mmol·L-1Na2-EDTA溶液浸泡主根和须根15 min,茎叶、主根和须根用超纯水漂洗后沥干;置于105 ℃条件下杀青30 min,再于70 ℃条件下烘干至恒质量;将干燥的样品磨碎后,过孔径0.5 mm筛,置于自封袋中于室温条件下保存、备用。
将采集的根际尾矿样品置于室内通风处进行自然风干,过孔径2.0 mm筛,置于自封袋中于室温条件下保存、备用。
1.2.2根际尾矿基本理化性质及重金属元素含量测定称取20.0 g根际尾矿样品,参照Xu等[1]的方法加入50 mL蒸馏水,搅匀后静置30 min,使用Mettler Toledo FE20 pH计〔梅特勒-托利多仪器(上海)有限公司〕和雷磁DDB-303A电导率仪(上海仪电科学仪器股份有限公司)分别测定pH值和电导率;称取5.0 g根际尾矿样品,采用烧失量法[20]测定有机质含量;参照Lopes等[21]的方法,使用Vario EL Ⅲ元素分析仪(德国Elementar公司)测定总碳和总氮含量;称取0.5 g根际尾矿样品,参照Xu等[1]的方法加入8 mL体积分数65%HNO3溶液和2 mL体积分数40%HF溶液,使用Speedwave-4微波消解仪(德国Berghof公司)进行微波消解,将消解液加热浓缩至体积为5 mL,加入2 mL体积分数72%HClO4溶液,继续加热浓缩至体积为2 mL,定容至25 mL,使用IRIS Intrepid Ⅱ XSP ICP-AES(美国Thermo Fisher公司)测定总磷、总钾和各重金属元素的含量;称取2.5 g根际尾矿样品,在室温下用50 mL浓度0.5 mol·L-1NaHCO3溶液浸提30 min,采用钼锑抗比色法[20]测定速效磷含量;称取5.0 g根际尾矿样品,采用乙酸铵浸提法[22],使用50 mL浓度1.0 mol·L-1乙酸铵溶液(pH 7.0)进行提取,使用IRIS Intrepid Ⅱ XSP ICP-AES测定速效钾含量。每个样品各指标均重复测定3次,结果取平均值。
1.2.3样株中Ca和总磷及重金属元素含量测定称取0.5 g干燥的各器官样品,参照Xu等[1]的方法加入10 mL体积分数65%HNO3溶液,使用Speedwave-4微波消解仪进行微波消解,将消解液加热浓缩至体积为2 mL,定容至25 mL,使用IRIS Intrepid Ⅱ XSP ICP-AES测定Ca、总磷及各重金属元素的含量。各指标均重复测定3次,结果取平均值。
1.3 数据处理及统计分析
根据检测结果计算剑叶金鸡菊对各重金属元素的转移系数和富集系数,计算公式分别为某重金属元素的转移系数=茎叶中该重金属元素的含量/主根中该重金属元素的含量;某一器官某重金属元素的富集系数=此器官中该重金属元素的含量/根际尾矿中该重金属元素的含量。
采用SPSS 19.0统计分析软件对数据进行处理和统计分析,采用独立样本t检验法分析复垦区和未复垦区相关指标间的差异,采用Pearson相关性分析法进行双变量相关分析。
2 结果和分析
2.1 铜尾矿库剑叶金鸡菊根际尾矿的基本理化性质及重金属元素含量分析
2.1.1基本理化性质分析检测结果(表1)表明:复垦区和未复垦区根际尾矿的pH值分别为pH 7.7和pH 7.8,均偏碱性。复垦区根际尾矿的电导率以及有机质、总碳、总氮、总磷、速效磷和速效钾含量均高于未复垦区,而pH值和总钾含量均低于未复垦区;并且,复垦区和未复垦区根际尾矿的有机质和速效磷含量差异显著(P<0.05)。
2.1.2重金属元素含量分析检测结果(表2)表明:复垦区根际尾矿的重金属元素含量从高到低依次为Cu、Mn、Zn、As、Pb、Cd,而未复垦区根际尾矿的重金属元素含量从高到低则依次为Mn、Cu、Zn、As、Pb、Cd。其中,复垦区根际尾矿的Cu、Zn、Pb和Cd含量均高于未复垦区,分别为后者对应重金属元素含量的1.8、1.6、1.5和1.2倍,而As和Mn的含量则低于未复垦区;并且,复垦区和未复垦区根际尾矿的Cu、Zn和Pb含量差异显著。



采样区SamplingareapH值pHvalue电导率/μS·cm-1Electricconductivity有机质含量/g·kg-1Organicmattercontent总碳含量/g·kg-1Totalcarboncontent总氮含量/g·kg-1Totalnitrogencontent复垦区Reclamationarea7.7±0.1a285.33±6.51a8.96±2.11b10.40±3.64a2.17±0.32a未复垦区Non-reclamationarea7.8±0.1a243.67±17.90a4.80±1.04a8.28±1.32a1.95±0.03a采样区Samplingarea总磷含量/g·kg-1Totalphosphoruscontent总钾含量/g·kg-1Totalpotassiumcontent速效磷含量/mg·kg-1Availablephosphoruscontent速效钾含量/mg·kg-1Availablepotassiumcontent复垦区Reclamationarea0.32±0.04a8.45±1.44a4.25±1.84b2.97±1.42a未复垦区Non-reclamationarea0.27±0.05a9.72±0.89a1.02±0.48a1.93±0.61a
1)同列中不同的小写字母表示差异显著(P<0.05) Different lowercases in the same column indicate the significant difference (P<0.05).



采样区Samplingarea各重金属元素的含量/mg·kg-1 ContentofeachheavymetalelementCuZnPbCdMnAs复垦区Reclamationarea2812.81±440.99b422.80±34.23b44.35±14.30b2.60±0.26a1759.29±206.75a179.78±51.23a未复垦区Non-reclamationarea1536.78±204.43a257.02±17.34a29.56±3.47a2.15±0.21a1960.32±89.63a193.49±65.80a
1)同列中不同的小写字母表示差异显著(P<0.05) Different lowercases in the same column indicate the significant difference (P<0.05).
2.2 铜尾矿库剑叶金鸡菊的重金属元素含量及其转移和富集能力分析
2.2.1重金属元素含量分析检测结果(表3)表明:复垦区剑叶金鸡菊主根和须根的各重金属元素含量由高到低依次为Cu、Zn、Mn、Pb、As、Cd,而未复垦区剑叶金鸡菊主根和须根的各重金属元素含量由高到低则依次为Cu、Zn、Mn、As、Pb、Cd;复垦区和未复垦区剑叶金鸡菊茎叶的各重金属元素含量由高到低均依次为Zn、Mn、Cu、Cd、Pb、As(未检出)。其中,复垦区剑叶金鸡菊主根的Cu含量低于未复垦区,而其余重金属元素含量均高于未复垦区,且复垦区和未复垦区剑叶金鸡菊主根的Pb含量差异显著(P<0.05);复垦区剑叶金鸡菊须根的Cu、Zn和Mn含量低于未复垦区,而其余重金属元素含量均高于未复垦区,且复垦区和未复垦区剑叶金鸡菊须根的Pb含量差异显著;复垦区剑叶金鸡菊茎叶的各重金属元素含量均低于未复垦区,且复垦区和未复垦区剑叶金鸡菊茎叶的Cu、Zn和Mn含量差异显著。
由表3还可见:复垦区和未复垦区剑叶金鸡菊各器官的Cu含量均表现为在须根中最高,在主根中次之,在茎叶中最低,且主根和须根的Cu含量明显高于茎叶;复垦区和未复垦区剑叶金鸡菊各器官的Zn和Mn含量均表现为在茎叶中最高,在须根中次之,在主根中最低,且茎叶的Zn含量明显高于主根和须根,而未复垦区茎叶的Mn含量明显高于主根和须根,但复垦区各器官的Mn含量差异不明显;复垦区剑叶金鸡菊各器官的Pb含量表现为在主根中最高,在须根中次之,在茎叶中最低,而未复垦区剑叶金鸡菊各器官的Pb含量则表现为在茎叶中最高,在须根中次之,在主根中最低;复垦区和未复垦区剑叶金鸡菊各器官的Cd含量均表现为在茎叶中最高,在主根和须根中较低且相近;复垦区和未复垦区剑叶金鸡菊各器官的As含量均表现为在主根和须根中较高且相近,在茎叶中未检出。上述研究结果表明:剑叶金鸡菊的Cu和As主要分布在根(主根和须根)中,而Cd和Zn则主要分布在茎叶中。
2.2.2重金属元素转移和富集能力分析计算结果(表4)表明:复垦区剑叶金鸡菊中Zn、Cd和Mn的转移系数以及未复垦区剑叶金鸡菊中Zn、Pb、Cd和Mn的转移系数均大于1,复垦区剑叶金鸡菊中Pb的转移系数以及复垦区和未复垦区剑叶金鸡菊中Cu的转移系数均小于1,而复垦区和未复垦区剑叶金鸡菊中As的转移系数因在茎叶中未检出而无法计算,说明Zn、Pb、Cd和Mn在剑叶金鸡菊体内的转移较Cu和As容易。并且,复垦区剑叶金鸡菊中Zn、Pb、Cd和Mn的转移系数显著低于未复垦区,Cu的转移系数略低于未复垦区。
由表4还可见:复垦区和未复垦区剑叶金鸡菊主根、须根和茎叶中Cu、Zn、Pb、Mn和As的富集系数普遍较低,其中,未复垦区剑叶金鸡菊茎叶中Zn的富集系数最高,但仅为0.304;复垦区和未复垦区剑叶金鸡菊主根和须根中Cd的富集系数也较低,而茎叶中Cd的富集系数较高,其中,复垦区和未复垦区剑叶金鸡菊茎叶中Cd的富集系数分别为0.578和0.995。并且,复垦区剑叶金鸡菊主根中Cu和Zn的富集系数分别显著和略低于未复垦区,Pb的富集系数显著高于未复垦区,而Cd、Mn和As的富集系数均略高于未复垦区;复垦区剑叶金鸡菊须根中Cu和Zn的富集系数显著低于未复垦区,Cd和Mn的富集系数均略低于未复垦区,而Pb和As的富集系数则略高于未复垦区。


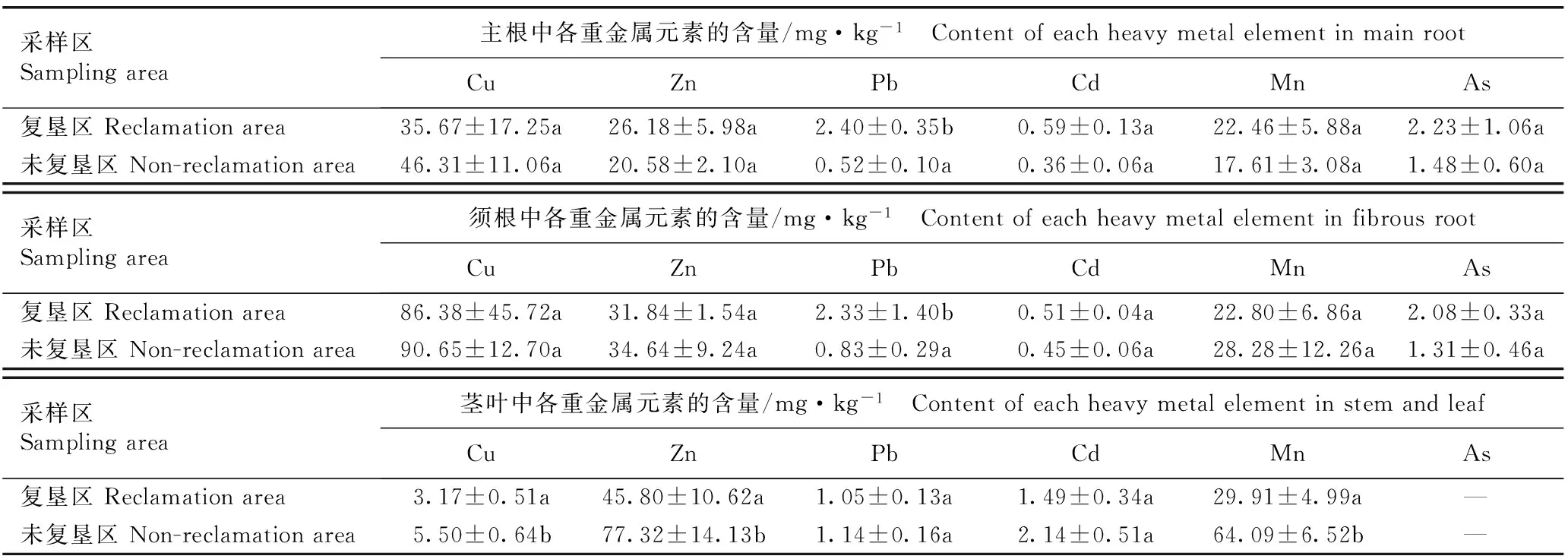
采样区Samplingarea主根中各重金属元素的含量/mg·kg-1 ContentofeachheavymetalelementinmainrootCuZnPbCdMnAs复垦区Reclamationarea35.67±17.25a26.18±5.98a2.40±0.35b0.59±0.13a22.46±5.88a2.23±1.06a未复垦区Non-reclamationarea46.31±11.06a20.58±2.10a0.52±0.10a0.36±0.06a17.61±3.08a1.48±0.60a采样区Samplingarea须根中各重金属元素的含量/mg·kg-1 ContentofeachheavymetalelementinfibrousrootCuZnPbCdMnAs复垦区Reclamationarea86.38±45.72a31.84±1.54a2.33±1.40b0.51±0.04a22.80±6.86a2.08±0.33a未复垦区Non-reclamationarea90.65±12.70a34.64±9.24a0.83±0.29a0.45±0.06a28.28±12.26a1.31±0.46a采样区Samplingarea茎叶中各重金属元素的含量/mg·kg-1 ContentofeachheavymetalelementinstemandleafCuZnPbCdMnAs复垦区Reclamationarea3.17±0.51a45.80±10.62a1.05±0.13a1.49±0.34a29.91±4.99a—未复垦区Non-reclamationarea5.50±0.64b77.32±14.13b1.14±0.16a2.14±0.51a64.09±6.52b—
1)同列中不同的小写字母表示差异显著(P<0.05) Different lowercases in the same column indicate the significant difference (P<0.05). —: 未检出Undetected.



采样区Samplingarea各重金属元素的转移系数 TransfercoefficientofeachheavymetalelementCuZnPbCdMnAs复垦区Reclamationarea0.108±0.060a1.861±0.740a0.446±0.102a2.647±0.933a1.419±0.505a—未复垦区Non-reclamationarea0.125±0.039a3.739±0.312b2.243±0.632b5.906±0.688b3.696±0.628b—采样区Samplingarea主根中各重金属元素的富集系数 EnrichmentcoefficientofeachheavymetalelementinmainrootCuZnPbCdMnAs复垦区Reclamationarea0.012±0.004a0.062±0.013a0.057±0.014b0.231±0.068a0.013±0.004a0.013±0.007a未复垦区Non-reclamationarea0.030±0.004b0.081±0.013a0.018±0.002a0.167±0.019a0.009±0.001a0.009±0.005a采样区Samplingarea须根中各重金属元素的富集系数 EnrichmentcoefficientofeachheavymetalelementinfibrousrootCuZnPbCdMnAs复垦区Reclamationarea0.030±0.014a0.075±0.003a0.050±0.016a0.199±0.032a0.013±0.006a0.012±0.004a未复垦区Non-reclamationarea0.059±0.005b0.134±0.029b0.028±0.009a0.212±0.030a0.015±0.007a0.007±0.002a采样区Samplingarea茎叶中各重金属元素的富集系数 EnrichmentcoefficientofeachheavymetalelementinstemandleafCuZnPbCdMnAs复垦区Reclamationarea0.001±0.000a0.109±0.027a0.025±0.007a0.578±0.159a0.017±0.004a—未复垦区Non-reclamationarea0.004±0.001b0.304±0.076b0.039±0.007a0.995±0.220a0.033±0.002b—
1)同列中不同的小写字母表示差异显著(P<0.05) Different lowercases in the same column indicate the significant difference (P<0.05). —: 未检出Undetected.
2.3 铜尾矿库剑叶金鸡菊的Ca和总磷含量分析
检测结果(表5)表明:复垦区剑叶金鸡菊主根的Ca和总磷含量以及须根和茎叶的总磷含量均略高于未复垦区;复垦区剑叶金鸡菊主根的Ca含量与总磷含量的比值(R)以及须根的Ca含量和R值均略低于未复垦区,而茎叶的Ca含量和R值则显著(P<0.05)低于未复垦区。
由表5还可见:复垦区和未复垦区剑叶金鸡菊茎叶的Ca含量均显著高于主根和须根,而主根的Ca含量略高于须根;复垦区和未复垦区剑叶金鸡菊主根、须根和茎叶的总磷含量差异较小,且均表现为须根的总磷含量最高、主根的总磷含量最低;复垦区和未复垦区剑叶金鸡菊茎叶的R值显著高于主根和须根,而主根的R值略高于须根。



采样区Samplingarea主根中Ca和总磷(TP)的含量及其比值ContentsofCaandtotalphosphorus(TP)andtheirratioinmainrootCa/g·kg-1TP/g·kg-1RRA3.83±0.95a0.51±0.09a7.52±0.82aNRA3.80±1.13a0.47±0.19a8.05±1.42a采样区Samplingarea须根中Ca和总磷(TP)的含量及其比值ContentsofCaandtotalphosphorus(TP)andtheirratioinfibrousrootCa/g·kg-1TP/g·kg-1RRA3.24±0.32a0.96±0.12a3.36±0.61aNRA3.51±0.36a0.62±0.24a5.66±1.59a采样区Samplingarea茎叶中Ca和总磷(TP)的含量及其比值ContentsofCaandtotalphosphorus(TP)andtheirratioinstemandleafCa/g·kg-1TP/g·kg-1RRA13.29±5.01a0.79±0.07a16.77±5.18aNRA25.65±2.50b0.59±0.17a43.57±11.61b
1)RA: 复垦区 Reclamation area; NRA: 未复垦区 Non-reclamation area.R: Ca含量与总磷含量的比值 Ratio of Ca content to total phosphorus content. 同列中不同的小写字母表示差异显著(P<0.05) Different lowercases in the same column indicate the significant difference (P<0.05).
2.4 Pearson相关性分析
2.4.1剑叶金鸡菊与根际尾矿相应重金属元素含量的相关性分析相关性分析结果(表6)表明:剑叶金鸡菊主根的Pb含量与根际尾矿的Pb含量呈显著(P<0.05)正相关,相关系数为0.708;主根的Zn和Cd含量与根际尾矿的相应重金属元素含量呈不显著正相关;主根的Cu、Mn和As含量与根际尾矿的相应重金属元素含量呈不显著负相关。剑叶金鸡菊须根的Pb含量与根际尾矿的Pb含量呈极显著(P<0.01)正相关,相关系数为0.948;须根的Cu、Cd和As含量与根际尾矿的相应重金属元素含量呈不显著正相关;须根的Zn和Mn含量与根际尾矿的相应重金属元素含量呈不显著正相关。剑叶金鸡菊茎叶的Cu含量与根际尾矿的Cu含量呈极显著负相关,相关系数为-0.940;茎叶的Zn含量与根际尾矿的Zn含量呈显著负相关,相关系数为-0.856;茎叶的Cd含量与根际尾矿的Cd含量呈不显著负相关;茎叶的Pb和Mn含量与根际尾矿的相应重金属元素含量呈不显著正相关。
表6剑叶金鸡菊不同器官重金属元素含量与根际尾矿相应重金属元素含量的Pearson相关性分析
Table6PearsoncorrelationanalysisoncontentofheavymetalelementsindifferentorgansofCoreopsislanceolataLinn.withcontentofcorrespondingheavymetalelementsinrhizospheretailings
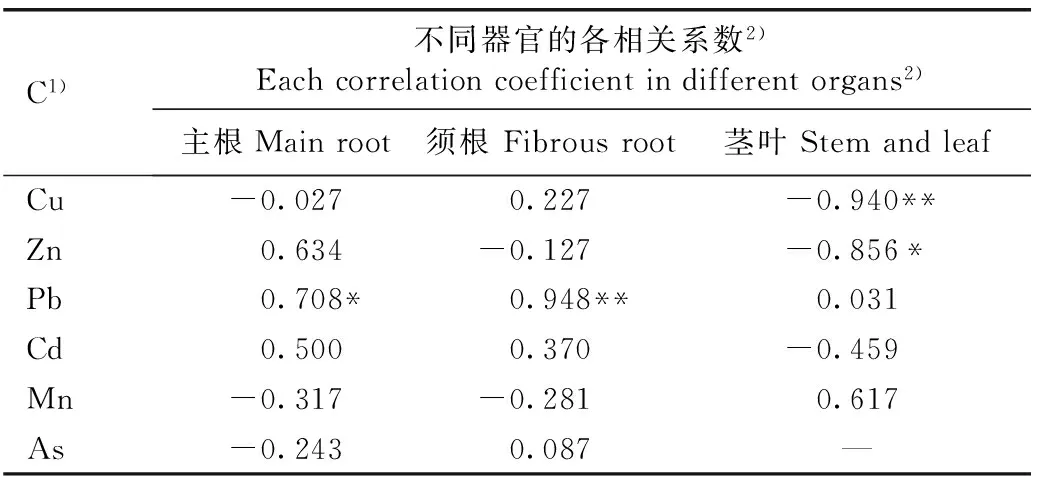
C1)不同器官的各相关系数2)Eachcorrelationcoefficientindifferentorgans2)主根Mainroot须根Fibrousroot茎叶StemandleafCu-0.0270.227-0.940**Zn0.634-0.127-0.856*Pb0.708*0.948**0.031Cd0.5000.370-0.459Mn-0.317-0.2810.617As-0.2430.087—
1)C: 根际尾矿的重金属元素含量 Content of heavy metal elements in rhizosphere tailings.
2)*:P<0.05; ** :P<0.01. —: 未检出 Undetected.
2.4.2剑叶金鸡菊重金属元素含量与Ca和总磷含量及其比值(R)的相关性分析相关性分析结果(表7)表明:剑叶金鸡菊主根的Mn含量与Ca和总磷含量以及Cu含量与R值均呈显著正相关,相关系数分别为0.726、0.734和0.868;主根的Zn、Pb、Cd和As含量与Ca和总磷含量以及主根的Cu含量与Ca含量均呈不显著正相关;而主根的Cu含量与总磷含量以及Zn、Pb、Cd、Mn和As含量与R值均呈不显著负相关。剑叶金鸡菊须根的Cd含量与Ca含量呈极显著负相关,相关系数为-0.972;须根的As含量与Ca含量以及须根的Mn含量与总磷含量均呈显著负相关,相关系数分别为-0.765和-0.827;须根其余重金属元素含量与Ca和总磷含量以及各重金属元素含量与R值的相关性均不显著。剑叶金鸡菊茎叶的Mn含量与Ca含量呈极显著正相关,相关系数为0.945;茎叶的Cu、Zn和Cd含量与Ca含量,以及Cu和Mn含量与R值均呈显著正相关,相关系数分别为0.865、0.871、0.744、0.822和0.820;茎叶的各重金属元素含量与总磷含量的相关性均不显著。
表7剑叶金鸡菊不同器官重金属元素含量与相应器官Ca和总磷含量及其比值的Pearson相关性分析
Table7PearsoncorrelationanalysisoncontentofheavymetalelementsindifferentorgansofCoreopsislanceolataLinn.withcontentsofCaandtotalphosphorusandtheirratioincorrespondingorgans
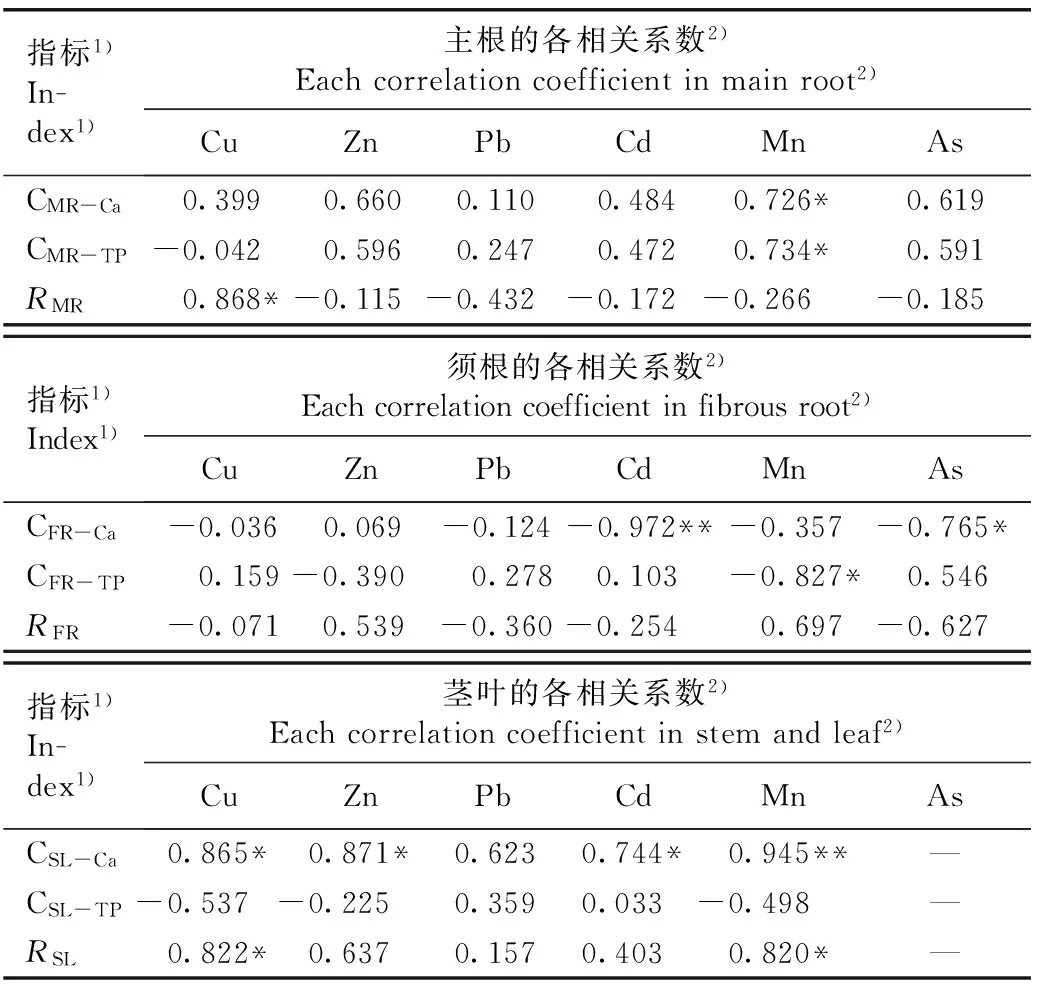
指标1)In-dex1)主根的各相关系数2)Eachcorrelationcoefficientinmainroot2)CuZnPbCdMnAsCMR-Ca0.3990.6600.1100.4840.726*0.619CMR-TP-0.0420.5960.2470.4720.734*0.591RMR0.868*-0.115-0.432-0.172-0.266-0.185指标1)Index1)须根的各相关系数2)Eachcorrelationcoefficientinfibrousroot2)CuZnPbCdMnAsCFR-Ca-0.0360.069-0.124-0.972**-0.357-0.765*CFR-TP0.159-0.3900.2780.103-0.827*0.546RFR-0.0710.539-0.360-0.2540.697-0.627指标1)In-dex1)茎叶的各相关系数2)Eachcorrelationcoefficientinstemandleaf2)CuZnPbCdMnAsCSL-Ca0.865*0.871*0.6230.744*0.945**—CSL-TP-0.537-0.2250.3590.033-0.498—RSL0.822*0.6370.1570.4030.820*—
1)CMR-Ca: 主根的Ca含量 Ca content in main root; CMR-TP: 主根的总磷含量 Total phosphorus content in main root;RMR: 主根的Ca含量与总磷含量的比值 Ratio of Ca content to total phosphorus content in main root; CFR-Ca: 须根的Ca含量 Ca content in fibrous root; CFR-TP: 须根的总磷含量 Total phosphorus content in fibrous root;RFR: 须根的Ca含量与总磷含量的比值 Ratio of Ca content to total phosphorus content in fibrous root; CSL-Ca: 茎叶的Ca含量 Ca content in stem and leaf; CSL-TP: 茎叶的总磷含量 Total phosphorus content in stem and leaf;RSL: 茎叶的Ca含量与总磷含量的比值 Ratio of Ca content to total phosphorus content in stem and leaf.
2)*:P<0.05; ** :P<0.01. —: 未检出 Undetected.
3 讨论和结论
3.1 复垦区和未复垦区尾矿重金属元素含量特征
与GB 15618—1995中规定的国家土壤二级标准(Cu、Zn、Pb、As和Cd的含量分别为100、250、300、40和0.6 mg·kg-1)相比,复垦区和未复垦区剑叶金鸡菊根际尾矿的Cu、Zn、As和Cd含量均超出标准范围,说明该铜尾矿库复垦区和未复垦区的尾矿均属于复合重金属污染。
通常情况下,在对尾矿库进行植物修复前均需要对尾矿库进行覆土复垦,关于覆土复垦后尾矿中各重金属元素的含量、分布和迁移及定居植物的重金属元素含量变化已经成为研究热点[4,23-26]。安徽省铜陵市杨山冲铜尾矿库复垦区剑叶金鸡菊根际尾矿的Cu、Zn、Pb和Cd含量均高于未复垦区,这可能是因为未复垦区的根际尾矿处于裸露状态,由于雨水侵蚀、地表径流和渗流作用等导致其中的重金属流失,也可能是因为复垦区的根际尾矿位于覆土层下面,土壤中的多孔颗粒通过吸附作用将向根系迁移的重金属保留在覆土层。
3.2 剑叶金鸡菊对重金属元素的吸收和积累特征
虽然安徽省铜陵市杨山冲铜尾矿库复垦区和未复垦区剑叶金鸡菊根际尾矿的Cu和As含量均超出一般植物的忍受范围(Cu为2~250 mg·kg-1,As为0.1~40.0 mg·kg-1)[10],根际尾矿的Cd含量也接近对植物造成毒害作用的临界值(3~8 mg·kg-1)[27],但尾矿库中生长的剑叶金鸡菊未受到明显影响,表明剑叶金鸡菊具有较强的复合重金属耐性[28]。通常情况下,植物体内Cu、Zn、Pb、Cd、Mn和As含量的正常范围分别为5~25、20~400、0.1~5.0、0.2~0.8、1~700和0.01~5.00 mg·kg-1[9-10]。检测结果表明:复垦区和未复垦区剑叶金鸡菊主根、须根和茎叶的Zn、Pb、Mn和As含量均在正常范围内,但主根和须根的Cu含量以及茎叶的Cd含量却超出正常范围,说明剑叶金鸡菊对上述重金属元素均有一定的吸收和积累能力,并且,其根对Cu的积累能力以及茎叶对Cd的积累能力均很强。
孙庆业等[29]认为,植物对重金属元素的吸收和积累不但与植物对重金属的耐性机制有关,还与重金属元素本身的活动有关。本研究中,不同重金属元素在复垦区和未复垦区剑叶金鸡菊各器官的吸收和积累特征明显不同,其中,Cu主要积累在主根和须根中,且Cu的转移系数很低(0.108~0.125);As也主要积累在主根和须根中,在茎叶中未检出,说明Cu和As在剑叶金鸡菊体内的转移受到明显抑制。相关研究结果表明:根中重金属元素含量过高和转移系数很低说明在重金属污染条件下植物对重金属元素的吸收和转移具有较高的协调性[30-31],植物对重金属污染的抗性可通过逃避机制获得(如将重金属固定在根中[32]);Wei等[33]认为,植物地上部对某些重金属元素具有一定的排斥作用,采取限制重金属元素从根部向地上部转移的忍耐策略来抵御重金属胁迫,据此推测,剑叶金鸡菊很可能采取这种策略来应对Cu和As胁迫,具体机制有待深入研究。
复垦区和未复垦区剑叶金鸡菊中Zn、Pb、Mn和Cd的转移系数均较高,基本上大于1,仅复垦区剑叶金鸡菊Pb的转移系数较小,说明剑叶金鸡菊将Zn、Pb、Mn和Cd从根部向茎叶转移的能力较强。除了采取限制重金属元素从根部向地上部转移的策略,植物还可以采取使重金属元素尽快离开植物体的方法(即将重金属元素积累到植株容易脱落的器官或组织中[34-35])来减轻重金属胁迫对植物的伤害。由于剑叶金鸡菊为多年生宿根草本植物,每年深秋植株的地上部枯死,因此,剑叶金鸡菊很可能采取这种方式来应对Zn、Pb、Mn和Cd胁迫,具体机制有待进一步深入研究。
当从植物提取角度考虑物种修复潜力时,重金属元素的富集系数通常是重要因子之一[36]。本研究中,仅未复垦区剑叶金鸡菊茎叶Cd的富集系数接近1,而复垦区和未复垦区剑叶金鸡菊主根、须根和茎叶中Cu、Zn、Pb、Mn和As的富集系数均小于1,说明剑叶金鸡菊可能对Cd胁迫具有较强的植物提取修复潜力,而对Cu、Zn、Pb、Mn和As胁迫的植物提取修复潜力却较弱。
3.3 剑叶金鸡菊体内重金属元素吸收和转移的影响因子分析
相关研究结果表明:植物体内的重金属元素含量与其生长基质的重金属元素含量关系密切,并受环境条件、植物自身特性、根际小环境和植物种类等因子的影响[37-39]。相关性分析结果表明:剑叶金鸡菊主根的Pb、Zn和Cd含量以及须根的Pb含量与根际尾矿的相应重金属元素含量均呈正相关,且相关系数均在0.5以上;而茎叶的Cu和Zn含量与根际尾矿的相应重金属元素含量分别呈极显著(P<0.01)和显著(P<0.05)负相关。另外,铜尾矿库复垦区剑叶金鸡菊根际尾矿的有机质和速效磷含量均显著高于未复垦区,而复垦区剑叶金鸡菊茎叶中Cu、Zn、Pb、Cd和Mn 5种重金属元素含量均低于未复垦区,由于高含量的有机质可能会降低重金属元素的生物有效性[40],据此推测复垦区根际尾矿有机质和速效磷的高含量很可能是限制重金属元素从剑叶金鸡菊根部向地上部转移的重要因子。
Turnau等[41]的研究结果表明:与对照相比,生长在铅锌工业废弃物上的耐旱植物叶片的Ca含量较高;Probst等[42]的研究结果也表明:与正常土壤中蚕豆(ViciafabaLinn.)相比,铅锌尾矿中蚕豆叶片的Ca含量较高。本研究中,复垦区剑叶金鸡菊茎叶的Ca和各重金属元素含量均低于未复垦区,且茎叶的Cu、Zn、Cd和Mn含量与茎叶的Ca含量均呈显著或极显著正相关,说明剑叶金鸡菊茎叶的Ca含量对Cu、Zn、Cd和Mn的积累具有明显影响,即Ca含量越高,这些重金属元素在剑叶金鸡菊茎叶中的积累越多。此外,复垦区剑叶金鸡菊茎叶中Ca含量与总磷含量的比值显著低于未复垦区,而复垦区剑叶金鸡菊中Zn、Pb、Cd和Mn的转移系数均显著低于未复垦区,但剑叶金鸡菊对各重金属元素的转移能力是否与其体内Ca含量与总磷含量的比值有直接关系还需进一步深入研究。
综上所述,剑叶金鸡菊是一种多重金属耐性植物,能够改善其根际尾矿的理化性质,对重金属元素具有固定作用;覆土复垦可显著降低剑叶金鸡菊体内重金属元素从根部向茎叶转移的能力,因此,建议将剑叶金鸡菊作为Cu和As污染地植物固定修复的物种,而能否将其作为Cd污染地植物提取修复的物种则仍需要进一步的深入研究。
参考文献:
[1]XU D C, ZHOU P, ZHAN J, et al. Assessment of trace metal bioavailability in garden soils and health risks via consumption of vegetables in the vicinity of Tongling mining area, China[J]. Ecotoxicology and Environmental Safety, 2013, 90(2): 103-111.
[2]魏伟, 王丽, 周平, 等. 安徽铜陵地区河流生态系统健康的多指标评价[J]. 中国环境科学, 2013, 33(4): 691-699.
[3]王少华, 杨吉力, 刘苏明, 等. 铜陵狮子山杨山冲尾矿库重金属元素释放的环境效应[J]. 高校地质学报, 2011, 17(1): 93-100.
[4]NEJAD Z D, KIM J W, JUNG M C. Reclamation of arsenic contaminated soils around mining site using solidification/stabilization combined with revegetation[J]. Geosciences Journal, 2017, 21(3): 385-396.
[5]AKHTAR M S, CHALI B, AZAM T. Bioremediation of arsenic and lead by plants and microbes from contaminated soil[J]. Research in Plant Sciences, 2013, 1(3): 68-73.
[6]韦朝阳, 陈同斌. 重金属超富集植物及植物修复技术研究进展[J]. 生态学报, 2001, 21(7): 1196-1203.
[7]BABAEIAN E, HOMAEE M, RAHNEMAIE R. Chelate-enhanced phytoextraction and phytostabilization of lead-contaminated soils by carrot (Daucuscarota)[J]. Archives of Agronomy and Soil Science, 2016, 62(3): 339-358.
[8]康薇, 鲍建国, 郑进, 等. 湖北铜绿山古铜矿遗址区木本植物对重金属富集能力的分析[J]. 植物资源与环境学报, 2014, 23(1): 78-84.
[9]刘月莉, 伍钧, 唐亚, 等. 四川甘洛铅锌矿区优势植物的重金属含量[J]. 生态学报, 2009, 29(4): 2020-2026.
[10]HAQUE N, PERALTA-VIDEAB J R, JONES G L, et al. Screening the phytoremediation potential of desert broom (BaccharissarothroidesGray) growing on mine tailings in Arizona, USA[J]. Environmental Pollution, 2008, 153(2): 362-368.
[12]LI M S, LUO Y P, SU Z Y. Heavy metal concentrations in soils and plant accumulation in a restored manganese mineland in Guangxi, South China[J]. Environmental Pollution, 2007, 147(1): 168-175.

[14]SARASWAT S, RAI J P N. Phytoextraction potential of six plant species grown in multimetal contaminated soil[J]. Chemistry and Ecology, 2009, 25(1): 1-11.
[15]NEDUNURI K V, LOWELL C, MEADE W, et al. Management practices and phytoremediation by native grasses[J]. International Journal of Phytoremediation, 2010, 12(2): 200-214.
[16]郭运雪, 蒋文伟, 戴锋, 等. 3种金鸡菊的光合特性比较[J]. 浙江农林大学学报, 2012, 29(5): 755-761.
[17]李治慧. 4种宿根花卉的耐旱性及园林应用研究[D]. 福州: 福建农林大学园艺学院, 2015: 1.
[18]曾建军, 肖宜安, 孙敏. 入侵植物剑叶金鸡菊的繁殖特征及其与入侵性之间的关系[J]. 植物生态学报, 2010, 34(8): 966-972.
[19]黄张婷, 姜培坤, 宋照亮, 等. 不同竹龄雷竹中硅及其他营养元素吸收和积累特征[J]. 应用生态学报, 2013, 24(5): 1347-1353.
[20]ZHAN J, SUN Q Y. Diversity of free-living nitrogen-fixing microorganisms in the rhizosphere and non-rhizosphere of pioneer plants growing on wastelands of copper mine tailings[J]. Microbiological Research, 2012, 167(3): 157-165.
[21]LOPES C, HERVA M, FRANCO-URA A, et al. Multicorrelation models and uptake factors to estimate extractable metal concentrations from soil and metal in plants in pasturelands fertilized with manure[J]. Environmental Pollution, 2012, 166(11): 17-22.
[22]鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000: 257-282.
[23]MAITI S K, RANA V. Assessment of heavy metals contamination in reclaimed mine soil and their accumulation and distribution inEucalyptushybrid[J]. Bulletin of Environmental Contamination and Toxicology, 2017, 98(1): 97-104.
[25]邓红卫, 贺威, 周科平. 复垦尾矿库重金属分布及生态风险评价[J]. 中国有色金属学报, 2015, 25(10): 2929-2935.
[26]毛香菊, 邹安华, 马亚梦, 等. 南京某铁尾矿库复垦土壤重金属污染评价[J]. 矿产保护与利用, 2015(1): 54-58.
[27]OUTRIDGE P M, NOLLER B N. Accumulation of toxic trace elements by freshwater vascular plants[M]∥WARE G W. Reviews of Environmental Contamination and Toxicology: Vol. 121. New York: Springer-Verlag Inc., 1991: 1-63.
[28]PICHTEL J, KUROIWA K, SAWYERR H T. Distribution of Pb, Cd and Ba in soils and plants of two contaminated sites[J]. Environmental Pollution, 2000, 110(1): 171-178.
[29]孙庆业, 蓝崇钰, 黄铭洪, 等. 铅锌尾矿上自然定居植物[J]. 生态学报, 2001, 21(9): 1457-1462.
[30]NKOANE B B M, SAWULA G M, WIBETOE G, et al. Identification of Cu and Ni indicator plants from mineralised locations in Botswana[J]. Journal of Geochemical Exploration, 2005, 86(3): 130-142.
[31]DENG H, YE Z H, WONG M H. Accumulation of lead, zinc, copper and cadmium by 12 wetland plant species thriving in metal-contaminated sites in China[J]. Environmental Pollution, 2004, 132(1): 29-40.
[32]GARBISU C, ALKORTA I. Phytoextraction: a cost-effective plant-based technology for the removal of metals from the environment[J]. Bioresource Technology, 2001, 77(3): 229-236.
[33]WEI S H, ZHOU Q X, WANG X. Identification of weed plants excluding the uptake of heavy metals[J]. Environment International, 2005, 31(6): 829-834.
[34]BAKER A J M, PROCTOR J. The influence of cadmium, copper, lead, and zinc on the distribution and evolution of metallophytes in British Isles[J]. Plant Systematics and Evolution, 1990, 173(1): 91-108.
[35]MCGRATH S P, ZHAO F J, LOMBI E. Plant and rhizosphere processes involved in phytoremediation of metal-contaminated soils[J]. Plant and Soil, 2001, 232(1/2): 207-214.
[36]ZHAO F J, LOMBI E, MCGRATH S P. Assessing the potential for zinc and cadmium phytoremediation with the hyperaccumulator Thlaspi caerulescens[J]. Plant and Soil, 2003, 249(1): 37-43.
[37]CHEN W P, LI L Q, CHANG A C, et al. Characterizing the solid-solution partitioning coefficient and plant uptake factor of As, Cd, and Pb in California croplands[J]. Agriculture Ecosystems and Environment, 2009, 129(1/3): 212-220.
[38]HU P J, HUANG J X, OUYANG Y N, et al. Water management affects arsenic and cadmium accumulation in different rice cultivars[J]. Environmental Geochemistry and Health, 2013, 35(6): 767-778.
[39]WANG C, JI J F, YANG Z F, et al. Effects of soil properties on the transfer of cadmium from soil to wheat in the Yangtze River Delta Region, China—a typical industry-agriculture transition area[J]. Biological Trace Element Research, 2012, 148(2): 264-274.
[40]LIU L N, CHEN H S, CAI P, et al. Immobilization and phytotoxicity of Cd in contaminated soil amended with chicken manure compost[J]. Journal of Hazardous Materials, 2009, 163(2/3): 563-567.
[41]TURNAU K, OSTACHOWICZ B, WOJTCZAK G, et al. Metal uptake by xerothermic plants introduced into Zn-Pb industrial wastes[J]. Plant Soil, 2010, 337(1/2): 299-311.
[42]PROBST A, LIU H Y, FANJUL M, et al. Response ofViciafabaL. to metal toxicity on mine tailing substrate: geochemical and morphological changes in leaf and root[J]. Environmental and Experimental Botany, 2009, 66(2): 297-308.
