金钗石斛内生细菌的组成及多样性分析
2018-04-08吴庆珊雷友梅翁庆北
吴庆珊, 雷 珣, 雷友梅, 蒲 星, 刘 颖, 翁庆北
(贵州师范大学生命科学学院, 贵州 贵阳 550001)
金钗石斛(DendrobiumnobileLindl.)隶属兰科(Orchidaceae)石斛属(DendrobiumSw.),为多年生草本植物[1],多附生在阴凉通风的悬崖石壁上或树上,主要分布在中国西南、华南和台湾等地。金钗石斛在贵州省有50余年的栽培历史,贵州省赤水市的金钗石斛在2006年由国家质量监督检验检疫总局批准实施国家地理标志产品保护。金钗石斛为中国传统名贵中药材和保健品原料,主要化学成分包括生物碱、多糖、倍半萜类、菲类、联苄类等,具有抗肿瘤、抗衰老、改善记忆、提高免疫力、提高胃肠道功能及抗白内障等功效[2],经济价值很高。然而,金钗石斛种子自然萌发困难,随着人们对金钗石斛的不断开发利用,导致其野生资源日渐枯竭,因此,应建立完善的金钗石斛人工组培繁殖和保育体系,以加快金钗石斛的规范化和规模化种植。
植物内生细菌栖居于健康的植物组织和器官的细胞间隙或细胞内,不会对寄主植物造成实质性危害,并可与寄主植物建立和谐共生关系[3]。相关研究结果表明:兰科植物具有依赖菌根成活和生长的特性[4-5],其内生细菌的数量和种类因生境而异,并与兰科植物的种类、根龄、生长季节及菌根真菌的定植程度等密切相关[6-8]。迄今为止,研究者们已经从90多种兰科植物中分离出大量的内生细菌,并以根部内生细菌为主[9],其中,已经分离出内生细菌的石斛属植物有美花石斛(D.loddigesiiRolfe)[10]、细茎石斛〔D.moniliforme(Linn.) Sw.〕[11]、铁皮石斛(D.officinaleKimura et Migo)[12]和杓唇石斛〔D.moschatum(Buch.-Ham.) Sw.〕[13]等。
在兰科植物的整个微生态系统中,植物与其内生微生物相互作用,并且,内生细菌间、内生细菌与植物菌根真菌间的相互作用可直接或间接促进植物生长发育。植物内生细菌不仅可以通过生物固氮和分泌IAA等植物激素直接促进植物生长[5-8],还可以通过诱导植物体产生植物激素、增强植物体抗逆性及防御病原体入侵等途径间接促进植物生长发育[14-15],因此,内生细菌对植物的生长和繁殖具有重要作用。相关研究结果表明:接种内生细菌可提高兰科植物种子的萌发率[5-7]和组培苗炼苗移栽的成活率[13,16],促进组培苗生长,并提高组培苗的生物产量及多糖等活性成分的含量。不同生长阶段的兰科植物对促生微生物的种类需求不同[9],并且,内生细菌与菌根真菌混合接种的促生效果明显优于单独接种菌根真菌[17]。综上所述,兰科植物内生细菌对维持兰科植物的物种多样性及其规模化园艺栽培和药用生产等具有重要意义。
传统分离培养是微生物研究的重要基础,对丰富兰科植物内生细菌资源,研究内生细菌的生物学特性及其与植物种子萌发和幼苗生长等的相互作用具有不可替代的作用。为此,作者从贵州省3个地区人工种植的金钗石斛根、茎和叶等器官中分离出内生细菌,并采用扩增核糖体DNA限制性分析(amplified ribosomal DNA restriction analysis,ARDRA)法对分离的内生细菌进行多样性分析,以期丰富兰科植物内生细菌的种质资源,为进一步利用内生细菌共生技术开展药用植物栽培和活性天然产物分离等研究提供基础数据和参考依据。
1 研究地概况和研究方法
1.1 研究地概况
供试金钗石斛分别来自贵州省赤水市旺隆镇(P1)、贵州省贵阳市贵州师范大学生命科学学院大棚(P2)和贵州省金沙县台金生态农业观光园大棚(P3)3个样地,均于2015年9月采集。其中,P1样地位于北纬28°32′01″、东经105°51′52″,海拔377 m,属中亚热带湿润季风气候,年均温18.1 ℃,年均空气相对湿度82%,供试植株以压石法仿野生种植[18],栽培基质以苔藓、腐熟牛肥和锯木屑为主;P2样地位于北纬26°35′31″、东经106°43′10″,海拔1 096 m,供试植株种植在大棚内,棚内温度25 ℃~30 ℃,年均空气相对湿度75%~85%,栽培基质以营养土和锯木屑为主,基质含水量为50%~60%;P3样地位于北纬27°29′53″、东经106°10′09″,海拔948 m,供试植株种植在大棚内,棚内温度25 ℃~30 ℃,年均空气相对湿度70%~80%,栽培基质以泥炭和珍珠岩为主,基质含水量为40%~60%。
1.2 研究方法
1.2.1样株的采集方法采用五点取样法在样地内选择正常生长且无病虫害的2年生金钗石斛植株,每个采样点采集1株样株,同一样地的5株样株放入1个无菌袋中,置于冰盒中带回实验室,尽快用于内生细菌分离。经鉴定,样株种植于贵州师范大学生命科学学院微生物实验室进行活体保存。
1.2.2内生细菌的分离和纯化用蒸馏水冲洗样株表面,用滤纸吸干表面水分,每个样地分别称取根、茎和叶各2.0 g;先用体积分数75%乙醇进行消毒,根、茎和叶的消毒时间分别为3 min、2 min和30 s;接着用质量体积分数0.1% HgCl2溶液进行消毒,根、茎和叶的消毒时间分别为1 min、1 min和40 s;再用质量体积分数4% NaClO溶液进行消毒,根、茎和叶的消毒时间均为3 min;最后用无菌水漂洗3次。用无菌滤纸吸干根、茎和叶的表面水分,置于盛有18 mL无菌水的无菌研钵中研磨至匀浆,采用10倍梯度稀释法用无菌水稀释匀浆液,量取稀释10、100和1 000倍的匀浆液各100 μL,分别均匀涂布在LB、NA、TB、YT、YPD、TSA、YG、R2A和KB培养基平板上,置于37 ℃条件下倒置培养1~2 d,以菌落形成单位(colony forming unit,CFU)为准统计菌落总数。每个样地金钗石斛根、茎和叶不同稀释倍数的匀浆液均设置3个平行实验。挑取单菌落进行纯化培养,使用相应的斜面培养基置于4 ℃条件下保存,或使用体积分数30%甘油置于-80 ℃条件下保存。
1.2.3细菌基因组DNA的提取使用相应的培养基将各菌株进行活化,并接种至5 mL相应的液体培养基中,于37 ℃条件下160 r·min-1振荡培养过夜;菌液在12 000 r·min-1条件下离心2 min,收集沉淀,参照董乙乂等[19]的方法提取细菌基因组DNA。
1.2.4ARDRA分析使用通用引物27F(引物序列为5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(引物序列为5′-CTACGGCTACCTTGTTACGA-3′)扩增细菌基因组DNA中16SrDNA的近全长片段;使用限制性内切酶HhaⅠ和HaeⅢ对扩增产物进行酶切分析,根据ARDRA的酶切产物带型划分不同的操作分类单元(operational taxonomic units,OTUs)。
选取每个OTU的代表性菌株,将扩增出的16SrDNA片段送生工生物工程(上海)股份有限公司进行测序;使用BLASTn程序(http:∥www.ncbi.nlm.nih.gov/blast/Blast.cgi)将测序获得的序列与GenBank数据库中已知的序列进行在线比对;下载与分离菌株16SrDNA序列最相似的菌株序列,使用Clustal W软件进行多重比对;使用MEGA 7.0软件,采用邻接法(neighbor-joining)构建系统发育树,重复抽样检测1 000次;将每个OTU代表性菌株的16SrDNA序列提交至GenBank数据库,获得GenBank登录号。
1.3 数据分析
使用Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(E)和Margalef丰富度指数(R)分析金钗石斛内生细菌的多样性,使用Sørenson相似性系数比较金钗石斛不同部位内生细菌组成的相似程度[20]。采用SPSS 20.0统计分析软件对相关数据进行处理,采用LSD法进行差异显著性分析。
2 结果和分析
2.1 金钗石斛内生细菌的总体组成分析
统计结果表明:在贵州省的赤水市旺隆镇、贵阳市贵州师范大学生命科学学院大棚和金沙县台金生态农业观光园3个样地金钗石斛的根、茎和叶中共分离出1 081株内生细菌菌株;根据ARDRA分析结果,这些菌株可分成41个OTUs。每个OTU代表菌株与GenBank数据库中近缘菌株16SrDNA序列的相似度及各OTU的分离菌株情况见表1;基于16SrDNA序列构建的各OTU代表菌株与GenBank数据库中近缘菌株的系统发育树见图1。
表1金钗石斛内生细菌41个OTUs代表菌株与GenBank数据库中近缘菌株16SrDNA序列的相似度及各OTU的分离菌株情况分析
Table1Similarityof16SrDNAsequencesbetweenrepresentativestrainsof41OTUsofendophyticbacteriainDendrobiumnobileLindl.andrelativestrainsinGenBankdatabase,andanalysisonstatusofisolatedstrainsofeachOTU
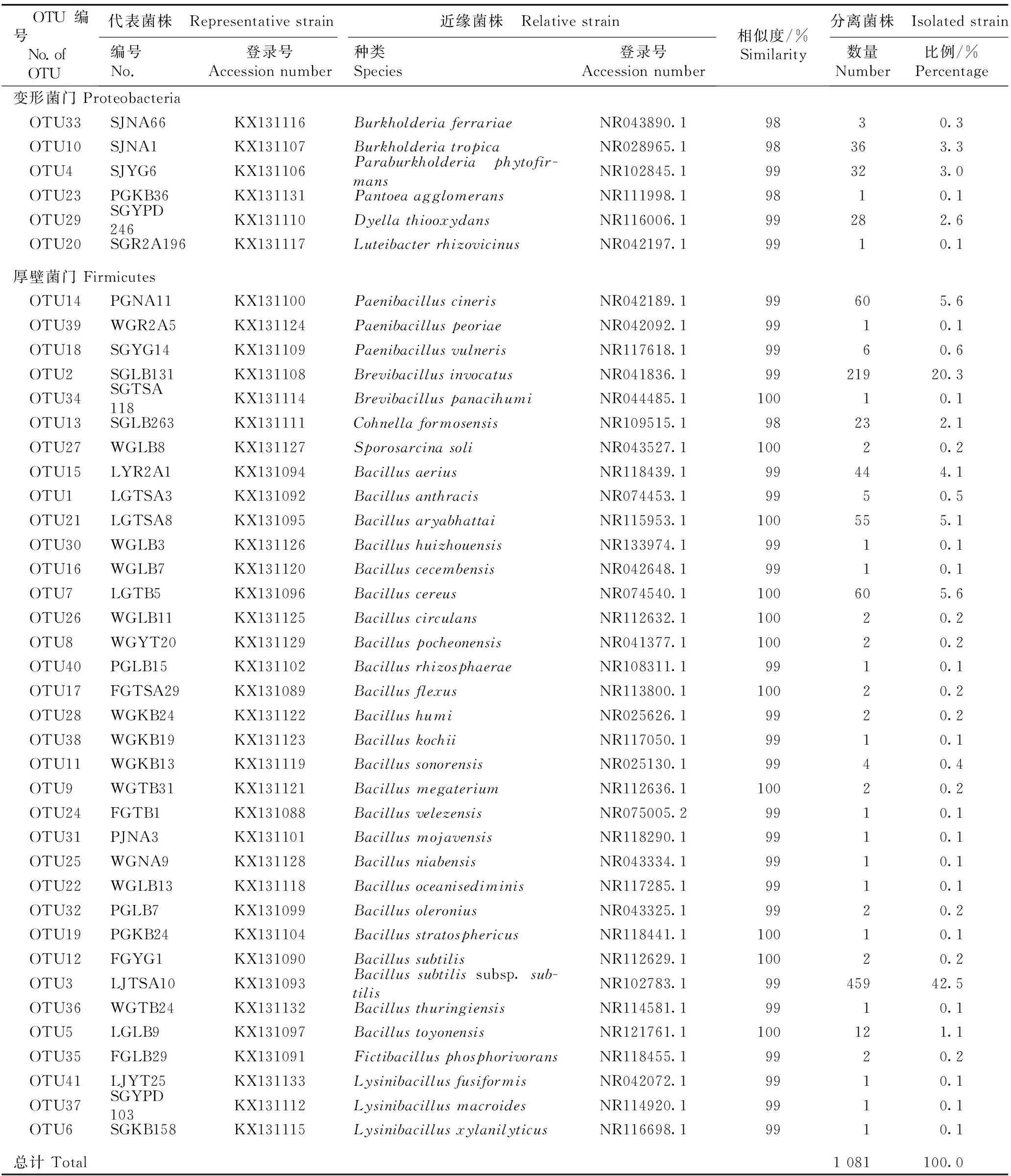
OTU编号 No.of OTU代表菌株 Representativestrain近缘菌株 Relativestrain编号No.登录号Accessionnumber种类Species登录号Accessionnumber相似度/%Similarity分离菌株 Isolatedstrain数量Number比例/%Percentage变形菌门Proteobacteria OTU33SJNA66KX131116BurkholderiaferrariaeNR043890.19830.3 OTU10SJNA1KX131107BurkholderiatropicaNR028965.198363.3 OTU4SJYG6KX131106Paraburkholderiaphytofir-mansNR102845.199323.0 OTU23PGKB36KX131131PantoeaagglomeransNR111998.19810.1 OTU29SGYPD246KX131110DyellathiooxydansNR116006.199282.6 OTU20SGR2A196KX131117LuteibacterrhizovicinusNR042197.19910.1厚壁菌门Firmicutes OTU14PGNA11KX131100PaenibacilluscinerisNR042189.199605.6 OTU39WGR2A5KX131124PaenibacilluspeoriaeNR042092.19910.1 OTU18SGYG14KX131109PaenibacillusvulnerisNR117618.19960.6 OTU2SGLB131KX131108BrevibacillusinvocatusNR041836.19921920.3 OTU34SGTSA118KX131114BrevibacilluspanacihumiNR044485.110010.1 OTU13SGLB263KX131111CohnellaformosensisNR109515.198232.1 OTU27WGLB8KX131127SporosarcinasoliNR043527.110020.2 OTU15LYR2A1KX131094BacillusaeriusNR118439.199444.1 OTU1LGTSA3KX131092BacillusanthracisNR074453.19950.5 OTU21LGTSA8KX131095BacillusaryabhattaiNR115953.1100555.1 OTU30WGLB3KX131126BacillushuizhouensisNR133974.19910.1 OTU16WGLB7KX131120BacilluscecembensisNR042648.19910.1 OTU7LGTB5KX131096BacilluscereusNR074540.1100605.6 OTU26WGLB11KX131125BacilluscirculansNR112632.110020.2 OTU8WGYT20KX131129BacilluspocheonensisNR041377.110020.2 OTU40PGLB15KX131102BacillusrhizosphaeraeNR108311.19910.1 OTU17FGTSA29KX131089BacillusflexusNR113800.110020.2 OTU28WGKB24KX131122BacillushumiNR025626.19920.2 OTU38WGKB19KX131123BacilluskochiiNR117050.19910.1 OTU11WGKB13KX131119BacillussonorensisNR025130.19940.4 OTU9WGTB31KX131121BacillusmegateriumNR112636.110020.2 OTU24FGTB1KX131088BacillusvelezensisNR075005.29910.1 OTU31PJNA3KX131101BacillusmojavensisNR118290.19910.1 OTU25WGNA9KX131128BacillusniabensisNR043334.19910.1 OTU22WGLB13KX131118BacillusoceanisediminisNR117285.19910.1 OTU32PGLB7KX131099BacillusoleroniusNR043325.19920.2 OTU19PGKB24KX131104BacillusstratosphericusNR118441.110010.1 OTU12FGYG1KX131090BacillussubtilisNR112629.110020.2 OTU3LJTSA10KX131093Bacillussubtilissubsp.sub-tilisNR102783.19945942.5 OTU36WGTB24KX131132BacillusthuringiensisNR114581.19910.1 OTU5LGLB9KX131097BacillustoyonensisNR121761.1100121.1 OTU35FGLB29KX131091FictibacillusphosphorivoransNR118455.19920.2 OTU41LJYT25KX131133LysinibacillusfusiformisNR042072.19910.1 OTU37SGYPD103KX131112LysinibacillusmacroidesNR114920.19910.1 OTU6SGKB158KX131115LysinibacillusxylanilyticusNR116698.19910.1总计Total1081100.0
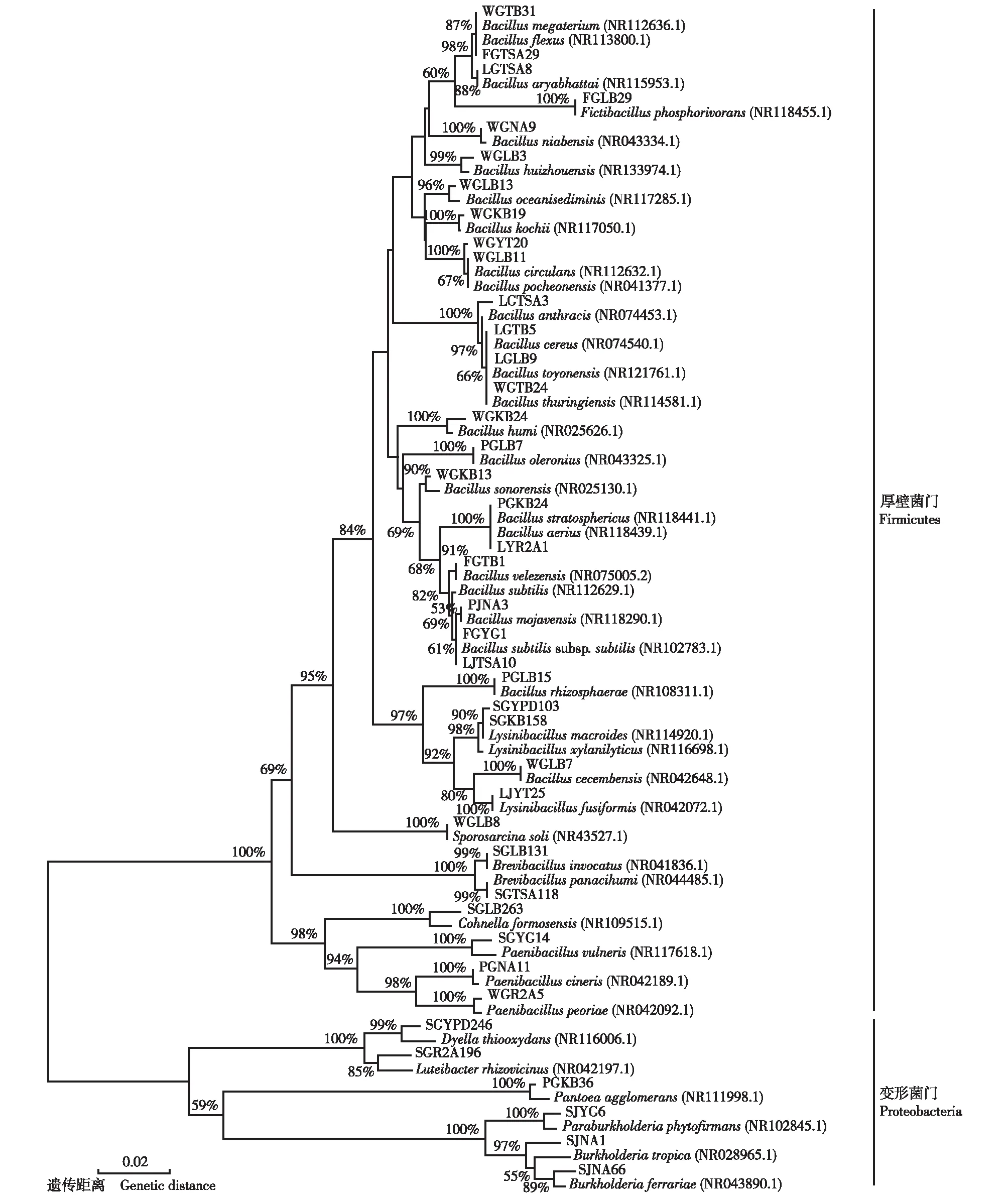
分支上的数值为1 000次重复抽样检测的自展支持率 Datums on the branches are the bootstrap values of 1 000 replications. 括号内的编号为近缘菌株在GenBank数据库中的登录号 Nos. in brackets are accession numbers of relative strains in GenBank database. 大写字母和数字组合为各OTU代表菌株的编号 Combinations of capitals and numbers are Nos. of representative strains of each OTU.图1 基于16S rDNA序列构建的金钗石斛内生细菌各OTU代表菌株与GenBank数据库中近缘菌株的系统发育树Fig. 1 Phylogenetic tree of representative strains of each OTU of endophytic bacteria in Dendrobium nobile Lindl. and relative strains in GenBank database based on 16S rDNA sequences
结果表明:分离的菌株属于厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)2门,包括5科12属40种1亚种,且各OTU代表菌株与GenBank数据库中近缘菌株16SrDNA序列的相似度为98%~100%。
属于厚壁菌门的OTUs有35个,分离菌株数占金钗石斛内生细菌分离菌株总数的90.7%,包括芽孢杆菌科(Bacillaceae)和类芽孢杆菌科(Paenibacillaceae)2科共7属,其中,芽孢杆菌科包括芽孢杆菌属(Bacillus)、赖氨酸芽孢杆菌属(Lysinibacillus)和虚构芽孢杆菌属(Fictibacillus)3属,类芽孢杆菌科包括短芽孢杆菌属(Brevibacillus)、类芽孢杆菌属(Paenibacillus)、芽孢八叠球菌属(Sporosarcina)和柯恩氏菌属(Cohnella)4属。进一步分析结果表明:属于芽孢杆菌属的OTUs有24个,分离菌株数占金钗石斛内生细菌分离菌株总数的61.3%;属于类芽孢杆菌属和赖氨酸芽孢杆菌属的OTUs各有3个,分离菌株数分别占金钗石斛内生细菌分离菌株总数的6.2%和0.3%;属于短芽孢杆菌属的OTUs有2个,分离菌株数占金钗石斛内生细菌分离菌株总数的20.4%;属于柯恩氏菌属、芽孢八叠球菌属和虚构芽孢杆菌属的OTUs各只有1个,分离菌株数分别占金钗石斛内生细菌分离菌株总数的2.1%、0.2%和0.2%。
属于变形菌门的OTUs有6个,分离菌株数占金钗石斛内生细菌分离菌株总数的9.3%,包括伯克氏菌科(Burkholderiaceae)、肠杆菌科(Enterobacteriaceae)和黄单胞菌科(Xanthomonadaceae)3科共5属,其中,伯克氏菌科包括伯克氏菌属(Burkholderia)和副伯克氏菌属(Paraburkholderia)2属,黄单胞菌科包括藤黄杆菌属(Luteibacter)和戴氏菌属(Dyella)2属,肠杆菌科仅泛菌属(Pantoea)1属。进一步分析结果表明:属于伯克氏菌属的OTUs有2个,属于副伯克氏菌属、戴氏菌属、泛菌属和藤黄杆菌属的OTUs各只有1个,分离菌株数分别占金钗石斛内生细菌分离菌株总数的3.6%、3.0%、2.6%、0.1%和0.1%。
从分离菌株数的比例来看,芽孢杆菌属和短芽孢杆菌属为金钗石斛内生细菌的优势属;Bacillussubtilissubsp.subtilis和Brevibacillusinvocatus为优势种(亚种),分离菌株数分别占金钗石斛内生细菌分离菌株总数的42.5%和20.3%。
2.2 金钗石斛不同器官内生细菌的组成及多样性分析
2.2.1组成分析研究结果(表2)表明:从金钗石斛根中分离出695株内生细菌菌株,占金钗石斛内生细菌分离菌株总数的64.3%,包括12属38种1亚种;从茎和叶中各分离出232和154株内生细菌菌株,分别占金钗石斛内生细菌分离菌株总数的21.5%和14.2%,分别包括7属13种1亚种和6属11种1亚种。进一步分析结果表明:OTU31和OTU41仅在金钗石斛茎中分离获得,其余39个OTUs均可在金钗石斛根中分离获得,其中的24个OTUs仅能在根中分离获得,但分离菌株数较少;金钗石斛根、茎和叶中内生细菌的共有OTUs有9个。
结合表1,从分离菌株数的比例来看,芽孢杆菌属和短芽孢杆菌属为金钗石斛根、茎和叶内生细菌的优势属,Bacillussubtilissubsp.subtilis和Brevibacillusinvocatus为优势种(亚种);并且,Burkholderiatropica、Paenibacilluscineris、Paraburkholderiaphytofirmans、Brevibacillusinvocatus、Bacillusaerius、Bacillusaryabhattai、Bacilluscereus、Bacillussubtilissubsp.subtilis和Bacillustoyonensis8种1亚种细菌在金钗石斛的根、茎和叶中均有分布。
表2不同器官、样地和培养基中金钗石斛内生细菌41个OTUs的分离菌株数量分析1)
Table2Analysisonisolatedstrainnumberof41OTUsofendophyticbacteriafromDendrobiumnobileLindl.indifferentorgans,plots,andmedia1)

OTU编号 No.ofOTU器官2) Organ2)样地3) Plot3)培养基 MediumRSLP1P2P3TSANALBR2AKBYGTBYPDYT变形菌门Proteobacteria OTU3312——3——111————— OTU1022104111114625365422 OTU4291217961146—1289 OTU231——1——————1———— OTU2925—31198521421481 OTU201———1————1—————厚壁菌门Firmicutes OTU143814829171410817654352 OTU391——1—————1————— OTU185—13121111—11—— OTU21086447886170304132411513111818 OTU341———1—1———————— OTU13212—1184222724121 OTU272——1—1—1——————1 OTU15317625910587846241 OTU15——3111111———1— OTU214744281215127111247——2 OTU301——1————1—————— OTU161——1————1—————— OTU740137341313101213935—35 OTU262——2————1—————1 OTU82——2————1—————1 OTU401————1——1—————— OTU1711—11—11——————— OTU282——2————1—1———— OTU381————1————1———— OTU114——2111——11——1— OTU92——1—11—————1—— OTU241———1———————1—— OTU31—1———1—1——————— OTU251——1———1——————— OTU221——1————1—————— OTU322——1—1——1——1——— OTU191————1————1———— OTU121—1—11—1———1——— OTU3279110702071271256888102981611352219 OTU361——1————————1—— OTU59216421121—3121 OTU352——1—1——1—1———— OTU41—1———1————————1 OTU371———1————————1— OTU61———1—————1————总计Total6952321544932932951561802082016463677765
1)—: 未分离出内生细菌 No endophytic bacterium isolated.
2)R: 根 Root; S: 茎 Stem; L: 叶 Leaf.
3)P1: 贵州省赤水市旺隆镇 Wanglong Town in Chishui City of Guizhou Province; P2: 贵州省贵阳市贵州师范大学生命科学学院大棚 Greenhouse of School of Life Sciences of Guizhou Normal University in Guiyang City of Guizhou Province; P3: 贵州省金沙县台金生态农业观光园 Taijin Ecological Agricultural Sightseeing Garden in Jinsha County of Guizhou Province.
2.2.2多样性分析从分离自金钗石斛根、茎和叶的内生细菌多样性分析结果(表3)来看,根中内生细菌的Shannon-Wiener多样性指数(H′)和Margalef丰富度指数(R)最高,分别为2.20和5.81;茎中内生细菌的H′和R值分别为1.57和2.39,叶中内生细菌的H′和R值分别为1.71和2.18。从Pielou均匀度指数(E)来看,叶中内生细菌的E值最高,为0.69;根和茎中内生细菌的E值相近,分别为0.60和0.59。
Sørenson相似性系数分析结果表明:金钗石斛叶和茎间、根和叶间以及根和茎间内生细菌的Sørenson相似性系数分别为0.82、0.55和0.57,并且,叶和茎间内生细菌的Sørenson相似性系数显著高于根和叶间以及根和茎间内生细菌的Sørenson相似性系数(P<0.05)。
表3金钗石斛不同器官内生细菌的多样性分析
Table3DiversityanalysisonendophyticbacteriaindifferentorgansofDendrobiumnobileLindl.

器官Organ分离菌株数IsolatedstrainnumberOTU数量OTUnumberShannon-Wiener多样性指数Shannon-WienerdiversityindexMargalef丰富度指数MargalefrichnessindexPielou均匀度指数Pielouevennessindex根Root695392.205.810.60茎Stem232141.572.390.59叶Leaf154121.712.180.69
2.3 不同样地金钗石斛内生细菌的组成及多样性分析
2.3.1组成分析研究结果(表2)表明:从贵州省赤水市旺隆镇(P1)的金钗石斛中分离出493株内生细菌菌株,占金钗石斛内生细菌分离菌株总数的45.6%,包括10属28种1亚种;从贵州省贵阳市贵州师范大学生命科学学院大棚(P2)的金钗石斛中分离出293株内生细菌菌株,占金钗石斛内生细菌分离菌株总数的27.1%,包括9属21种1亚种;从贵州省金沙县台金生态农业观光园(P3)的金钗石斛中分离出295株内生细菌菌株,占金钗石斛内生细菌分离菌株总数的27.3%,包括10属23种1亚种。进一步分析结果表明:P1、P2和P3样地金钗石斛内生细菌的特有OTUs分别有10、6和5个;3个样地金钗石斛内生细菌的共有OTUs有14个,分离菌株数占金钗石斛内生细菌分离菌株总数的96.5%。
结合表1,从分离菌株数的比例来看,芽孢杆菌属和短芽孢杆菌属为3个样地金钗石斛内生细菌的优势属,Bacillussubtilissubsp.subtilis和Brevibacillusinvocatus为优势种(亚种);并且,不同样地金钗石斛的内生细菌存在一定差异,例如:泛菌属仅分离自P1样地的金钗石斛,藤黄杆菌属仅分离自P2样地的金钗石斛,而芽孢八叠球菌属未分离自P2样地的金钗石斛,赖氨酸芽孢杆菌属未分离自P1样地的金钗石斛。
2.3.2多样性分析从分离自3个样地金钗石斛的内生细菌多样性分析结果(表4)来看:P1样地金钗石斛内生细菌的Margalef丰富度指数(R)明显高于P2和P3样地;而3个样地金钗石斛内生细菌的Shannon-Wiener多样性指数(H′)和Pielou均匀度指数(E)差异较小,其中,P1样地金钗石斛内生细菌的H′值略高于P2和P3样地,而P2样地金钗石斛内生细菌的E值则略高于P1和P3样地。
表4不同样地金钗石斛内生细菌的多样性分析
Table4DiversityanalysisonendophyticbacteriaofDendrobiumnobileLindl.indifferentplots
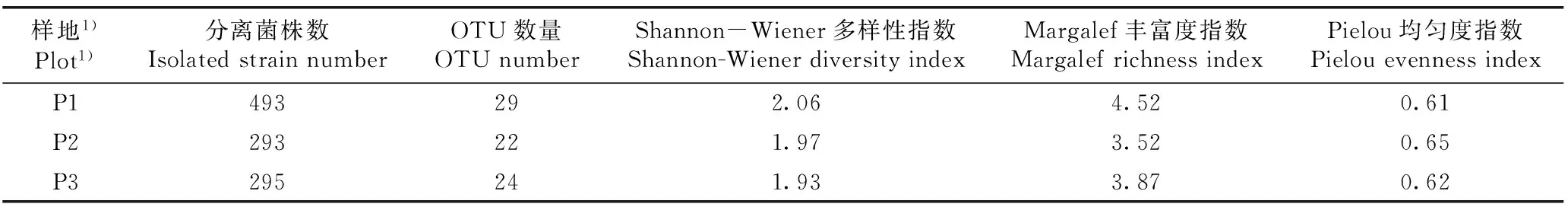
样地1)Plot1)分离菌株数IsolatedstrainnumberOTU数量OTUnumberShannon-Wiener多样性指数Shannon-WienerdiversityindexMargalef丰富度指数MargalefrichnessindexPielou均匀度指数PielouevennessindexP1493292.064.520.61P2293221.973.520.65P3295241.933.870.62
1)P1: 贵州省赤水市旺隆镇 Wanglong Town in Chishui City of Guizhou Province; P2: 贵州省贵阳市贵州师范大学生命科学学院大棚 Greenhouse of School of Life Sciences of Guizhou Normal University in Guiyang City of Guizhou Province; P3: 贵州省金沙县台金生态农业观光园 Taijin Ecological Agricultural Sightseeing Garden in Jinsha County of Guizhou Province.
2.4 不同培养基分离出的金钗石斛内生细菌的组成及数量分析
2.4.1组成分析研究结果(表2)表明:TSA培养基从金钗石斛中分离出156株内生细菌菌株,占金钗石斛内生细菌分离菌株总数的14.4%,包括7属16种1亚种;NA培养基从金钗石斛中分离出180株内生细菌菌株,占金钗石斛内生细菌分离菌株总数的16.7%,包括8属18种1亚种;LB培养基从金钗石斛中分离出208株内生细菌菌株,占金钗石斛内生细菌分离菌株总数的19.2%,包括8属22种1亚种;R2A培养基从金钗石斛中分离出201株内生细菌菌株,占金钗石斛内生细菌分离菌株总数的18.6%,包括8属16种1亚种;KB培养基从金钗石斛中分离出64株内生细菌菌株,占金钗石斛内生细菌分离菌株总数的5.9%,包括9属15种1亚种;YG培养基从金钗石斛中分离出63株内生细菌菌株,占金钗石斛内生细菌分离菌株总数的5.8%,包括7属13种1亚种;TB培养基从金钗石斛中分离出67株内生细菌菌株,占金钗石斛内生细菌分离菌株总数的6.2%,包括7属12种1亚种;YPD培养基从金钗石斛中分离出77株内生细菌菌株,占金钗石斛内生细菌分离菌株总数的7.1%,包括8属12种1亚种;YT培养基从金钗石斛中分离出65株内生细菌菌株,占金钗石斛内生细菌分离菌株总数的6.0%,包括9属14种1亚种。进一步分析结果表明:TSA、YPD和YT培养基分离出的金钗石斛内生细菌均有1个特有OTU,NA、R2A和TB培养基分离出的金钗石斛内生细菌均有2个特有OTUs,LB和KB培养基分离出的金钗石斛内生细菌分别有3和4个特有OTUs,而YG培养基分离出的金钗石斛内生细菌无特有OTU;9种培养基分离出的金钗石斛内生细菌共有OTUs有7个。
结合表1,从分离菌株数的比例来看,芽孢杆菌属和短芽孢杆菌属为9种培养基分离出的金钗石斛内生细菌的优势属,Bacillussubtilissubsp.subtilis和Brevibacillusinvocatus为优势种(亚种)。
2.4.2数量分析统计结果(表5)表明:NA培养基从金钗石斛根中分离出的内生细菌菌落数最多,为10.67×105CFU·g-1;R2A培养基从金钗石斛根中分离出的内生细菌菌落数次之,为10.20×105CFU·g-1;KB培养基从金钗石斛根中分离出的内生细菌菌落数最少,仅为1.76×105CFU·g-1。供试9种培养基从金钗石斛根中分离出的内生细菌菌落数存在极显著差异(P<0.01),并且,TSA、NA、LB和R2A培养基从金钗石斛根中分离出的内生细菌菌落数显著高于KB、YG、TB、YPD和YT培养基。另外,TSA、NA、LB、R2A和KB培养基从金钗石斛根中分离出的内生细菌OTU数量均较多(15~20个OTUs),而YG、TB、YPD和YT培养基从金钗石斛根中分离出的内生细菌OTU数量却较少(9~10个OTUs)。
由表5可见:LB培养基从金钗石斛茎中分离出的内生细菌菌落数最多,为10.47×104CFU·g-1;KB培养基从金钗石斛茎中分离出的内生细菌菌落数次之,为9.23×104CFU·g-1;NA培养基从金钗石斛茎中分离出的内生细菌菌落数最少,仅为3.70×104CFU·g-1。供试9种培养基从金钗石斛茎中分离出的内生细菌菌落数无显著差异。另外,9种培养基从金钗石斛茎中分离出的内生细菌OTU数量差异较小(7~11个OTUs)。
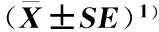
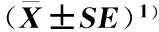
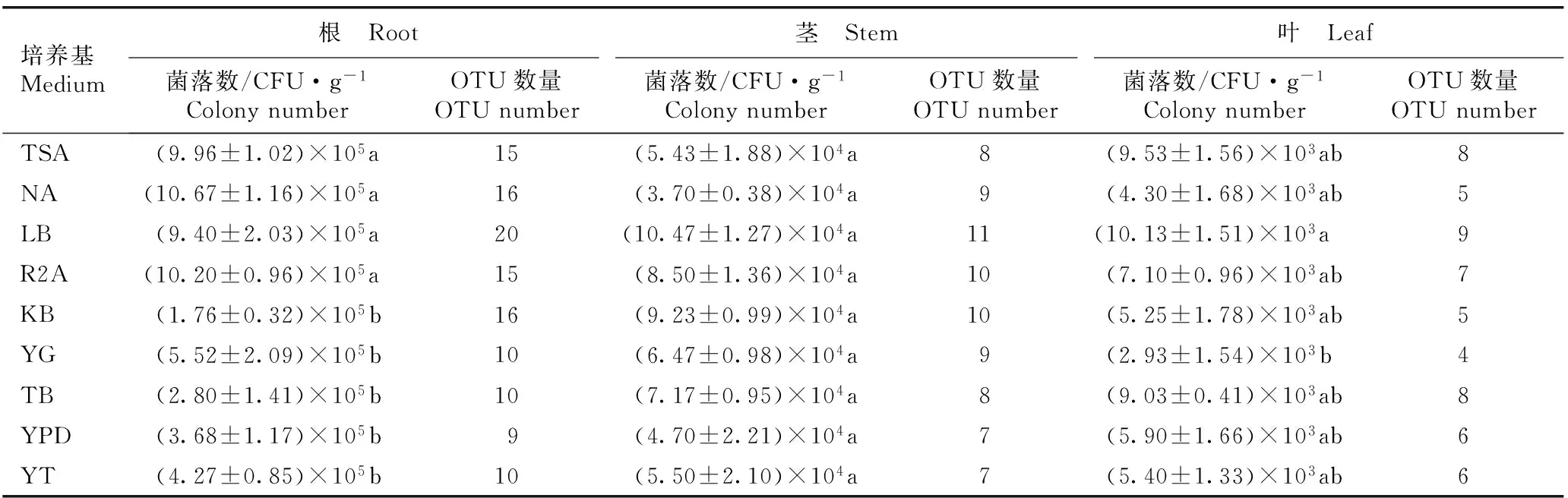
培养基Medium根 Root茎 Stem叶 Leaf菌落数/CFU·g-1ColonynumberOTU数量OTUnumber菌落数/CFU·g-1ColonynumberOTU数量OTUnumber菌落数/CFU·g-1ColonynumberOTU数量OTUnumberTSA(9.96±1.02)×105a15(5.43±1.88)×104a8(9.53±1.56)×103ab8NA(10.67±1.16)×105a16(3.70±0.38)×104a9(4.30±1.68)×103ab5LB(9.40±2.03)×105a20(10.47±1.27)×104a11(10.13±1.51)×103a9R2A(10.20±0.96)×105a15(8.50±1.36)×104a10(7.10±0.96)×103ab7KB(1.76±0.32)×105b16(9.23±0.99)×104a10(5.25±1.78)×103ab5YG(5.52±2.09)×105b10(6.47±0.98)×104a9(2.93±1.54)×103b4TB(2.80±1.41)×105b10(7.17±0.95)×104a8(9.03±0.41)×103ab8YPD(3.68±1.17)×105b9(4.70±2.21)×104a7(5.90±1.66)×103ab6YT(4.27±0.85)×105b10(5.50±2.10)×104a7(5.40±1.33)×103ab6
1)同列中的不同小写字母表示不同培养基从同一器官中分离的内生细菌菌落数差异显著(P<0.05) Different lowercases in the same column indicate the significant difference in colony number of endophytic bacteria isolated from the same organ among different media (P<0.05).
由表5还可见:LB培养基从金钗石斛叶中分离出的内生细菌菌落数最多,为10.13×103CFU·g-1;TSA培养基从金钗石斛叶中分离出的内生细菌菌落数次之,为9.53×103CFU·g-1;YG培养基从金钗石斛叶中分离出的内生细菌菌落数最少,仅为2.93×103CFU·g-1。供试9种培养基从金钗石斛叶中分离出的内生细菌菌落数存在显著差异(P<0.05),并且,LB培养基从金钗石斛叶中分离出的内生细菌菌落数显著高于YG培养基,而二者与其余7种培养基从金钗石斛叶中分离出的内生细菌菌落数差异不显著。另外,供试9种培养基从金钗石斛叶中分离出的内生细菌OTU数量较少(4~9个OTUs)。
比较分析结果表明:供试9种培养基从金钗石斛根中分离出的内生细菌菌落数和OTU数量均最多,从金钗石斛茎中分离出的内生细菌菌落数和OTU数量居中,而从金钗石斛叶中分离出的内生细菌菌落数和OTU数量均最少。
3 讨论和结论
兰科植物的内生细菌对宿主植物的生长、抗病和抗逆性等具有重要作用,因此,分离纯化金钗石斛的内生细菌并研究其组成有助于阐明内生细菌在与金钗石斛共生过程中的功能和作用。本研究从金钗石斛中共分离出1 081株内生细菌菌株,隶属2门5科12属,可划分为41个OTUs,并且,金钗石斛的内生细菌具有较高的遗传多样性。据不完全统计,从兰科植物中分离出的内生细菌不少于60种,并且,兰科植物内生细菌的组成差异与其生境不同有关[8-9];Tsavkelova等[8]和Wilkinson等[21]的研究结果表明:芽孢杆菌属和假单胞菌属(Pseudomonas)为兰科植物内生细菌的优势属,常见内生细菌还包括类芽孢杆菌属、伯克氏菌属、肠杆菌属(Enterobacter)和赖氨酸芽孢杆菌属等[10-13];本研究中,芽孢杆菌属和短芽孢杆菌属为金钗石斛内生细菌的优势属,并且未从金钗石斛体内分离出假单胞菌属内生细菌。作者还采用相同培养基对金钗石斛根际土壤进行了细菌分离实验,同样得出芽孢杆菌属和假单胞菌属为优势属的结论(另文发表)。另外,芽孢八叠球菌属、柯恩氏菌属和虚构芽孢杆菌属在兰科植物内生细菌研究中鲜见报道。推测兰科植物内生细菌组成差异除了与生境有关外,还可能与寄主植物种类密切相关。
兰科植物的许多内生细菌对植物的种子萌发和植株生长具有促生作用,被称为植物促生细菌(plant growth promoting bacteria,PGPB)。在金钗石斛分离的内生细菌中,OTU40的代表菌株PGLB15与GenBank数据库中近缘菌株Bacillusrhizosphaerae(登录号NR108311.1)16SrDNA序列的相似度为99%,OTU10的代表菌株SJNA1与GenBank数据库中近缘菌株Burkholderiatropica(登录号NR028965.1)16SrDNA序列的相似度为98%,OTU9的代表菌株WGTB31与GenBank数据库中近缘菌株Bacillusmegaterium(登录号NR112636.1)16SrDNA序列的相似度为100%,并且,这些近缘菌株均具有固氮作用[22-23],据此推测这些代表菌株可能为金钗石斛生长提供氮素营养。另外,在金钗石斛分离的内生细菌中,OTU24的代表菌株FGTB1与GenBank数据库中近缘菌株Bacillusvelezensis(登录号NR075005.2)16SrDNA序列的相似度为99%,OTU4的代表菌株SJYG6与GenBank数据库中近缘菌株Paraburkholderiaphytofirmans(登录号NR102845)16SrDNA序列的相似度为99%,并且,这2种近缘菌株对植物均具有一定的促生作用[24-25],据此推测这2种代表菌株对金钗石斛也有促生作用。研究表明:细茎石斛的许多内生菌具有解磷、解钾、产生长素及产嗜铁素的能力[11];杓唇石斛的鞘氨醇菌属(Sphingomonas)和分枝菌属(Mycobacterium)内生细菌[8]及铁皮石斛根中Sphingomospaucimmobilis和Paenibacillusmucilaginosus等内生细菌[16]对宿主植物均具有促生作用。已有研究表明:金钗石斛的多株内生细菌具有产IAA和解钾等活性,并对玉米(ZeamaysLinn.)种子萌发和幼苗生长具有促生作用[26]。然而,关于内生细菌促进兰科植物生长的机制尚未明确,关于金钗石斛内生细菌的促生作用也未可知,均有待深入研究。
由于植株各营养器官所处的微环境不同,导致植物内生细菌在器官中的分布存在差异,部分内生细菌具有明显的组织偏向性。本研究结果表明:金钗石斛根中内生细菌的菌落数和多样性均高于茎和叶;在分离出的12属41个OTUs中,有2个OTUs仅能在茎中分离获得,其余39个OTUs均可在根中分离获得,且其中的24个OTUs仅能在根中分离获得。推测造成上述结果的原因可能是由于金钗石斛根际土壤中的细菌含量丰富且多样性较高(另文发表),并且,金钗石斛海绵状结构组织的气根为内生细菌提供了适宜的栖居生境,更易被根际土壤中的细菌成功定植[5,8]。另外,金钗石斛叶和茎间内生细菌的Sørenson相似性系数(0.82)显著高于叶和根间(0.55)以及茎和根间(0.57)内生细菌的Sørenson相似性系数,这可能与金钗石斛叶和茎中含有较高含量的石斛碱有关[2],推测石斛碱的积累可能对金钗石斛的内生细菌具有选择作用,因此,关于金钗石斛内生细菌组成与石斛碱的关系有待进一步深入研究。
微生物可借助空气和雨水等,通过植物表面伤口或气孔从叶表面进入体内,但根部裂纹仍是目前细菌在植物体内定植的最主要“热点”[25]。本研究中,金钗石斛内生细菌菌株PGLB15、FGTB1、SGLB263、SGKB158、SGYPD246、SGR2A196、WGLB3、WGKB13、WGKB24、WGLB8和WGYT20等与已报道的土壤细菌16SrDNA序列具有较高的相似性[22,24,27-35];并且,金钗石斛内生细菌中16个OTUs的代表菌株与金钗石斛根际土壤中分离的细菌16SrDNA序列具有较高的相似性(97%~100%)(另文发表),但内生细菌的多样性低于根际土壤细菌,而内生细菌中Cohnella、Sporosarcina、Dyella、Luteibacter和Pantoea的种类并未在金钗石斛根际土壤中分离获得,说明金钗石斛特别是根部的内生细菌与其根际土壤细菌间既存在一定的相似性,也存在一定的特异性。值得注意的是,金钗石斛代表菌株SGLB263和SGKB158的近缘菌株均具有降解木聚糖的作用[27-28],说明这2种内生细菌可能通过分解表皮和细胞壁进入金钗石斛体内,并以组织中的纤维素为碳源,顺利定植于体内。
研究表明:植物内生细菌间以及内生细菌与宿主植物间存在和谐与竞争的关系[36]。贵州省赤水市旺隆镇(P1)、贵州省贵阳市贵州师范大学生命科学学院大棚(P2)和贵州省金沙县台金生态农业观光园(P3)的金钗石斛内生细菌的Shannon-Wiener多样性指数和Pielou均匀度指数差异较小,3个样地金钗石斛内生细菌的共有OTUs有14个,分离菌株数占金钗石斛内生细菌分离菌株总数的96.5%,且优势属均为芽孢杆菌属和短芽孢杆菌属,优势种(亚种)均为Bacillussubtilissubsp.subtilis和Brevibacillusinvocatus,据此推测这3个样地金钗石斛的来源相同,且内生细菌的优势属和优势种(亚种)与金钗石斛的生长发育有关。Wilkinson等[37]认为,兰科植物内生细菌的优势属随地区和季节,尤其是基于菌根菌侵染的组织形态不同而发生变化,且不同地区间存在差异;童文君等[10]也认为,不同产地美花石斛的内生细菌存在地区特异性。本研究中,供试3个样地金钗石斛内生细菌的特有OTUs共21个,但分离菌株数较少,仅占金钗石斛内生细菌分离菌株总数的2.4%,推测这可能与不同样地的环境和栽培条件有关。
本研究中,不同培养基从金钗石斛中分离出的内生细菌的菌株数量和种类存在差异;与营养成分含量较高的YPD、YT和YG培养基相比,NA、TSA、LB、KB、R2A和TB培养基分离出的金钗石斛内生细菌的菌落数和OTU数量更多。郭斌等[38]认为,多数微生物更倾向于生长在与其自然环境相近的基质中。当在贫营养的植物体内生长的微生物突然被转移到富营养的培养基中时,将导致其新陈代谢反应失衡,不利于其生长[36]。R2A是一种贫营养型培养基,含有的丙酮酸钠能够降解微生物培养过程中产生的毒性氧[39],因而,该培养基从金钗石斛中分离出的内生细菌的菌株数量和种类较丰富。
综上所述,金钗石斛内生细菌资源丰富,且其内生细菌的组成和多样性与分离器官、种植地及培养基密切相关;其中,芽孢杆菌属和短芽孢杆菌属为金钗石斛内生细菌的优势属,Bacillussubtilissubsp.subtilis和Brevibacillusinvocatus为优势种(亚种)。
参考文献:
[1]国家药典委员会. 中华人民共和国药典: 2010年版(一部)[M]. 北京: 中国医药科技出版社, 2010: 85-86.
[2]乙引, 陈玲, 张习敏. 金钗石斛研究[M]. 北京: 电子工业出版社, 2009: 6.
[3]JAMES E K, OLIVARES F L. Infection and colonization of sugar cane and other graminaceous plants by endophytic diazotrophs[J]. Critical Reviews in Plant Sciences, 1997, 17(1): 77-119.
[4]SHAO S C, BURGESS K S, CRUSE-SANDERS J M, et al. Usinginsitusymbiotic seed germination to restore over-collected medicinal orchids in southwest China[J]. Frontiers in Plant Science, 2017, 8: 888.
[5]PAVLOVA A S, LEONTIEVA M R, SMIRNOVA T A, et al. Colonization strategy of the endophytic plant growth-promoting strains ofPseudomonasfluorescensandKlebsiellaoxytocaon the seeds, seedlings and roots of the epiphytic orchid,DendrobiumnobileLindl.[J]. Journal of Applied Microbiology, 2017, 123(1): 217-232.
[6]FARIA D C, DIAS A C F, MELO I S, et al. Endophytic bacteria isolated from orchid and their potential to promote plant growth[J]. World Journal of Microbiology and Biotechnology, 2013, 29(2): 217-221.
[7]TSAVKELOVA E A, EGOROVA M A, LEONTIEVA M R, et al.DendrobiumnobileLindl. seed germination in co-cultures with diverse associated bacteria[J]. Plant Growth Regulation, 2016, 80(1): 1-13.
[8]TSAVKELOVA E A, CHERDYNTSEVA T A, BOTINA S G, et al. Bacteria associated with orchid roots and microbial production of auxin[J]. Microbiological Research, 2007, 162(1): 69-76.
[9]张萍, 宋希强. 兰科植物内生细菌物种多样性及其促生机理研究进展[J]. 热带亚热带植物学报, 2012, 20(1): 92-98.
[10]童文君, 张礼, 薛庆云, 等. 不同产地美花石斛内生细菌分离及促生潜力比较[J]. 植物资源与环境学报, 2014, 23(1): 16-23.
[11]张礼, 童文君, 薛庆云, 等. 细茎石斛内生和根围细菌多样性及促生能力分析[J]. 植物资源与环境学报, 2015, 24(3): 32-40.
[12]王明月, 陶茜, 李克艳, 等. 铁皮石斛内生细菌群落结构分析[J]. 西部林业科学, 2014, 43(5): 106-111.
[13]TSAVKELOVA E A, CHERDYNTSEVA T A, NETRUSOV A I. Bacteria associated with the roots of epiphyticorchids[J]. Microbiology, 2004, 73(6): 825-831.
[14]AHEMAD M, KIBRET M. Mechanisms and applications of plant growth promoting rhizobacteria: current perspective[J]. Journal of King Saud University-Science, 2014, 26(1): 1-20.
[15]SINGH S P, GAUR R. Evaluation of antagonistic and plant growth promoting activities of chitinolytic endophytic actinomycetes associated with medicinal plants againstSclerotiumrolfsiiin chickpea[J]. Journal of Applied Microbiology, 2016, 121(2): 506-518.
[16]俞婕, 赵凯鹏, 董飞, 等. 野生铁皮石斛内生菌的分离及促生作用研究[J]. 现代农业科技, 2010(9): 96-97.
[17]DA SILVA J A T, TSAVKELOVA E A, ZENG S, et al. Symbioticinvitroseed propagation ofDendrobium: fungal and bacterial partners and their influence on plant growth and development[J]. Planta, 2015, 242(1): 1-22.
[18]付芳婧, 刘政. 金钗石斛优良种源的适生条件及仿野生栽培的关键技术[J]. 种子, 2012, 31(7): 137-139.
[19]董乙乂, 艾义郎, 黄煜, 等. 人类活动对织金洞洞穴水中可培养细菌多样性的影响[J]. 贵州师范大学学报(自然科学版), 2017, 35(4): 64-70, 76.
[20]WHITTAKER R H. Evolution and measurement of species diversity[J]. Taxon, 1972, 21(2/3): 213-251.
[21]WILKINSON K G, SIVASITHAMPARAM K, DIXON K W, et al. Identification and characterization of bacteria associated with western Australian orchids[J]. Soil Biology Biochemistry, 1994, 26(1): 137-142.
[22]MADHAIYAN M, POONGUZHALI S, LEE J-S, et al.Bacillusrhizosphaeraesp. nov., an novel diazotrophic bacterium isolated from sugarcane rhizosphere soil[J]. Antonie van Leeuwenhoek, 2011, 100(3): 437-444.
[23]REIS V M, SANTOS P E-D I, TENORIO-SALGADO S, et al.Burkholderiatropicasp. nov., a novel nitrogen-fixing, plant-associated bacterium[J]. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(6): 2155-2162.
[24]CHEN X H, KOUMOUTSI A, SCHOLZ R, et al. Comparative analysis of the complete genome sequence of the plant growth-promoting bacteriumBacillusamyloliquefaciensFZB42[J]. Nature Biotechnology, 2007, 25(9): 1007-1014.
[25]HARDOIM P R, VAN OVERBEEK L S, VAN ELSAS J D. Properties of bacterial endophytes and their proposed role in plant growth[J]. Trends in Microbiology, 2008, 16(10): 463-471.
[26]高阳, 朱双丽, 吴庆珊, 等. 金钗石斛IAA内生细菌筛选及对干旱胁迫下玉米种子萌发的影响[J]. 种子, 2017, 36(4): 36-41.
[27]HAMEED A, HUNG M-H, LIN S-Y, et al.Cohnellaformosensissp. nov., a xylanolytic bacterium isolated from the rhizosphere ofMedicagosativaL.[J]. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(8): 2806-2812.
[28]LEE C S, JUNG Y-T, SOOYEON P, et al.Lysinibacillusxylanilyticussp. nov., a xylan-degrading bacterium isolated from forest humus[J]. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(2): 281-286.
[29]WEON H-Y, ANANDHAM R, KIM B-Y, et al.Dyellasolisp. nov. andDyellaterraesp. nov., isolated from soil[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(7): 1685-1690.
[30]JOHANSEN J E, BINNERUP S J, KROER N, et al.Luteibacterrhizovicinusgen. nov., sp. nov., a yellow-pigmented gammaproteobacterium isolated from the rhizosphere of barley (HordeumvulgareL.)[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(6): 2285-2291.
[31]LI J, YANG G, WU M, et al.Bacillushuizhouensissp. nov., isolated from a paddy field soil[J]. Antonie van Leeuwenhoek, 2014, 106(2): 357-363.
[32]PALMISANO M M, NAKAMURA L K, DUNCAN K E, et al.Bacillussonorensissp. nov., a close relative ofBacilluslicheniformis, isolated from soil in the Sonoran Desert, Arizona[J]. International Journal of Systematic and Evolutionary Microbiology, 2001, 51(5): 1671-1679.
[34]KWON S-W, KIM B-Y, SONG J, et al.Sporosarcinakoreensissp. nov. andSporosarcinasolisp. nov., isolated from soil in Korea[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(8): 1694-1698.
[35]TEN L N, BAEK S-H, IM W-T, et al.Bacilluspocheonensissp. nov., a moderately halotolerant, aerobic bacterium isolated from soil of a ginseng field[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(11): 2532-2537.
[36]冉国华, 张志元. 植物内生细菌研究及其应用[J]. 海南大学学报(自然科学版), 2004, 22(4): 365-373.
[37]WILKINSON K G,DIXON K W,SIVASITHAMPARAM K, et al. Effect of IAA on symbiotic germination of an Australian orchid and its production by orchid-associated bacteria[J]. Plant and Soil, 1994, 159(2): 291-295.
[38]郭斌, 吴晓磊, 钱易. 提高微生物可培养性的方法和措施[J]. 微生物学报, 2006, 46(3): 504-507.
[39]BLOOMFIELD S F, STEWART G S, DODD C E, et al. The viable but non-culturable phenomenon explained?[J]. Microbiology, 1998, 144(1): 1-3.
