局部亚低温条件下急性脑梗死患者血清NSE和S-100蛋白水平变化及其保护机制
2018-04-08王慧霞赵建华
王慧霞 赵建华
1)郑州市第七人民医院神经内科,河南 郑州 450000 2)新乡医学院,河南 新乡 453000 3)河南省人民医院,河南 郑州 450000
近年来急性脑梗死发病率呈现逐年攀升趋势,对患者及其家庭的生活质量造成严重影响[1]。目前,临床治疗急性脑梗死较多的方式为采用静脉溶栓血管再通,但存在较为严格的禁忌证和时间窗,故采用科学有效的脑保护措施对治疗急性脑梗死具有重要意义[2]。早期动物实验研究结果显示[3],局部亚低温治疗可对神经元细胞发挥重要的保护作用,现阶段亦有临床结果证实[4],局部亚低温治疗逐步成为治疗缺血性脑损伤后的有效措施。本研究主要探讨局部亚低温条件下急性脑梗死患者血清神经元特异性烯醇化酶(NSE)和S-100蛋白水平变化及其保护机制,以期为临床治疗提供新思路。现报告如下。
1 资料与方法
1.1一般资料纳入2015-02—2017-02郑州市第七人民医院神经内科诊疗的急性脑梗死患者120例为研究对象。纳入标准:(1)经颅脑CT或MRI检查确诊;(2)年龄20~80岁;(3)发病时间<24 h;(4)首次发病;(5)未接受动静脉溶栓治疗;(6)对本研究使用方法不存在禁忌证者;(7)参与本人及家属均知情同意者。排除标准:(1)依从性较差,且不能进行有效配合;(2)属于短暂性缺血发作;(3)临床资料残缺;(4)就诊时生命体征已不稳定;(5)存在脑炎、脑肿瘤、动脉瘤、脑外伤等其他脑部损伤病情;(6)凝血功能严重异常;(7)伴有严重脓毒症。本研究经我院医学伦理委员会批准同意。120例急性脑梗死患者按照随机数字表法分为实验组(n=60)和对照组(n=60),实验组男34例,女26例;年龄40~78(61.05±2.92)岁;发病至入院时间(7.84±1.09)h;基础疾病:高血压13例,冠心病22例,高血脂8例,糖尿病10例。对照组男33例,女27例;年龄39~79(61.18±2.81)岁;发病至入院时间(7.85±1.06)h;基础疾病:高血压14例,冠心病20例,高血脂9例,糖尿病11例。2组基线资料比较无显著性差异(P>0.05),具有可比性。
1.2方法对照组进行常规标准内科治疗,包括吸氧、抗栓、改善脑循环、抗血小板或抗凝、降低颅内压、纠正水电解质失衡、活血化瘀、营养神经等综合措施对症治疗,必要情况可给予鼻饲进食、吸痰等措施。实验组在对照组治疗基础上联合局部亚低温治疗:将密贴式冰帽亚低温治疗仪的降温帽戴至患者头部后启动仪器,并使患者鼓膜温度于2 h左右缓慢降低至34 ℃,且维持在33~35 ℃。进行亚低温治疗24 h后撤离机器,并于室温下复温6 h。采用欧姆龙红外线耳式温度计测量鼓膜温度,降温阶段15 min/次,保持及复温阶段1 h/次。进行局部亚低温治疗期间,部分患者可进行小剂量镇静药物治疗以预防并发症的发生,同时严密监测患者生命体征、意识状态及瞳孔变化。
1.3观察指标(1)采用美国国立卫生研究院卒中量表(NIHSS)评价2组神经功能变化。(2)临床疗效标准:基本治愈为NIHSS评分减少>90%,且病残程度为0级;显效为NIHSS评分减少46%~90%,病残程度为1~3级;有效为NIHSS评分减少18%~45%;无效为治疗后NIHSS评分减少<17%或有增加趋势,甚者病情恶化,发生死亡。临床有效率=(基本治愈+显效+有效)例数/总例数×100%。(3)采用头颅MRI测量2组治疗前及治疗5 d后脑梗死体积。(4)采集2组治疗前及治疗后3 d、7 d及14 d晨起空腹静脉血,经离心分离后,保存血清标本,采用ELISA检测2组血清NSE和S-100蛋白水平变化。

2 结果
2.12组临床疗效比较实验组临床治疗有效率显著高于对照组,差异显著(P<0.05)。见表1。
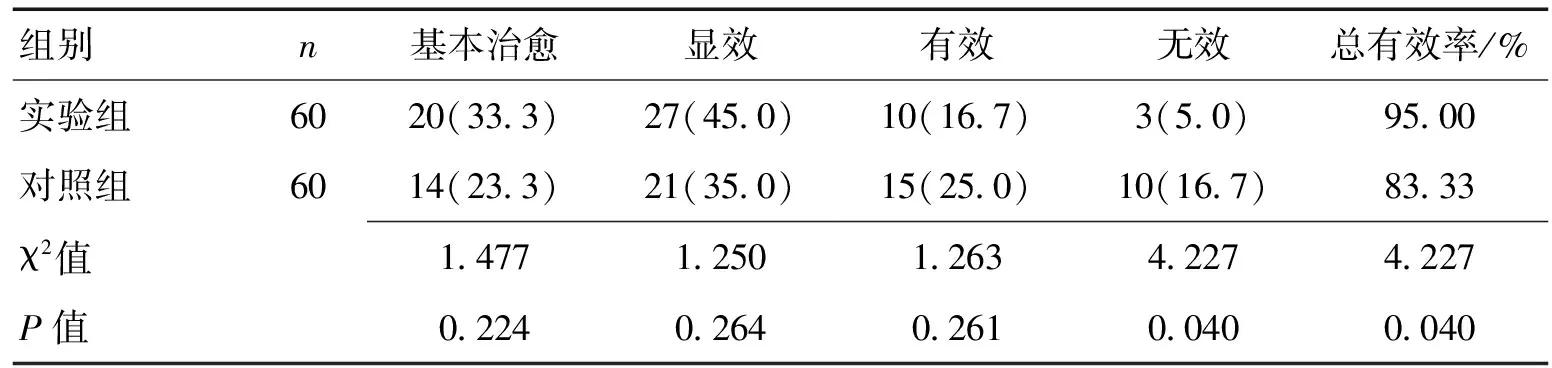
表1 2组临床疗效比较 [n(%)]
2.22组治疗前及治疗5 d后的脑梗死体积比较实验组治疗前脑梗死体积(6.14±2.15)cm3,治疗第5 d为(6.61±2.08)cm3,对照组分别为(6.20±2.09)cm3、(6.72±1.97)cm3,2组比较差异无统计学意义(t=0.155,P=0.877;t=0.297,P=0.767)。
2.32组不同时间点NIHSS评分比较治疗前,2组NIHSS评分差异无统计学意义(P>0.05),治疗后第7~14天2组NIHSS评分均显著低于治疗前(P<0.01),且治疗第14天实验组NIHSS评分显著低于对照组,差异有统计学意义(P<0.01)。见表2。
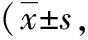
表2 2组不同时间点NIHSS评分比较分)
注:与治疗前比较,**P<0.01。
2.42组不同时间点血清NSE和S-100蛋白水平比较治疗前,2组血清NSE和S-100蛋白水平比较差异无统计学意义(P>0.05),治疗后第3~14 天2组血清NSE和S-100蛋白水平均显著低于治疗前(P<0.01),且实验组显著低于对照组,差异有统计学意义(P<0.05或P<0.01)。见表4。

表4 2组不同时间点血清NSE和S-100蛋白水平比较
注:与治疗前比较,**P<0.01
3 讨论
急性脑梗死的主要发病机制为机体颅外或局部脑动脉血管内壁受到创伤,并使其形成的血栓脱落,进而因阻塞导致脑供血动脉、脑部血供中断,并促进机体局部脑组织由于缺血、缺氧而严重受损,加剧相应区域神经功能损伤[5]。近年来研究发现,在局部亚低温条件下能有效保护实验性脑缺血和颅脑损伤的神经功能,但关于局部亚低温治疗急性脑梗死的研究相对较少[6]。本研究选取发病时间<24 h,且处于脑梗死急性期患者进行局部亚低温治疗,结果显示,实验组临床治疗有效率显著高于对照组,差异显著。表明局部亚低温治疗能够有效缓解患者的临床特征,提高其预后效果。
研究发现[7],全身亚低温治疗对大面积脑梗死患者的临床症状改善发挥重要作用,且不会显著增加进行低温干预患者并发症的发生。一项有关手术期间对蛛网膜下腔出血的患者给予亚低温治疗的Meta分析结果显示,该疗法可明显改善轻型患者的预后效果。同时有动物实验发现,局部亚低温治疗对缩小脑梗死面积起到显著作用[8-9]。本研究结果显示,治疗前及治疗第5天 2组脑梗死体积比较差异无统计学意义。提示在初始治疗阶段,局部亚低温治疗并不会缩小脑梗死面积,但实验组局部脑梗死面积小于对照组,可能是治疗第5天患者脑梗死状态并未达到水肿峰值,可考虑后续持续观察病情,进而行颅脑MRI测量脑梗死体积变化。近年来,随着基础实验和临床研究的逐步深入,学者们证实亚低温治疗对神经保护发挥关键作用,且耐受性好,后期并发症低[10-12]。本研究表明,治疗后第7~14天2组NIHSS评分均显著低于治疗前(P<0.01),且第14天实验组NIHSS评分显著低于对照组,差异具有统计学意义,同相关报道研究相似。血清NSE和S-100蛋白是临床监测脑组织损伤的有效指标,在神经细胞受损方面具有较高的敏感度,且两者水平愈高,提示神经受损程度呈严重[13-14]。本研究显示治疗后第3~14天2组血清NSE和S-100蛋白水平均显著低于治疗前,且实验组显著低于对照组,进一步提示局部亚低温治疗可明显降低机体神经元和神经胶质细胞的死亡,有助于机体脑保护作用。
目前,临床有关局部亚低温治疗的机制认为与以下因素有关[15]:(1)该疗法能有效抑制机体NO、白三烯以及去甲肾上腺素的合成,对脑血管舒张收缩功能的稳定发挥重要作用,且在一定程度能够维持机体血脑屏障的完整性,抑制水肿的发生发展;(2)该手段可减少机体脑细胞的氧耗,尽可能将脑细胞代谢稳定在一个相对较低的状态,同时避免乳酸等酸性物质的集聚,抑制酸中毒的发生;(3)可有效抑制氧自由基、乙酰胆碱、儿茶酚胺等多种内源性毒性物质的合成、释放,并可抑制机体释放炎症因子的生成,有效缓解机体脑组织的再灌注损伤,并减轻局部炎症反应的发生;(4)该措施对Ca2+内流发挥显著的阻断作用,进而有效降低因出现缺血半暗带细胞内Ca2+过量而致的不可逆性神经功能受损;(5)亦能够有效抑制脑细胞结构蛋白的损坏,对机体脑细胞结构和功能的恢复发挥促进作用。但有关局部亚低温治疗急性脑梗死的确切机制,仍需后续大样本,更深入的研究。
综上所述,对急性脑梗死患者在常规治疗的基础上给予早期的局部亚低温治疗可明显改善其临床特征,对保护机体神经细胞,促进其神经功能恢复发挥重要作用,该治疗凡是效果确切,值得临床推广应用。
[1]ZHANG M.Clinical research on traumatic cerebral infarction treated with mild-hypothermia and acupuncture[J].Zhongguo Zhen Jiu,2012,32(8):697-700.
[2]PENG X,YUE W,LIU W,et al.Protective roles of intra-arterial mild hypothermia and arterial thrombolysis in acute cerebral infarction[J].Springerplus,2016,5(1):1 988.
[3]罗映.局部亚低温对大鼠脑出血血清NSE和s-100β蛋白的影响[D].绵阳:西南医科大学,2016.
[4]陈阵,李文强.亚低温治疗大面积脑梗死临床进展[J].医学研究杂志,2012,41(2):17-19.
[5]PIIRONEN K,TIAINEN M,MUSTANOJA S,et al.Mild hypothermia after intravenous thrombolysis in patients with acute stroke:a randomized controlled trial[J].Stroke,2014,45(2):486-491.
[6]宋德刚,陈晓雪,李京龙,等.局部亚低温治疗对急性脑梗死患者疗效及可能作用机制的研究[J].河北医科大学学报,2017,38(5):510-513;565.
[7]GUO J,WANG Y,ZHU J,et al.Right axillary and femoral artery perfusion with mild hypothermia for aortic arch replacement[J].Journal of Cardiothoracic Surgery,2014,9(1):1-6.
[8]CHANG Y P,LIAO P T,SHEN E Y,et al.Protective effect against focal cerebral ischemia injury in acute phase of a novel invasive device for regional hypothermia[J].Journal of the Chinese Medical Association,2015,78(1):67-75.
[9]梁建军.体温控制对重型颅脑损伤患者血清中S-100B蛋白、LDH表达及预后的影响[J].中国实验诊断学,2016,20(5):755-757.
[10]胡骁,代永庆,陈士新,等.局部亚低温对脑梗死患者的脑保护机制的临床研究[J].重庆医学,2016,45(34):4 817-4 819.
[11]ANDRESEN M,GAZMURI J T,MARN A,et al.Therapeutic hypothermia for acute brain injuries[J].Scandinavian Journal of Trauma Resuscitation & Emergency Medicine,2015,23(1):42-48.
[12]郭晓燕,李爱琼,詹冀,等.局部亚低温对重症脑梗死患者血清NSE的影响[J].卒中与神经疾病,2012,19(4):214-216.
[13]吕连智,韩春花,杨文东.急性脑梗死患者血清MMP-9、NSE和S-100B蛋白水平变化及临床价值的研究分析[J].实用心脑肺血管病杂志,2012,20(6):977-978.
[14]SU Y,FAN L,ZHANG Y,et al.Improved Neurol-ogical Outcome With Mild Hypothermia in Surviving Patients With Massive Cerebral Hemispheric Infarction[J].Stroke,2015,47(2):457-463.
[15]曹建,杨小丽,谢海洋,等.局部亚低温对脑梗死患者的脑保护机制的临床研究[J].中国血液流变学杂志,2015,25(4):423-426.
