全腔镜与开放食管癌根治术的近期效果对比研究
2018-04-08朱坤寿王枫方卫民陈元美林绍峰应敏刚
朱坤寿,王枫,方卫民,陈元美,林绍峰,应敏刚
福建省肿瘤医院胸部外科,福州3500140
食管癌是一种恶性肿瘤,发病率居全球所有恶性肿瘤的第6位,在中国的发病率约为22/10万[1‐2]。外科手术是食管癌的主要治疗手段[3],传统的食管癌开放手术具有创伤大、术后恢复慢、并发症多及病死率高的缺点[4‐5]。近年来,中国腔镜外科技术迅速发展,具有创伤小、并发症少及恢复快的优势[6‐8]。本文回顾性分析94例食管癌患者的临床资料,旨在比较全腔镜与开放食管癌根治术的疗效,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2009年1月至2010年10月于福建省肿瘤医院胸外科施行食管癌根治术的94例食管癌患者的临床资料。纳入标准:①经内镜检查确诊为食管中段或下段鳞癌,病变长度≤7 cm;②CT增强扫描显示肿瘤无明显外侵;③年龄≤75岁;④术前检查明确可耐受开胸手术;⑤肿瘤无远处转移;⑥未接受术前新辅助治疗;⑦既往无恶性肿瘤病史;⑧美国麻醉师协会(American Society of An‐esthesiologists,ASA)评分≤3分;⑨体重指数(body mass index,BMⅠ)≤30 kg/m2;⑩卡氏评分(Karnof‐sky performance status,KPS)≥60分。排除标准:①肿瘤出现远处转移的患者;②肿瘤累及邻近脏器的患者;③肿瘤直径>7 cm的患者;④年龄<18岁或>75岁的患者;⑤ASA评分>3分的患者;⑥BMⅠ>30 kg/m2的患者;⑦KPS评分<60的患者;⑧既往有腹部手术史的患者。根据手术方式的不同将患者分为全腔镜组和传统开放组,每组47例。两组患者的年龄、性别、BMⅠ、ASA评分、临床分期、KPS评分、术前总蛋白水平、术前白蛋白水平、术前血红蛋白水平、糖尿病情况比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。
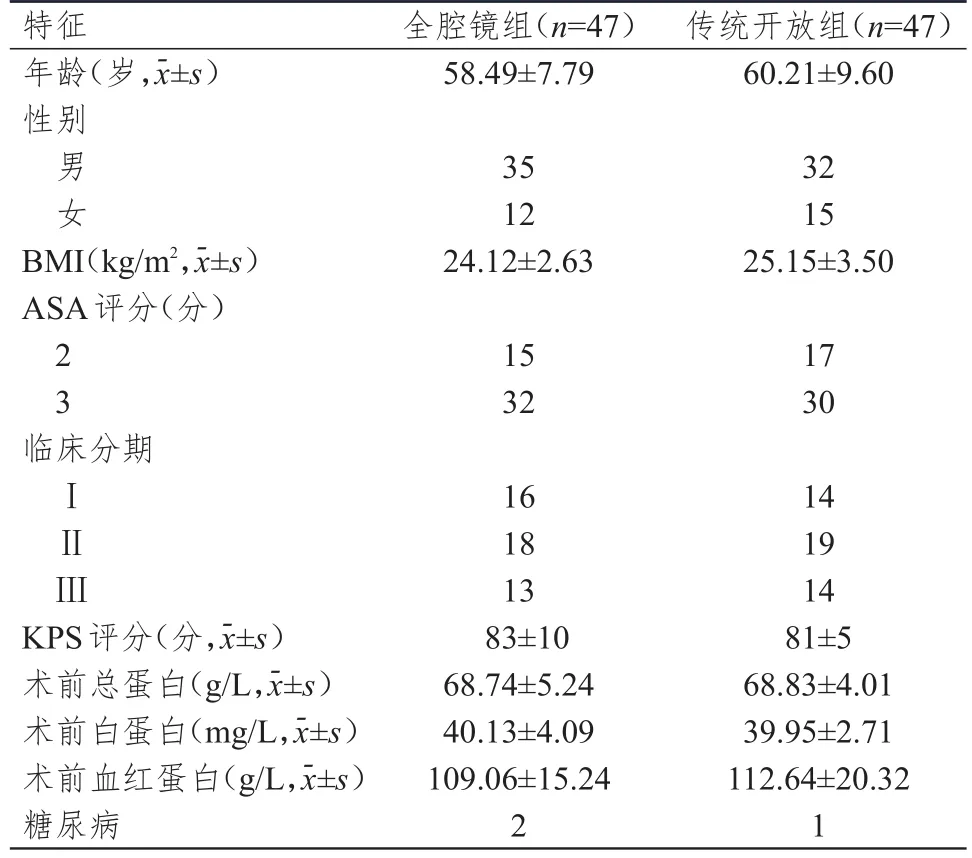
表1 两组患者的一般资料
1.2 手术方法
术前置胃肠减压管,全身(气静复合)麻醉成功后,双腔气管插管。
1.2.1 全腔镜组手术操作所有患者均接受胸腔镜联合腹腔镜手术[9]。胸腔镜手术:患者取左侧90°卧位,左肺单侧通气。于右胸腋前线第3和第5肋间,腋后线第7和第9肋间做约1 cm切口进胸,游离切断奇静脉弓;游离食管,上至胸顶,下至食管裂孔。清扫食管旁、隆突下、气管旁及双侧喉返神经链旁的肿大淋巴结。将胃从扩大的食管裂孔拖入胸腔,制成长度约20 cm、管径约5 cm的管状胃。用管状吻合器吻合后,残端闭合。逐层缝合关闭胸腔。腹腔镜手术:取仰卧位,双肺通气。于脐上缘做10 mm穿刺孔,建立CO2气腹。于左腋前线肋缘下2 cm处穿刺10 cm Trocar作为主操作孔,双侧锁骨中线肋缘下3~4 cm、右腋前线肋缘下2 cm处分别穿刺5 cm Trocar作为操作孔。超声刀游离胃大弯侧,保留胃网膜右动脉,离断大网膜、脾胃韧带、膈食管韧带左前侧部;大弯侧游离完全后将胃向上方翻转托起,沿胰腺上缘解剖腹腔动脉及其3个分支,根部用Hem‐O‐lok分别结扎冠状静脉和胃左动脉;继续向后上解剖结扎胃后动脉、膈下动脉;然后从肝胃韧带开始游离,暴露食管裂孔及左右膈肌脚后,完成膈肌下清扫,直至松解膈食管韧带后部,适当扩大食管裂孔(5 cm),关闭切口。
1.2.2 传统开放组手术操作所有患者均接受食管癌 Ⅰvor‐Lewis手术+胸、腹两野淋巴结清扫[10]。患者先取平卧位,行上腹正中切口游离胃。保留胃网膜右血管弓及胃右血管近端,解离结肠‐大网膜及小网膜,结扎切断胃网膜左、胃短及胃左血管,并同时清扫肝总动脉旁、胃左动脉旁、脾动脉旁及腹腔干动脉旁脂肪淋巴组织。膈肌下切断腹段食管,以机械性切割缝合器制作胃管。腹部手术结束后,患者改左侧卧位,右侧第4或第5肋间切口进胸。结扎切断奇静脉弓,自横膈起至隆突水平沿心包后方,脊柱主动脉前方,两侧胸膜间行食管en‐bloc切除,分别暴露胸段喉返神经全程,清扫双侧气管食管沟淋巴结,并行胃‐食管胸顶吻合。
1.3 观察指标
对比两组患者的围手术期指标(住院时间、术中出血量、手术时间、淋巴结清扫个数、术后下床时间、术后排气时间、胸部和腹部切口长度)和术后指标(术后并发症、局部复发率及远处转移率)。
1.4 随访
术后随访分为3个阶段,术后2年内每3个月随访1次,术后2~5年每半年随访1次,术后5年后每年随访1次。随访内容包括体格检查、血液及生化检验、胸片、腹部B超。患者出院前进行出院宣导,告知其随访复查的重要性,并于复查前取得电话联系提醒到院复查。末次随访时间为2015年12月,中位随访时间为28.2个月。
1.5 统计学方法
采用SPSS 22.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以频数和率(%)表示,组间比较采用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 围手术期指标的比较
全腔镜组患者的住院时间、术后下床时间、术后排气时间明显短于传统开放组,术中出血量明显少于传统开放组,胸部和腹部切口长度明显短于传统开放组,手术时间明显长于传统开放组,差异均有统计学意义(P<0.01)。两组患者的胸部和腹部淋巴结清扫个数比较,差异均无统计学意义(P>0.05)。(表2)
表2 两组患者围手术期指标的比较(± s)
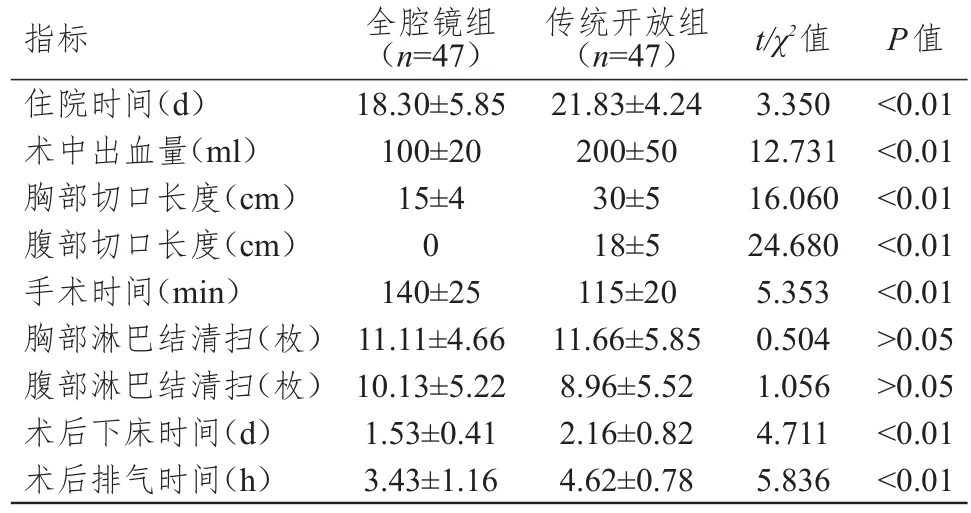
表2 两组患者围手术期指标的比较(± s)
指标住院时间(d)术中出血量(ml)胸部切口长度(cm)腹部切口长度(cm)手术时间(min)胸部淋巴结清扫(枚)腹部淋巴结清扫(枚)术后下床时间(d)术后排气时间(h)全腔镜组(n=47)18.30±5.85 100±20 15±4 0 140±25 11.11±4.66 10.13±5.22 1.53±0.41 3.43±1.16传统开放组(n=47)21.83±4.24 200±50 30±5 18±5 115±20 11.66±5.85 8.96±5.52 2.16±0.82 4.62±0.78 t/χ2值3.350 12.731 16.060 24.680 5.353 0.504 1.056 4.711 5.836 P值<0.01<0.01<0.01<0.01<0.01>0.05>0.05<0.01<0.01
2.2 术后指标的比较
全腔镜组患者肺部感染的发生率为2.13%(1/47),低于传统开放组的17.02%(8/47),差异有统计学意义(P<0.05)。两组患者吻合口瘘、重返ⅠCU、声音嘶哑、胸部切口感染、胃梗阻、胸腔出血发生率比较,差异均无统计学意义(P>0.05)。全腔镜组中,20例患者出现局部复发,复发率为42.55%(20/47),其中10例患者表现为区域淋巴结复发,5例患者表现为吻合口复发,5例患者表现为区域淋巴结并吻合口复发;传统开放组中,17例患者出现局部复发,复发率为36.17%(17/47),其中10例患者表现为区域淋巴结复发,3例患者表现为吻合口复发,4例患者表现为区域淋巴结并吻合口复发。两组患者的局部复发率比较,差异无统计学意义(P>0.05)。全腔镜组中,13例患者出现远处转移,远处转移率为27.66%(13/47);传统开放组中,16例患者出现远处转移,远处转移率为34.04%(16/47)。两组患者的远处转移率比较,差异无统计学意义(P>0.05)。(表3)

表3 两组患者术后指标的比较[ n(%)]
3 讨论
自1992年Cuschieri等[11]首次报道腔镜辅助食管癌手术至今,腔镜辅助食管癌根治术在世界各地广泛开展。临床实践证明,相比于传统开放手术,腔镜手术具有创伤小、术中出血量少、术后恢复速度快的优势[12]。Xie等[13]研究发现,腔镜组食管癌患者肺部并发症、吻合口瘘、乳糜胸、切口感染的发生率均低于传统开放组。Ⅰchikawa等[14]报道,腔镜组食管癌患者的术中失血量、住院时间和ⅠCU住院时间均明显少于或短于传统开放组,其术后镇痛要求少、手术切口小,说明接受腔镜手术食管癌患者的术后恢复及美容效果明显优于接受传统手术的患者。本组研究结果表明,全腔镜组患者的手术创伤小、术中出血量少、术后恢复快,其微创效果明显。
淋巴结清扫是食管癌手术治疗的关键,对患者的生存率具有较大影响[15‐17]。腔镜能提供较好的视野,充分暴露食管及胃周围的组织结构,具有良好的深部照明,使术野得以放大,能更清晰地暴露纵隔及胃周淋巴结,更有利于淋巴结清扫[6,18]。本研究结果表明,腔镜下淋巴结清扫个数与传统开放手术下淋巴结清扫个数比较,差异无统计学意义(P>0.05);术后局部复发率及远处转移率比较,差异均无统计学意义(P>0.05),与Kinjo等[19]的研究结果相似。
国外的队列研究显示,腔镜食管癌根治术患者的5年生存率达到57.8%[14],与开放性食管癌根治术比较,差异无统计学意义(P>0.05);本组5年生存率仍在随访。笔者认为对于临床分期为Ⅰ~Ⅲ期的食管癌,全腔镜食管癌根治术可以达到传统开放手术的肿瘤切除效果及淋巴结清扫率,微创治疗效果明显,值得提倡和临床推广。
在目前的大部分研究中,全腔镜食管癌根治术的手术时间长于传统开放手术[13‐14,20],本研究结果与上述结论一致。这与新技术的应用需要经历一定的学习过程有关[21],也与胸外科医师对腹腔镜的熟悉程度有关[22]。相信随着手术经验的积累、操作水平的提高,胸腔镜手术的手术时间会进一步缩短。
综上所述,全腔镜食管癌根治术作为胸外科领域中的新技术,相对于传统开放手术具有明显的微创优势,尤其是创伤小、并发症少、恢复快等优点已得到广泛认可,可以达到传统开放手术的肿瘤切除效果及淋巴结清扫率,值得临床应用和推广。
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CACancer J Clin,2015,65(2):87‐108.
[2]Herszenyi L,Tulassay Z.Epidemiology of gastrointestinal and liver tumors[J].Eur Rev Med Pharmacol Sci,2010,14(4):249‐258.
[3]Bodner BE.Surgical strategy of extended lymphadenecto‐my for esophageal carcinoma[J].Ann Surg,1993,218(2):213‐214.
[4]Adelstein DJ,Rice TW,Tefft M,et al.Aggressive concur‐rent chemoradiotherapy and surgical resection for proximal esophageal squamous cell carcinoma[J].Cancer,1994,74(6):1680‐1685.
[5]Yasunaga H,Matsuyama Y,Ohe K.Effects of hospital and surgeon case‐volumes on postoperative complications and length of stay after esophagectomy in Japan[J].Surg Today,2009,39(7):566‐571.
[6]Ben‐David K,Rossidis G,Zlotecki RA,et al.Minimally in‐vasive esophagectomy is safe and effective following neo‐adjuvant chemoradiation therapy[J].Ann Surg Oncol,2011,18(12):3324‐3329.
[7]Feng MX,Wang H,Zhang Y,et al.Minimally invasive esophagectomy for esophageal squamous cell carcinoma:a case‐control study of thoracoscope versus mediastinoscope assistance[J].Surg Endosc,2012,26(6):1573‐1578.
[8]Tan Z,Ma G,Zhao J,et al.Ⅰmpact of thoracic recurrent la‐ryngeal node dissection:508 patients with tri‐incisional esophagectomy[J].J Gastrointest Surg,2014,18(1):187‐193.
[9]朱坤寿,王枫,张德荣,等.腹腔镜联合胸腔镜辅助小切口食管癌根治术的临床应用[J].腹腔镜外科杂志,2010,15(12):909‐912.
[10]马龙飞,相加庆,李鹤成.Ⅰvor‐Lewis手术治疗食管癌的近期临床疗效分析[J].中华医学杂志,2012,92(23):1618‐1620.
[11]Cuschieri A,Shimi S,Banting S.Endoscopic oesophagec‐tomy through a right thoracoscopic approach[J].J R Coll Surg Edinb,1992,37(1):7‐11.
[12]Tapias LF,Mathisen DJ,Wright CD,et al.Outcomes with open and minimally invasiveⅠvor Lewis esophagectomy after neoadjuvant therapy[J].Ann Thorac Surg,2016,101(3):1097‐1103.
[13]Xie MR,Liu CQ,Guo MF,et al.Short‐term outcomes of minimally invasiveⅠvor‐Lewis esophagectomy for esopha‐geal cancer[J].Ann Thorac Surg,2014,97(5):1721‐1727.
[14]Ⅰchikawa H,Miyata G,Miyazaki S,et al.Esophagectomy using a thoracoscopic approach with an open laparotomic or hand‐assisted laparoscopic abdominal stage for esopha‐geal cancer:analysis of survival and prognostic factors in 315 patients[J].Ann Surg,2013,257(5):873‐885.
[15]Zhu Z,Chen H,Yu W,et al.Number of negative lymph nodes is associated with survival in thoracic esophageal squamous cell carcinoma patients undergoing three‐field lymphadenectomy[J].Ann Surg Oncol,2014,21(9):2857‐2863.
[16]Xu F,Wang C,Qi L,et al.Does the extent of lymph nodes dissection affect the prognosis of resected stageⅠA non‐small cell lung cancer?[J].Clin Transl Oncol,2014,16(1):77‐84.
[17]Baba M,Aikou T,Yoshinaka H,et al.Long‐term results of subtotal esophagectomy with three‐field lymphadenecto‐my for carcinoma of the thoracic esophagus[J].Ann Surg,1994,219(3):310‐316.
[18]Noshiro H,Ⅰwasaki H,Kobayashi K,et al.Lymphadenec‐tomy along the left recurrent laryngeal nerve by a minimal‐ly invasive esophagectomy in the prone position for tho‐racic esophageal cancer[J].Surg Endosc,2010,24(12):2965‐2973.
[19]Kinjo Y,Kurita N,Nakamura F,et al.Effectiveness of combined thoracoscopic‐laparoscopicesophagectomy:comparison of postoperative complications and midterm oncological outcomes in patients with esophageal cancer[J].Surg Endosc,2012,26(2):381‐390.
[20]Hsu PK,Huang CS,Wu YC,et al.Open versus thoraco‐scopic esophagectomy in patients with esophageal squa‐mous cell carcinoma[J].World J Surg,2014,38(2):402‐409.
[21]Xie X,Fu JH,Wang JY,et al.Analysis of learning process of video‐assisted minimally invasive esophagectomy for thoracic esophageal carcinoma[J].Zhonghua Wei Chang Wai Ke Za Zhi,2012,15(9):918‐921.
[22]Song SY,Na KJ,Oh SG,et al.Learning curves of mini‐mally invasive esophageal cancer surgery[J].Eur J Cardio‐thorac Surg,2009,35(4):689‐693.
