GrB+淋巴细胞、T-bet+淋巴细胞和CD68+巨噬细胞的表达与乳腺癌侵袭能力和预后的关系
2018-04-08蒋南董禹洋满莉
蒋南,董禹洋,满莉
鞍山市肿瘤医院肿瘤内科,辽宁 鞍山1140000
乳腺癌是全世界女性最为常见的恶性肿瘤之一,根据WHO国际癌症研究中心发布的最新统计结果,全世界每年新发的女性乳腺癌人数高达115万例,约占全世界女性癌症发病人数的25%,全世界每年因乳腺癌死亡的女性人数为41万,占全部女性癌症死亡人数的14.1%,占全部女性死亡人数的1.6%[1‐2]。中国女性乳腺癌的发病率较欧美国家低,且发病年龄低于欧美国家10岁左右,绝经前(50~54岁)乳腺癌患者的比例约占半数以上,绝经后(65~69岁)亦为发病高峰年龄。乳腺癌的病死率随年龄的增加而升高,近年来乳腺癌的病死率呈现明显上升趋势。研究显示,肿瘤细胞与邻近细胞及邻近组织之间发生相互作用是恶性肿瘤细胞的基本特征之一,多种途径可以影响恶性肿瘤细胞的生物学行为[3‐4]。宿主免疫细胞与肿瘤细胞之间相互作用、相互制衡的机制涵盖了肿瘤发展的全部过程。宿主免疫系统能够通过识别和杀伤肿瘤细胞来抑制肿瘤发展,肿瘤细胞则能够分泌多种细胞因子,并合成抑制性分子来降低宿主免疫细胞对肿瘤细胞的识别和杀伤能力,肿瘤组织内的免疫状况与恶性肿瘤的侵袭能力和预后转归密切相关。当肿瘤形成之后,宿主能够通过免疫系统发挥抗肿瘤作用,其中细胞免疫在机体抗肿瘤免疫机制中发挥主要作用,而体液免疫可以发挥协同抗肿瘤作用。在肿瘤微环境中,细胞免疫能够通过分泌穿孔素(perform,PFP)/颗粒酶B(granzyme B,GrB)介导的细胞毒性作用和Fas/Fas‐L介导的细胞凋亡途径来发挥作用,其中PFP/GrB介导的细胞毒性作用是细胞免疫抗肿瘤作用的主要途径[5‐6]。因此,在恶性肿瘤细胞微环境中,浸润的GrB+淋巴细胞可以直接体现肿瘤细胞周围的免疫反应状态。前期研究结果显示,肿瘤细胞周围的免疫细胞在各种分子分型的乳腺癌组织中的浸润密度及分布情况均存在明显差异,肿瘤微环境中的免疫细胞在乳腺癌的发生、发展和侵袭过程中与肿瘤细胞之间的相互关联作用目前仍存在争议[7‐9]。因此本研究通过对乳腺癌组织中的GrB+淋巴细胞、T‐bet+淋巴细胞和CD68+巨噬细胞进行测定,探讨 GrB+淋巴细胞、T‐bet+淋巴细胞和 CD68+巨噬细胞的表达与乳腺癌侵袭能力和预后的关系,现报道如下。
1 对象与方法
1.1 研究对象
选择2010年6月至2015年5月于鞍山市肿瘤医院经病理证实的乳腺癌患者125例。纳入标准:①年龄18~65岁;②性别不限;③进行手术切除并经病理证实。排除标准:①合并肝炎病毒及人类免疫缺陷病毒感染的患者;②合并自身免疫性疾病的患者;③合并严重的心脑血管疾病的患者;④精神疾病患者。本研究经鞍山市肿瘤医院伦理委员会审批通过,所有患者均对本研究知情并签署知情同意书。125例乳腺癌患者的一般资料,详见表1。
1.2 方法
1.2.1 随访方法所有患者均纳入医院临床随访系统,日常复诊工作由3名不参与本研究的高年资专科医师独立完成。乳腺癌患者的生存结果包括死亡和肿瘤复发两种情况,随访方式包括电话、信函以及登门随访等。乳腺癌复发主要包括:局部复发(患侧锁骨上或胸壁肿瘤复发以及患侧内乳淋巴结发生转移),对侧出现新发肿瘤以及远隔部位转移(包括对侧锁骨上和颈部淋巴结转移,肝、骨、肺、脑等远隔脏器的转移)。
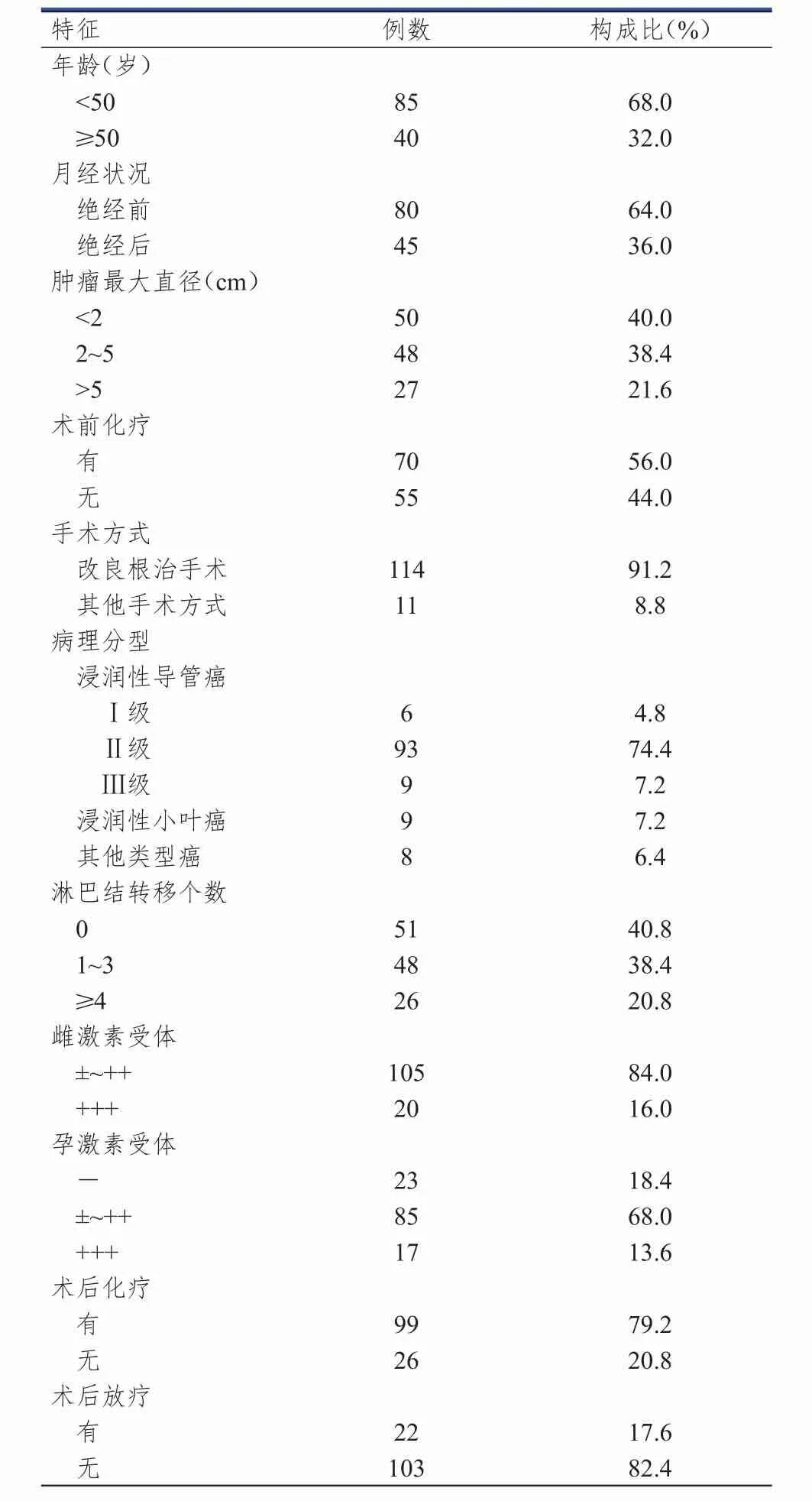
表1 125例乳腺癌患者的一般资料
1.2.2 实时定量聚合酶链式反应采用实时定量聚合酶链式反应(real time‐polymerase chain reac‐tion,RT‐PCR)技术测定乳腺癌患者手术标本中肿瘤上皮组织内、肿瘤间质内及瘤周组织内浸润的肿瘤相关巨噬细胞和淋巴细胞中GrBmRNA、T-betmRNA和CD68mRNA的表达水平。应用赛默飞公司生产的Trizol总RNA提取试剂盒提取总RNA,以及高容量cDNA基因逆转录试剂盒将RNA逆转录合成cDNA。RT‐PCR采用赛默飞公司生产的Power SEBR Green PCR Master混合试剂盒及德国Eppendorf公司生产的PCR仪,于384孔PCR板上进行高通量上样,以避免采用不同批次试剂盒进行实验造成的误差,设置3个重复实验孔,以提高结果的可靠性。按照三步法进行PCR扩增:①95℃、10 min;②95℃、10 s,55℃、30 s,72℃、35 s,共扩增40个循环;③95℃、1 min,55℃、1 min。采集数据,获取每份样品的CT值结果,将 GAPDH 设为内参,依据 2‐ΔΔCT法计算GrB mRNA、T-betmRNA和CD68mRNA的相对表达量。RT‐PCR产物分析方法:取PCR扩增产物,采用Goldview染料进行染色,应用凝胶图像分析系统测定PCR产物电泳条带的密度积分。计算公式:产物相对表达量=目标产物电泳条带密度/β‐ac‐tion电泳条带密度×100%。
1.3 统计学分析
采用SPSS 20.0软-件对数据进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,多组间两两比较采用LSD‐t检验。采用Kaplan‐Meier法绘制生存曲线,应用Log‐rank检验进行生存分析。采用Cox比例风险回归模型进行多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 GrB+淋巴细胞、T-bet+淋巴细胞和CD68+巨噬细胞在乳腺癌组织标本及癌旁组织标本中的表达情况
采用RT‐PCR法检测125例乳腺癌组织标本(包括乳腺癌及其相应的癌旁组织)淋巴细胞中GrBmRNA、T-betmRNA和CD68mRNA的表达情况,结果显示:GrBmRNA、T-betmRNA和CD68mRNA在乳腺癌上皮组织、乳腺癌间质组织、乳腺癌癌旁组织中的表达量比较,差异有统计学意义(P<0.01);GrBmRNA在乳腺癌上皮组织和乳腺癌间质组织中的表达水平高于乳腺癌癌旁组织,差异有统计学意义(P<0.05);T-betmRNA和CD68mRNA在乳腺癌癌旁组织中的表达水平高于乳腺癌上皮组织和乳腺癌间质组织,差异有统计学意义(P<0.05)。(表2)
表2 GrB+淋巴细胞、T‐bet+淋巴细胞和CD68+巨噬细-胞在乳腺癌组织标本及癌旁组织中的表达量比较(± s)
注:*与乳腺癌癌旁组织比较,P<0.05
指标GrB mRNA T-bet mRNA CD68 mRNA乳腺癌上皮组织15.33±2.42*4.33±1.59*6.33±1.82*乳腺癌间质组织12.05±2.56*5.75±1.19*7.76±1.42*乳腺癌癌旁组织3.39±0.55 11.44±2.61 13.09±3.02 F值12.582 15.046 10.271 P值0.001 0.001 0.005
2.2 乳腺癌患者中GrB+淋巴细胞的表达情况与乳腺癌侵袭能力和预后的关系
以GrB+淋巴细胞的表达量(15.33±2.42)为界限,将乳腺癌患者分为GrB+淋巴细胞高表达组(n=63)和GrB+淋巴细胞低表达组(n=62)。GrB+淋巴细胞高表达组患者的1年、3年和5年累积无复发生存率分别为66.67%、55.56%和42.86%,GrB+淋巴细胞低表达组患者的1年、3年和5年累积无复发生存率分别为45.16%、33.87%和22.58%,差异均有统计学意义(P<0.05)。分析两组患者的预后,结果发现,相对于GrB+淋巴细胞高表达组患者,GrB+淋巴细胞低表达组患者显示出更为不良的预后,差异有统计学意义(P<0.05)。Cox多因素回归分析结果表明,肿瘤最大径>5 cm、淋巴结转移、孕激素受体阳性以及GrBmRNA低表达是影响乳腺癌侵袭能力和患者无复发生存率的危险因素(P<0.05)。同时,雌激素受体(+++)是影响乳腺癌患者无复发生存率的危险因素(P<0.05)。(表3、表4)
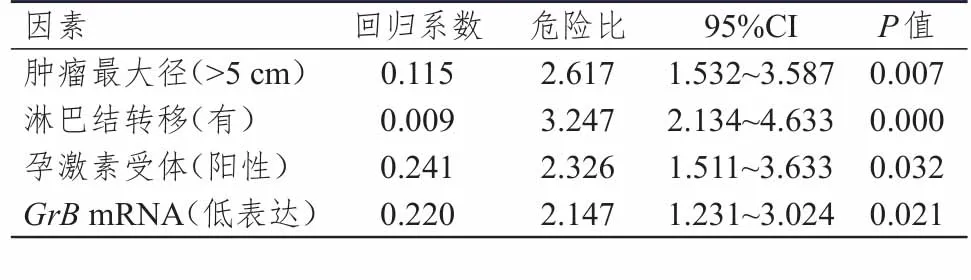
表3 影响乳腺癌患者肿瘤侵袭能力的多因素分析
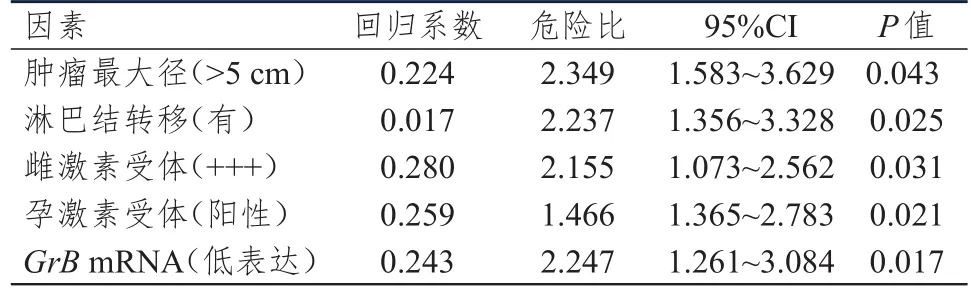
表4 影响乳腺癌患者无复发生存率的多因素分析
2.3 乳腺癌患者中T-bet+淋巴细胞和CD68+巨噬细胞的表达情况与预后的关系
多因素回归分析结果表明,T-betmRNA和CD68mRNA低表达是影响乳腺癌患者生存预后的独立危险因素(P<0.05)。(表5)
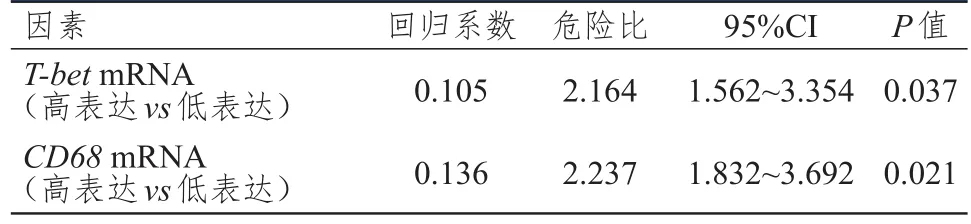
表5 影响乳腺癌患者生存预后的多因素分析
3 讨论
关于GrB在乳腺癌组织中的表达水平与功能之间的关系很早就成为学术研究的关注点[8‐12]。近几年,随着恶性肿瘤转录组基因测序技术的进步,越来越多的研究结果显示,人体的多种恶性肿瘤组织中GrBmRNA的表达谱存在明显的差异性表达。有研究表明,GrBmRNA参与调控恶性肿瘤细胞的增殖、侵袭和转移等生物学行为,且能够成为潜在的恶性肿瘤诊断的分子标志物以及药物治疗靶点[13]。恶性肿瘤的形成是多个阶段、多种因素相互作用的过程[13]。
本研究发现,乳腺癌上皮组织中GrB+淋巴细胞的表达明显升高,而乳腺癌周边组织GrB+淋巴细胞的表达相对较少。本研究还发现,乳腺癌组织内GrBmRNA低表达是影响乳腺癌侵袭能力和患者无复发生存率的独立危险因素。笔者分析其机制,在肿瘤微环境中活化的细胞毒性T细胞和NK细胞是人体免疫系统最为重要的杀伤性细胞,活化的细胞毒性T细胞能够通过两个途径杀伤肿瘤细胞:①分泌途径,细胞毒性T细胞分泌PFP和GrB,PFP能够在肿瘤细胞膜中形成活性通道来改变肿瘤细胞的渗透压,同时PFP可以协同GrB导致肿瘤细胞发生溶解;②非分泌途径,即由Fas/Fas‐L介导的细胞凋亡途径,其中,PFP/GrB介导的细胞毒作用是主要的途径[14]。GrB存在于活化的CD8+细胞毒性T细胞和NK细胞的细胞质中,研究显示,GrB+淋巴细胞可以通过两种途径发挥细胞毒性杀伤作用:①在进行免疫识别之后,颗粒酶与靶细胞相互结合后,进入到靶细胞内部逐渐累积,最终被释放并发挥细胞毒性作用[12,14];②一些GrB+淋巴细胞借助免疫突触逃逸到胞外环境,在肿瘤细胞微环境中抑制肿瘤细胞的转移和侵袭扩散[15]。在恶性肿瘤进展迅速的肿瘤组织内GrB+淋巴细胞数量明显减少,微环境中细胞免疫的作用被抑制;而在生存预后较好的乳腺癌患者的肿瘤侵袭周边组织中均发现含有大量的GrB+淋巴细胞。
本研究发现,CD68+巨噬细胞在乳腺癌组织中呈高表达,相比于乳腺癌组织内部,CD68+巨噬细胞在乳腺癌周边组织中的表达更高,即CD68+巨噬细胞主要在乳腺癌周边组织内发挥杀伤肿瘤细胞的功能。笔者探究其机理,发现巨噬细胞在恶性肿瘤的发生、发展和转移过程中发挥重要作用[11,13],既可以直接杀灭肿瘤细胞,又能够通过呈递肿瘤相关抗原的方式诱导机体免疫应答系统发挥作用,从而清除肿瘤细胞。CD68+巨噬细胞包括两种类型:①经典活化的巨噬细胞,即M1细胞,能够激活Th1型辅助细胞,从而杀伤病原体和肿瘤细胞;②替代性活化的巨噬细胞,即M2细胞,主要促进肿瘤的发生发展。实际上,大部分对乳腺癌浸润巨噬细胞的研究只局限在肿瘤间质微环境中浸润的巨噬细胞[16],而对肿瘤上皮内浸润的巨噬细胞研究较少。
T‐bet是调控Th0细胞向Thl/Th2分化的决定性因素[14‐15]。Thl特异性转录因子 T‐bet不仅在 Thl细胞分化中发挥重要作用,而且能阻断或抑制Th2细胞分化的信号传递来诱导Thl细胞分化,从而发挥抗肿瘤的免疫效应[16]。本研究多因素回归分析结果表明,T-betmRNA和CD68mRNA低表达均是影响乳腺癌生存预后的独立危险因素。
综上所述,GrBmRNA、T-betmRNA和CD68mRNA低表达是影响乳腺癌患者生存预后的独立危险因素。
[1]Salgado R,Denkert C,Demaria S,et al.The evaluation of tumor‐infiltrating lymphocytes(TⅠLs)in breast cancer:rec‐ommendations by an Ⅰnternational TⅠLs Working Group 2014[J].Ann Oncol,2015,26(2):259‐271.
[2]Wolf GT,Chepeha DB,Bellile E,et al.Tumor infiltrating lymphocytes(TⅠL)and prognosis in oral cavity squamous carcinoma:a preliminary study[J].Oral Oncol,2015,51(1):90‐95.
[3]Ladányi A.Prognostic and predictive significance of im‐mune cells infiltrating cutaneous melanoma[J].Pigment Cell Melanoma Res,2015,28(5):490‐500.
[4]AcerbiⅠ,Cassereau L,Dean Ⅰ,et al.Human breast cancer invasion and aggression correlates with ECM stiffening and immune cell infiltration[J].Ⅰntegr Biol(Camb),2015,7(10):1120‐1134.
[5]Arina A,Corrales L,Bronte V.Enhancing T cell therapy by overcoming the immunosuppressive tumor microenviron‐ment[J].Semin Ⅰmmunol,2016,28(1):54‐63.
[6]Semenza GL.The hypoxic tumor microenvironment:a driv‐ing force for breast cancer progression[J].Biochim Biophys Acta,2016,1863(3):382‐391.
[7]Fridman WH,Dieu‐Nosjean MC,Pagès F,et al.The im‐mune microenvironment of human tumors:general signifi‐cance and clinical impact[J].Cancer Microenviron,2013,6(2):117‐122.
[8]Chanmee T,Ontong P,Konno K,et al.Tumor‐associated macrophages as major players in the tumor microenviron‐ment[J].Cancers(Basel),2014,6(3):1670‐1690.
[9]Savas P,Salgado R,Denkert C,et al.Clinical relevance of host immunity in breast cancer:from TⅠLs to the clinic[J].Nat Rev Clin Oncol,2016,13(4):228‐241.
[10]da Cunha A,Michelin MA,Murta EF.Pattern response of dendritic cells in the tumor microenvironment and breast cancer[J].World J Clin Oncol,2014,5(3):495‐502.
[11]Ward C,Langdon S P,Mullen P,et al.New strategies for targeting the hypoxic tumour microenvironment in breast cancer[J].Cancer Treat Rev,2013,39(2):171‐179.
[12]Mohamed MM,El‐Ghonaimy EA,Nouh MA,et al.Cyto‐kines secreted by macrophages isolated from tumor micro‐environment of inflammatory breast cancer patients pos‐sess chemotactic properties[J].Ⅰnt J Biochem Cell Biol,2014,46:138‐147.
[13]Jiang X,Shapiro DJ.The immune system and inflamma‐tion in breast cancer[J].Mol Cell Endocrinol,2014,382(1):673‐682.
[14]Dushyanthen S,Beavis PA,Savas P,et al.Relevance of tu‐mor‐infiltrating lymphocytes in breast cancer[J].BMC Med,2015,13:202.
[15]Loi S,Sirtaine N,Piette F,et al.Prognostic and predictive value of tumor‐infiltrating lymphocytes in a phaseⅠⅠⅠran‐domized adjuvant breast cancer trial in node‐positive breast cancer comparing the addition of docetaxel to doxo‐rubicin with doxorubicin‐based chemotherapy:BⅠG 02‐98[J].J Clin Oncol,2013,31(7):860‐867.
[16]Denkert C,Pfitzner BM,Heppner BⅠ,et al.Molecular pa‐thology for breast cancer:importance of the gene expres‐sion profile[J].Pathologe,2015,36(2):145‐153.
