肺癌骨转移患者CaN、PTHRP的水平变化及诊断价值探讨
2018-04-08马智中李红艺
马智中,李红艺
新郑市人民医院骨科,河南 新郑4511500
肺癌是临床常见的原发性恶性肿瘤,有较高的发病率和病死率。近年来,随着环境污染的加剧,肺癌的发病率逐年增加。由于肺癌早期缺乏特异性症状,多数患者在确诊时已达到肺癌晚期或肺癌转移至其他脏器,其中骨转移是最常见的类型,提示预后不良。早期诊断、早期治疗对延长生存时间和改善生存质量有益[1]。
目前,临床诊断骨转移的方法主要为影像学检查,但影像学检查价格高,且仅在骨质破坏到一定程度方可显像,确诊时患者的骨质破坏已经非常严重;因此,寻找特异度和灵敏度较好的检测指标,一直是临床工作和研究的热点[2]。本研究探讨了检测血清钙调磷酸酶(calcineurin,CaN)和甲状旁腺激素相关蛋白(parathyroid hormone related protein,PTHRP)对早期诊断肺癌骨转移的临床价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2010年1月至2016年12月新郑市人民医院确诊的79例肺癌骨转移患者(转移组)和90例肺癌未发生骨转移患者(无转移组)的病历资料。纳入标准:①肺癌患者均经过病理学检查证实。②肺癌骨转移满足以下三点中任何一点,外科手术后活检证实肺癌骨转移;发射计算机断层显像(emission computed tomography,ECT)检查证实3处以上部位出现异常,伴有骨转移症状并得到其他影像学检查证实;X线、CT和MRⅠ证实为骨转移肿瘤。③患者年龄≤79岁。④所有纳入对象均未接受放化疗。排除标准:①合并其他部位恶性肿瘤;②接受放化疗、免疫治疗的患者;③入组前伴有外伤性骨折;④伴有骨代谢性疾病;⑤血糖未得到控制的糖尿病患者。转移组79例患者中,男45例,女34例;年龄为51~79岁,平均为(63.9±9.2)岁。无转移组90例患者中,男54例,女36例;年龄为45~79岁,平均为(61.0±13.5)岁。两组患者的年龄、性别、体力活动状态(performance status,PS)评分、病理类型比较,差异均无统计学意义(P>0.05);两组患者的TNM分期比较,差异有统计学意义(P<0.05),详见表1。

表1 两组患者的一般资料比较
1.2 检测方法
抽取研究对象空腹静脉血5 ml,静置20 min,4℃下以3000 r/min的速度离心10 min,取上层血清冻存于‐70℃冰箱。采用酶联免疫吸附法(en‐zyme linked immunosorbent assay,ELⅠSA)检测标本中CaN、PTHRP、癌胚抗原(carcinoembryonic anti‐gen,CEA)、CA125和骨碱性磷酸酶(bone alkaline phosphatase,BALP)的含量(试剂盒均购于美国R&D公司)。检测仪器为瑞士SUNRⅠSE酶标仪,检测波长为450 nm(购于中国北京世贸远东科学仪器有限公司)。
1.3 统计学方法
采用SPSS 16.0统计软件分析数据,计量资料以均数±标准差(±s)表示,两组间比较采用t检验;计数资料以率(%)表示,两组间比较采用χ2检验;绘制ROC曲线,分析最佳诊断临界值及对应的灵敏度、特异度、漏诊率、误诊率,其中漏诊率=1-灵敏度,误诊率=1-特异度。P<0.05为差异有统计学意义。
2 结果
2.1 血清CaN、PTHRP、CEA、CA125、BALP水平
转移组患者的血清CaN、PTHRP、CEA、CA125、BALP水平均明显高于无转移组,差异有统计学意义(P<0.01)。(表2)
表2 两组患者血清CaN、PTHRP、CEA、CA125、BALP水平比较(± s)

表2 两组患者血清CaN、PTHRP、CEA、CA125、BALP水平比较(± s)
组别转移组(n=79)无转移组(n=90)t值P值CaN(U/ml)680.9±309.1 298.7±159.0 10.285<0.01 PTHRP(ng/ml)8.05±5.21 4.31±2.90 5.856<0.01 CEA(pg/L)17.63±5.59 13.04±4.92 5.678<0.01 CA125(Ku/L)104.2±37.8 69.8±29.1 6.671<0.01 BALP(U/L)664.1±169.8 481.8±133.0 7.815<0.01
2.2 血清CaN、PTHRP与CEA、CA125、BALP的相关性
转移组患者的血清CaN、PTHRP与CEA、CA125、BALP水平均呈显著正相关(P<0.01)。(表3)

表3 转移组患者血清CaN、PTHRP与CEA、CA125、BALP的相关性分析
2.3 血清CaN、PTHRP检测诊断肺癌骨转移的ROC曲线图
绘制ROC曲线,当选取CaN=590.4 U/ml为诊断临界点时,鉴别诊断肺癌骨转移的灵敏度为78.2%,特异度为84.0%,漏诊率为21.8%,误诊率为16.0%,ROC曲线下面积为 0.872(95%CⅠ:0.821~0.946);当选取PTHRP=6.81 ng/ml为诊断临界点时,鉴别诊断肺癌骨转移的灵敏度为70.4%,特异度为78.5%,漏诊率为29.6%,误诊率为21.5%,ROC曲线下面积为 0.811(95%CⅠ:0.785~0.863)。(图1)
3 讨论
近年来,环境污染日益加剧,肺癌的发病率和病死率逐年增加,已居于中国恶性肿瘤之首。肺癌早期临床症状不典型,大多数患者确诊时已为晚期[3]。尽管目前临床治疗肺癌的方法较多,手术治疗、化疗、放疗、靶向治疗和中药治疗等方法的综合运用,使晚期肺癌患者的生存时间延长,但其2年生存率仍然处于较低水平,这与肺癌的远处转移有密切的关系[4]。
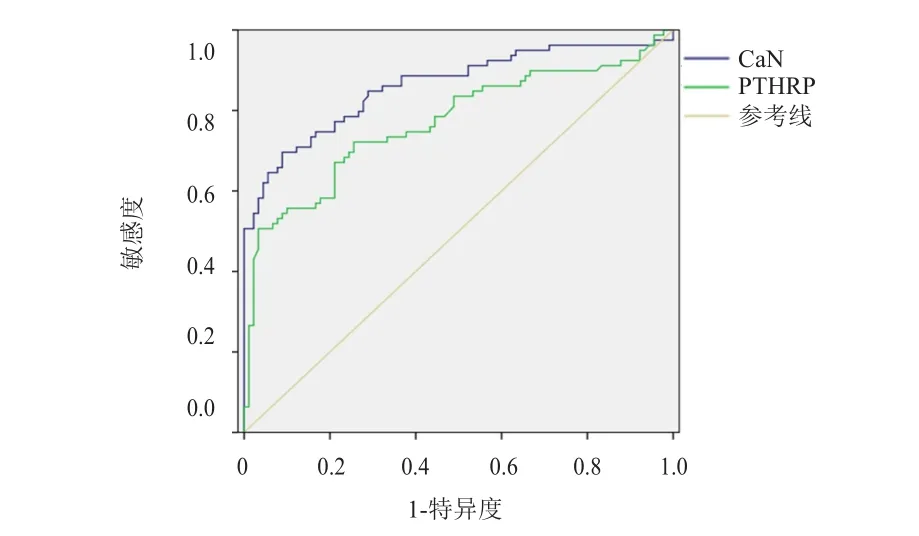
图1 血清CaN、PTHRP检测诊断肺癌骨转移的ROC曲线图
肿瘤细胞转移至骨骼时,分泌多种细胞因子,破坏破骨细胞和成骨细胞的动态平衡,破坏骨的微环境。骨组织受到破坏后,释放大量的活性物质,促进肿瘤细胞增殖,并在骨组织局部形成转移灶[5]。肿瘤的骨转移分为溶骨性骨转移、成骨性骨转移和混合性骨转移3种类型[6]。肺癌骨转移以溶骨性骨转移为主,可引起剧烈疼痛、病理性骨折和高钙血症,严重影响患者的生存时间和生存质量[7]。
目前,临床对肺癌骨转移的诊断主要依靠影像学检查,但在骨转移发生早期,骨质破坏不明显,同时肺癌患者可能存在骨质疾病,增加了肺癌骨转移的影像学诊断难度[8]。单纯依靠影像学检查对肺癌骨转移进行早期诊断,效果不理想。越来越多的学者倾向于采用实验室血清指标辅助诊断,早期发现肺癌骨转移,早期做出干预措施[9]。
CEA是目前临床最常用的肿瘤标志物,正常情况下血清CEA含量极微。恶性肿瘤患者细胞基因受损后,血液中CEA激增[10]。CA125是卵巢癌的特异性标志物,肺癌患者的血清CA125水平也会有所升高[11]。BALP是血清碱性磷酸酶的同工酶,由成骨细胞合成。当骨内磷酸钙大量沉积时,BALP水平升高,反映骨代谢异常,具有较高的灵敏度[12]。本研究中转移组患者的血清CEA、CA125、BALP水平明显高于无转移组。但有研究表明,其他骨代谢疾病均可引起BALP水平的升高[12],故将BALP作为肺癌骨转移的特异性指标,存在一定的差异。因此,联合其他新的灵敏度、特异度均较好的指标检测,对改善肺癌骨转移患者的预后有重要的意义。CaN是一种丝氨酸/苏氨酸蛋白磷酸酶,在人体内分布广泛,在淋巴细胞、神经组织、心脏和骨骼肌中的含量较高。CaN被钙离子活化后可激活T细胞核因子信号传导通路,参与多种基因的活化[13]。有研究发现,在肿瘤组织中CaN表达升高,与病理分型、分化级别等有关。CaN可调节破骨细胞基因的关键转录因子NFATC1的活化,在破骨细胞的分化中有重要的作用,推测其在肺癌骨转移患者体内的表达处于较高水平[14]。本研究中转移组患者的血清CaN水平明显高于无转移组,这个结果证实了上述推测。PTHRP是一种分泌蛋白,其生物学特性与甲状旁腺激素类似,在大多数的非小细胞肺癌患者体内高表达,预示患者发生转移和死亡的风险较高。有研究证实,PTHRP与肿瘤溶骨性骨转移有密切的关系,PTHRP阳性者更易发生骨转移[15]。本研究结果也充分证实了这一点。这可能是由于肺癌细胞分泌PTHRP后与成骨细胞表面相应受体结合,促进破骨细胞的分化成熟,最终导致溶骨性骨破坏有关。本研究发现,转移组患者的血清CaN、PTHRP与CEA、CA125、BALP水平均呈显著正相关,对血清CaN、PTHRP在肺癌骨转移诊断中的临界点进行探索时发现,当选取CaN=590.4 U/ml、PTHRP=6.81 ng/ml为诊断临界点时,肺癌骨转移的诊断有良好的特异度和灵敏度。综上所述,肺癌骨转移患者的血清CaN和PTHRP水平升高明显,对肺癌骨转移有一定的鉴别诊断价值。
[1]孙燕,管忠震,廖美琳,等.肺癌骨转移诊疗专家共识(2014版)[J].中国肺癌杂志,2014,17(2):57‐72.
[2]陈申,马锐.肺癌骨转移的诊断进展[J].医学与哲学,2014,35(7):51‐54.
[3]吴京,谢惠英,蔡梦洁,等.肺癌骨转移患者6项骨代谢指标的变化[J].检验医学,2016,31(10):904‐906.
[4]郝艳萍,吴俊,艾风波.CA19‐9、CA125、CEA 和 CY‐FRA21‐1检测对肺腺癌患者骨转移的诊断价值分析[J].标记免疫分析与临床,2016,23(12):1372‐1374;1398.
[5]刘洋,贺贵福,赵义,等.SPECT/CT联合CEA、Cyfra‐211、NSE诊断肺癌骨转移的价值[J].中国老年学杂志,2015,12(24):7081‐7083.
[6]潘兴喜,杨文,杨画,等.肺癌骨转移患者放疗前后血清β‐CTX和PⅠNP水平变化及其与疗效的关系[J].山东医药,2015,55(8):31‐33.
[7]叶骉飞,郑平菊,张妮,等.肺癌骨转移临床特征及预后相关因素[J].实用医学杂志,2016,32(10):1656‐1659.
[8]Johnson RW,Merkel AR,Page JM,et al.Wnt signaling in‐duces gene expression of factors associated with bone de‐struction in lung and breast cancer[J].Clin Exp Metastasis,2014,31(8):945‐959.
[9]李春雨,杨德鸿,孟越,等.甲状旁腺激素(1‐34)对小鼠肺癌骨转移瘤生长的影响[J].南方医科大学学报,2014,34(9):1295‐1300.
[10]王东来,李雅琪,常颖.肺癌骨转移分子机制研究进展[J].实用医学杂志,2014,30(10):1672‐1674.
[11]刘桂玲,马仁龙,万仁明,等.肿瘤及骨转换生化标志物联合检测对肺癌骨转移的诊断价值[J].中华核医学与分子影像杂志,2015,35(1):63‐64.
[12]李殿波,姜格宁.肺肿瘤标志物及碱性磷酸酶对肺癌骨转移早期诊断的临床意义[J].医学综述,2015,21(8):1487‐1488.
[13]王胜,张诗民,李珍珍,等.程序性死亡分子1/程序性死亡分子1配体信号通路在肺癌细胞株上的表达及其生物学意义[J].中华实验外科杂志,2016,33(8):1893‐1896.
[14]刘慧,李永怀,桂淑玉.肺癌患者血清肿瘤标记物检测的临床意义及预后评估[J].临床肺科杂志,2014,19(12):2219‐2223.
[15]Wu CE,Wang CW,Huang WK,et al.Cytoplasmic and nu‐clear parathyroid hormone‐related proteins are opposing prognostic factors in patients with non‐small‐cell lung can‐cer who have undergone curative resection[J].Jpn J Clin Oncol,2015,45(3):267‐273.
