Snail转录因子与ER- α36介导的雌激素信号在胃癌肿瘤细胞成球作用中的研究
2018-04-08朱勇朱媛鲁正学李伟
朱勇,朱媛,鲁正学,李伟
重庆市长寿区人民医院肿瘤科,重庆4012200
胃癌在中国是最常见的恶性肿瘤之一,并且绝大多数的胃癌患者在确诊时病情已进展到中晚期,常发生腹膜、肝脏、淋巴结转移,胃癌患者的5年生存期较短,预后较差[1]。随着对胃癌的发生、发展、侵袭及转移的深入研究,发现胃癌肿瘤组织内存在数量不多的恶性细胞亚群,即肿瘤干细胞。肿瘤干细胞在肿瘤形成、侵袭、转移中的作用机制和如何靶向治疗特异性肿瘤干细胞已成为目前研究的热点[2]。目前证实了人胃癌组织中也含有肿瘤干细胞,此外,在多株体外培养的人胃癌细胞系内也得到进一步的证实,有少量具有干细胞样特性的胃癌肿瘤干细胞的存在,并且,有关胃癌肿瘤干细胞方面的研究也取得了一定的进展[3‐4]。Snail可通过多种途径促使上皮‐间质转化(epithelial‐mesenchymal transition,EMT),在许多肿瘤组织中呈中高表达,被视为肿瘤侵袭转移的促进因素。另外,异常表达的Snail不仅可以有效地介导细胞存活,并使其获得干细胞样特性,还可以诱导肿瘤干细胞的存在。而雌激素受体(estrogen receptor,ER)的缺失与Snail高表达相关联,即ER‐α36介导的雌激素信号能促进SGC7901细胞的增殖与侵袭,ER‐α36介导的雌激素信号途径可能通过Snail作用于胃癌肿瘤干细胞[5‐7]。Snail蛋白作为参与EMT过程的重要分子,其在胃癌肿瘤干细胞形成过程中的作用及机制有待进一步深入研究。
实验细胞系:空载体转染的人胃癌细胞系SGC7901(由复旦大学医学院免疫学教研室馈赠),本实验室构建的稳定高表达ER‐α36的SGC7901细胞株High36、稳定沉默ER‐α36的SGC7901细胞株Low36。
实验试剂:胰蛋白酶购自美国Sigma公司,青霉素‐链霉素和谷氨酰胺购自北京碧云天生物科技有限公司,优质胎牛血清FBS购自澳洲,DMEM培养基购自Hyclone公司,无酚红DMEM/F12购自杭州吉诺公司,EGF购自 Gali‐Bio公司,FGF购自PeproTech公司,B27购自Gibco公司,17β‐雌二醇(17β‐Estradiol,E2β)购自美国Sigma公司,糖皮质激素氢化可的松(hydrocortisone)购自美国Sigma公司,细胞裂解液RⅠPA购自北京普利莱基因技术有限公司,BSA蛋白标准品购自北京碧云天生物科技有限公司,BCA蛋白浓度检测试剂盒购自武汉飞弈生物科技有限公司,甘油购自美国Sigma公司,蛋白MARKER购自美国Fermentas公司,0.22µmol/L PVDF膜购自美国Millipore公司,ECL化学发光检测试剂盒购自北京碧云天生物科技有限公司,CD24、CD44抗体购自BD公司,Snail抗体购自Abcam公司,ER‐α36抗体由美国Creighton大学王兆一教授馈赠,FⅠTC‐标记山羊抗兔购自Thermo公司,hoechst33258细胞核染色剂购自北京碧云天生物科技有限公司,无水乙醇和甲醇及甲醛分析纯购自国药集团化学试剂有限公司。
1材料与方法
1.1 材料
1.2 方法
1.2.1 肿瘤细胞球的培养取交替培养于含80%FBS培养瓶的SGC7901细胞,用磷酸盐缓冲溶液(phosphate buffered saline,PBS)清洗2次后,经胰酶消化至轻轻晃动,使细胞可完全脱落,再放置1 min后,加入SSM终止消化,轻轻机械吹打数次,收集细胞,1200 rpm,离心3 min,去上清后加入无血清培养基(serum free medium,SFM)轻轻吹打数次,使细胞成单细胞培养液。取100µl的细胞悬液加900µl PBS稀释,用全自动细胞计数器计数后重悬于SFM中,细胞以5×103/ml的密度分别接种于100 mm普通的培养皿和超低吸附培养皿中,补充SFM至总培养液体积为10 ml。放置于37℃、5%CO2、95%湿度的恒温细胞培养箱中,培养至第4天换液。
1.2.2 肿瘤细胞球HE染色当培养皿中形成肿瘤细胞球(1周)后收集细胞球,低速离心去上清液。加入新鲜配制的4%多聚甲醛固定30 min,涂在用0.5%明胶处理好的载玻片上,自然晾干。使用苏木素液染色(5~10 min),培养基中加入流水洗去苏木素液(1 min)、1%盐酸‐酒精(1~3 s)、流水冲洗(10~15 min)、蒸馏水洗(1~2 min)、0.5%伊红液染色(1~3 min)、蒸馏水稍洗(1~2 s)、80%乙醇(1~2 s)、95%乙醇Ⅰ(2~3 min)、95%乙醇Ⅱ(2~3 min)、无水乙醇Ⅰ(3~5 min)、无水乙醇Ⅱ(3~5 min)、二甲苯Ⅰ(3~5 min)、二甲苯Ⅱ(3~5 min)、二甲苯Ⅲ(3~5 min)。使用中性树胶封固并于倒置显微镜下拍照。
1.2.3 Westernblot鉴定肿瘤细胞球中Snail及相关蛋白的表达收集无血清悬浮培养1周的肿瘤细胞球,2000 rpm,离心5 min。弃上清,加入4 ml的PBS,并用移液枪轻轻吹打混匀,然后,2000 rpm,离心5 min。弃上清后,再用1 ml的PBS重复洗涤1次。弃上清,放置冰上。配制含1%胆碱脂酶抑制剂(phenylmethanesulfonyl fluoride,PMSF)的细胞裂解液。向离心管中加入适量现配现用的PMSF细胞裂解液后,置于冰上裂解30 min,每5~10 min漩涡震荡1次。裂解完成后,置于4℃高速冷冻离心机内,于16 000 rpm下离心15 min,收集上清即所需蛋白原液。取2µl蛋白原样加18µl的PBS溶液稀释10倍,与6组BSA蛋白标液样品一起点样到96孔板上,其中,每孔蛋白液样品5µl,蛋白定量液96µl,每个蛋白液点3个孔,点样完成后,在37℃的摇床上震荡,孵育30 min。使用酶标仪检测96孔板内蛋白在A492波长下的吸光度值,并通过Excel表格制作出标准曲线,得出计算公式,算出蛋白原液的浓度。采用Biostep Photoimpact凝胶分析系统软件测量各组目的蛋白与β‐actin条带的平均光密度值,计算两者的比值,进行相对定量。将经过去除雌激素影响的细胞用无酚红培养基培养作为对照组,比较SGC7901研究组和SGC7901对照组中Snail+细胞含量、Snail蛋白表达情况。将SGC7901、High36及Low36细胞中ER‐α36蛋白的表达情况进行比较。
1.3 统计学方法
采用SPSS 17.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,两组均数间比较采用t检验;多组均数间比较采用F检验,多组间两两比较采用q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤细胞球体内Snail+细胞含量及Snail蛋白的表达
SGC7901对照组的Snail+细胞含量明显高于SGC7901研究组,差异有统计学意义(P<0.01)。而SGC7901对照组的Snail蛋白表达低于SGC7901研究组,差异有统计学意义(P<0.05)。(表1)
表1 肿瘤细胞球体内Snail+细胞含量及Snail蛋白的表达(± s)
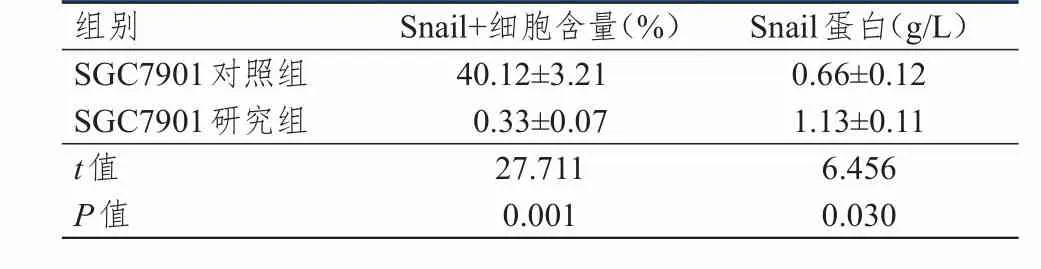
表1 肿瘤细胞球体内Snail+细胞含量及Snail蛋白的表达(± s)
组别SGC7901对照组SGC7901研究组t值P值40.12±3.21 0.33±0.07 27.711 0.001 0.66±0.12 1.13±0.11 6.456 0.030 Snail+细胞含量(%)Snail蛋白(g/L)
2.2 ER- α36对胃癌肿瘤干细胞样细胞生长的影响
Western blot检测结果显示,SGC7901对照组、High36组、Low36组ER‐α36蛋白和Snail蛋白的表达量比较,差异有统计学意义(P<0.05)。High36形成的肿瘤细胞球数量多于SGC7901对照组,而Low36形成的肿瘤细胞球数量低于SGC7901对照组,差异均有统计学意义(P<0.05)。上调ER‐α36细胞High36组的肿瘤细胞球体内Snail蛋白的表达高于SGC7901‐对照组,而Low36组的肿瘤细胞球体内Snail蛋白的表达低于SGC7901‐对照组(P<0.05)。(表2)
表2 SGC7901、High36及Lo-w36细胞中ER‐ α36蛋白和Snail蛋白的表达(g/L,± s)
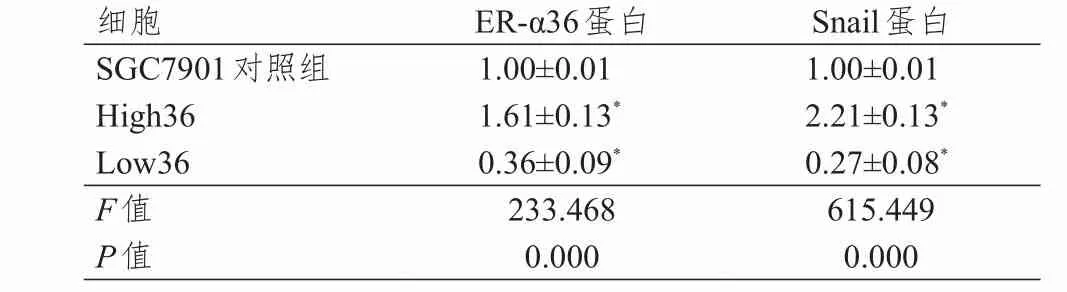
表2 SGC7901、High36及Lo-w36细胞中ER‐ α36蛋白和Snail蛋白的表达(g/L,± s)
注:*与SGC7901对照组比较,P<0.05
细胞SGC7901对照组High36 Low36 F值P值1.00±0.01 1.61±0.13*0.36±0.09*233.468 0.000 1.00±0.01 2.21±0.13*0.27±0.08*615.449 0.000 ER‐α36蛋白Snail蛋白
2.3 不同浓度ER预处理对于ER- α36和Snail表达的影响
低浓度ER处理组悬浮培养的肿瘤细胞球体内Snail蛋白和ER‐α36的表达高于无ER处理的对照组(P<0.05);而高浓度ER处理组悬浮培养的肿瘤细胞球体内Snail蛋白和ER‐α36的表达,低于无ER处理的对照组(P<0.05)。(表3)
表3 不同浓度ER处理后各组肿瘤细胞球体内ER‐ α36和Snail的表达(g/L,± s)

表3 不同浓度ER处理后各组肿瘤细胞球体内ER‐ α36和Snail的表达(g/L,± s)
注:*与对照组比较,P<0.05
组别对照组1 μmol组0.1 μmol组F值P值1.00±.0.01 0.68±0.13*1.29±0.08*59.679 0.000 1.00±0.01 0.52±0.11*1.93±0.21*136.918 0.000 ER‐α36Snail
3 讨论
在体外如何获得更多的胃癌干细胞,胃癌干细胞的表面标志物有哪些,胃癌组织中肿瘤干细胞的形成机制,这些都是研究胃癌重要生物学行为所面临的实际问题。本研究应用超低吸附培养皿悬浮培养胃癌细胞系SGC7901较应用普通培养皿可更多更好地获得肿瘤细胞球体。对肿瘤细胞球体细胞进行胰酶消化成单个细胞悬液后,全部继续进行无血清悬浮培养,肿瘤细胞球细胞仍能够进行分裂增殖,并稳定传至第4代,即表现出干细胞样的特征性能力之一,即自我更新的能力。这些肿瘤细胞球体内存在能够不断增殖,具有自我增殖的能力,与Deng等[4]的研究结果相似。
Snail作为转录因子,其在调节胚胎着床及细胞凋亡方面发挥极大的作用。同时有大量文献报道,Snail可通过不同途径促使 EMT[5‐7],EMT主要在肿瘤早期发生,是肿瘤发生侵袭、转移及复发的主要原因之一。Snail可促使细胞内E‐钙黏着蛋白及桥粒芯糖蛋白的表达下降,从而使细胞具有迁移性。此外,Snail还可以介导肿瘤细胞存活,诱导肿瘤干细胞形成[8]。在乳腺癌中异常表达的Snail,不仅能够提高肿瘤细胞形成具有乳腺上皮细胞相关特性的微球体和肿瘤种植能力,还能够提高肿瘤细胞表达干细胞相关表面标志物的能力。此外,Snail可以有效地介导细胞存活,并使细胞具有干细胞样特性。Sato等[9]在长期暴露于尼古丁中的口腔上皮中发现,敲除Snail基因后,肿瘤干细胞性能的增强及EMT得到逆转。由此推测,Snail可能也作为肿瘤干细胞标志物通过某一信号传导通路调节胃癌肿瘤干细胞的生长[10]。Snail蛋白作为参与EMT及诱导肿瘤干细胞存在的重要分子,其在胃癌肿瘤干细胞中的作用机制有待进一步研究。
新近发现的雌激素受体ER‐α36是ER‐α的新亚型,在ER‐α66阴性的乳腺癌中,ER‐α36通过激活多条信号通路刺激乳腺癌细胞生长,ER‐α36在组织中的表达与ER‐α66的表达呈负相关性,并且在ER阴性的乳腺癌中,Snail表达明显升高[12]。前期有研究发现,胃癌的发生发展与ER‐α36介导的雌激素之间也存在相关性,ER‐α36介导的雌激素信号能够促进SGC7901细胞增殖与侵袭[13]。因此,推测ER‐α36介导的雌激素信号可能与形成胃癌肿瘤干细胞有关,但目前未见相关报道。
在得到上述结果及前期研究结果的基础上,又应用无血清以及超低吸附培养皿悬浮培养胃癌细胞系SGC7901及SGC7901重组细胞系High36和Low36,并对SGC7901肿瘤细胞球进行不同浓度的ER(1 μmol、0.1 μmol)处理。应用倒置显微镜观察各组肿瘤细胞球的大小和形状,并在镜下利用热点计数法计算肿瘤细胞数目,结果显示,低浓度ER和ER‐α36蛋白上调均与促进肿瘤细胞球的形成有关。另外,本项研究还对各组肿瘤细胞球中细胞进行传代,继续无血清悬浮培养,计数每一代肿瘤细胞球中的细胞数。本研究发现,低浓度ER和上调ER‐α36均与促进肿瘤细胞球细胞分裂增殖有关(P<0.05)。此外,通过对不同浓度ER处理形成的肿瘤细胞球及重组细胞系High36和Low36肿瘤细胞球中Snail蛋白表达的检测中发现,在低浓度ER处理悬浮培养的细胞肿瘤细胞球中Snail蛋白高表达的同时,伴有ER‐α36表达的升高,而高浓度的ER处理作用却相反。最新的研究发现,Snail参与ER‐α促进EMT过程,并促进肿瘤的增殖和侵袭转移[14],针对性地抑制ER‐α表达,同时也抑制了Snail蛋白的表达[15‐16]。因此,根据已有的实验数据结果显示,推测ER‐α36‐Snail信号可能具有促进CSC样细胞生长作用,Snail通过ER‐α36介导的雌激素信号在胃癌肿瘤干细胞中的作用机制有待我们进行下一步的深入研究。
综上所述,本研究应用超低吸附皿无血清悬浮培养的方法,可稳定获得能够不断增殖、具有自我更新能力的胃癌肿瘤细胞球体。Snail在这些肿瘤细胞球体内细胞含量明显增高,且Snail蛋白也呈中高表达,低浓度ER刺激可以诱导Snail及ER‐α36的高表达。因此,Snail在ER‐α36信号通路促进胃癌肿瘤干细胞样成球中可能具有重要作用。
[1]张雷,何流,龙佩,等.胃癌应用CA724、CEA、CA242、CA199肿瘤标志物联合检验的价值分析[J].辽宁医学杂志,2017,31(2):1‐2.
[2]黎伟超,牛晓敏,何慧清,等.自体外周血造血干细胞移植对恶性淋巴瘤患者T细胞亚群的影响[J].辽宁医学杂志,2015,29(1):9‐10.
[3]黄辉,潘志坚.胃癌干细胞在胃癌侵袭、转移中及血管形成中的作用和机制[J].中国组织工程研究,2016,20(14):2021‐2026.
[4]Deng H,Zhang XT,Wang ML,et al.ER‐α36‐mediated rapid estrogen signaling positively regulates ER‐positive breast cancer stem/progenitor cells[J].PLoS One,2014,9(2):e88034.
[5]Kume K,Haraguchi M,Hijioka H,et al.The transcription factor Snail enhanced the degradation of E‐cadherin and desmoglein 2 in oral squamous cell carcinoma cells[J].Biochem Biophys Res Commun,2013,430(3):889‐894.
[6]Hwang WL,Yang MH,Tsai ML,et al.SNAⅠL regulates interleukin‐8 expression,stem cell‐like activity,and tumorigenicity of human colorectal carcinoma cells[J].Gastroenterology,2011,141(1):279‐291.
[7]Qu BL,Yu W,Huang YR,et al.6‐OH‐BDE‐47 promotes human lung cancer cells epithelial mesenchymal transition via the AKT/Snail signal pathway[J].Environ Toxicol Pharmacol,2015,39(1):271‐279.
[8]Hwang WL,Yang MH,Tsai ML,et al.SNAⅠL regulates interleukin‐8 expression,stem cell‐like activity,and tumorigenicity of human colorectal carcinoma cells[J].Gastroenterology,2011,141(1):279‐291.
[9]Sato F,Sato H,Jin D,et al.Smad3 and Snail show circadian expression in human gingival fibroblasts,human mesenchymal stem cell,and in mouse liver[J].Biochem Biochem Biophys Res Commun,2012,419(2):441‐446.
[10]吴丽霞,王绪明,张尚昆,等.胃癌细胞的无血清悬浮培养与初步鉴定[J].世界华人消化杂志,2014,22(11):1531‐1536.
[11]王绪明,刘晶晶,邓昊,等.ER‐α36对胃癌SGC7901细胞在裸鼠体内生长的影响[J].世界华人消化杂志,2011,19(28):2919‐2924.
[12]邹丰,王绪明,刘丽江.ER‐α36和miR‐143介导胃癌细胞的侵袭[J].中国病理生理杂志,2012,28(12):2167‐2171.
[13]Wang X,Deng H,Zou F,et al.ER‐α36‐mediated gastric cancer cell proliferation via the c‐Src pathway[J].Oncol Lett,2013,6(2):329‐335.
[14]宋伟.RNAi抑制Snail表达对于胃癌细胞上皮‐间充质转化以及体外侵袭的研究[D].武汉:华中科技大学,2009.
[15]Huang JW,Guan BZ,Yin LH,et al.Effects of estrogen‐related receptoralpha(ERRα)on proliferation and metastasisofhuman lungcancerA549cells[J].J Huazhong Univ Sci Technolog Med Sci,2014,34(6):875‐881.
[16]Lam SS,Mak AS,Yam JW,et al.Targeting estrogen‐related receptor alpha inhibits epithelial‐to‐mesenchymal transition and stem cell properties of ovarian cancer cells[J].Mol Ther,2014,22(4):743‐751.
