细粒棘球绦虫半胱氨酸蛋白酶抑制剂基因的克隆、表达及诊断价值的初步评价
2018-04-04吴茂迪宋星桔阳爱国古小彬杨光友
吴茂迪,宋星桔,闫 敏,阳爱国,郭 莉,王 凝,谢 跃,古小彬,杨光友*
(1. 四川农业大学动物医学院,成都 611130;2. 四川省动物疫病预防控制中心,成都 610041)
细粒棘球绦虫(Echinococcusgranulosus)的中绦期幼虫(细粒棘球蚴)寄生于人和动物的肝和肺等组织器官引起细粒棘球蚴病(cystic echinococcosis, 又称囊性包虫病),是一种重大的人兽共患病[1-4],该病呈世界性分布,我国是高发国家之一,主要在内蒙古、新疆、青海、西藏、宁夏、四川、甘肃等省份流行[5]。包虫病严重危害人体健康,同时给畜牧业造成严重的经济损失,给人类带来许多公共卫生问题。我国已将该病列为《国家中长期动物疫病防治规划》(2012—2020年)优先防治和重点防范的动物疫病。
半胱氨酸蛋白酶抑制剂是半胱氨酸蛋白酶类可逆性紧密结合抑制剂。根据半胱氨酸蛋白酶抑制剂的结构将其分为4个大家族,即Ⅰ型(the stefin)、Ⅱ型(the cystatin)、Ⅲ型(the kininogen)和Ⅳ型(the fetuin)[6-7]。其中,Ⅱ型cystatin属于分泌性蛋白,在N末端有信号肽序列,该家族蛋白一般分泌到细胞外参与外源蛋白的调节[8]。在对寄生性线虫半胱氨酸蛋白酶抑制剂的研究中发现该酶对宿主具有干预抗原呈递过程,调节细胞因子生成,活化巨噬细胞等作用[9-11]。因此,它在线虫逃避宿主免疫应答和适应寄生生活中发挥着重要作用[12]。在绦虫上,李君君等[13]对猪带绦虫的cystatin进行了三级结构分析,发现其结构域能与半胱氨酸蛋白酶活性位点结合来发挥抑制作用。
目前有关于细粒棘球绦虫cystatin的研究,尚未见有报道。本研究对细粒棘球绦虫半胱氨酸蛋白酶抑制剂(Eg-cystatin)的基本特性进行分析与虫体组织定位,并通过间接ELISA初步评价其诊断价值,为今后该蛋白质的功能研究提供重要资料。
1 材料与方法
1.1 虫体与实验动物
细粒棘球蚴包囊来自于自然感染的绵羊肝,样本采自青海省的某屠宰场。在无菌条件下,使用一次性注射器反复吹打后抽取包囊囊液,并分离生发层,囊液经3 000 r·min-1离心5 min,用灭菌生理盐水和PBS分别洗涤3次,获得细粒棘球蚴原头蚴。成虫由四川农业大学寄生虫病研究中心提供。两只9周龄(2.5 kg)雌性新西兰大白兔购自成都达硕实验动物中心。
1.2 生物信息学分析
Eg-cystatin全长核酸序列下载自细粒棘球绦虫基因组数据库GeneDB (EgrG_000849600) (http://www.genedb.org/)。以在线软件SignalP 4.1 server(http://www.cbs.dtu.dk/services/SignalP/)和ExPaSy (http://www.expasy.org/) 分别对Eg-cystatin的信号肽、理化参数、保守结构域、糖基化和磷酸化位点进行预测。以推导出的氨基酸序列找出同源序列,并用Clustal X 1.83 软件进行比对。
用DNAMAN比较同源基因的相似性。
用MEGA 5.05软件采用邻接法构建进化树,并进行系统进化分析。
1.3 Eg-cystatin的克隆、表达与纯化
以除去信号肽序列的Eg-cystatin序列为模板设计一对特异性引物(上游5′-CCGGAATTCAGACAGCAAGAGCGCAGCGT-3′,下划线为EcoRⅠ酶切位点;下游5′-ACGCGTCGACTAGGGCTGTGGGGTCTTGAT-3′,下划线为SalⅠ酶切位点)。从cDNA中扩增出Eg-cystatin序列,将扩增产物连接到pET28a(+)质粒上并转入大肠杆菌BL21中。细胞在1 mmol·L-1IPTG下37 ℃诱导5 h,离心收集菌体沉淀,用超声破碎仪超声裂解重组菌。重组蛋白质以Ni2+亲和层析的方法进行纯化。纯化后的蛋白质浓度用BCA蛋白试剂盒进行测定。
1.4 血清
24份健康绵羊血清采自细粒棘球蚴病的非流行区,并通过剖检确定无带科绦虫感染;24份自然感染细粒棘球蚴的绵羊血清、12份自然感染脑多头蚴的绵羊血清、3份自然感染细颈囊尾蚴绵羊血清以及7份自然感染细颈囊尾蚴山羊血清均采自四川省。以上阳性血清均经剖检确认,为单一的带科绦虫感染。
1.5 兔抗 rEg-cystatin-IgG
将纯化后的rEg-cystatin蛋白分别与弗氏完全佐剂和弗氏不完全佐剂按照 1∶1 比例混合制备乳剂苗,对两只新西兰兔进行三次皮下注射免疫,每次免疫间隔两周,第一次用弗氏完全佐剂和200 μg重组蛋白质皮下注射免疫,后两次均用弗氏不完全佐剂和200 μg重组蛋白质皮下注射免疫。收集血清,用Hitrap蛋白A亲和层析纯化。
1.6 免疫印迹和免疫荧光定位
重组蛋白质与原头蚴裂解液分别进行12%SDS-PAGE凝胶电泳,再将凝胶分别转移到硝酸纤维素膜上。经5%脱脂牛奶封闭后,分别以绵羊阳性、阴性血清和兔高免血清、对照血清对重组蛋白质进行孵育;以重组蛋白质高免血清和对照血清对原头蚴裂解液进行孵育。经洗涤后,以HRP标记的兔抗绵羊二抗对重组蛋白质进行孵育;并以HRP标记的山羊抗兔二抗对原头蚴裂解产物进行孵育。最后在显色底物作用下进行显色观察。
取原头蚴、生发层和成虫制备切片,经脱蜡、脱水处理后,用重组蛋白质高免血清4 ℃孵育过夜。反复洗涤切片后,以FITC标记的山羊抗兔荧光二抗对虫体进行显色,并在荧光显微镜下进行观察。
1.7 ELISA的建立和评估
用建立的间接ELISA分别对7份山羊细颈囊尾蚴阳性血清、3份绵羊细颈囊尾蚴阳性血清以及12份绵羊脑多头蚴血清进行检测,检测其交叉反应。
临床检测用24份阴性血清建立的间接ELISA方法分别对24份细粒棘球蚴病阴性绵羊血清和24份细粒棘球蚴病阳性绵羊血清进行,检测临界值判断该方法的可靠性。按照特异性=真阴性血清数/(真阴性血清数+假阳性血清数);敏感性=真阳性血清数/(真阳性血清数+假阴性血清数);符合率=(真阳性血清数+真阴性血清数)/(真阳性血清数+真阴性血清数+假阳性血清数+假阴性血清数),计算出特异性、敏感性及符合率。所有血清样品评价批间变异和批内变异的变异系数(CV)。每个样品包被三个板检测批间CV,并在每个板内进行三个重复检测批内CV。
2 结 果
2.1 Eg-cystatin基因的扩增与生物信息学分析
Eg-cystatin(EgrG_000849600)基因全长825 bp,编码274个氨基酸,预测相对分子质量为30.8 ku。经氨基酸序列预测,发现在第18和第19个氨基酸之间有信号肽存在,切除信号肽后长度为256个氨基酸,预测相对分子质量为28.9 ku,等电点为5.7,无糖基化位点,存在磷酸化位点。氨基酸序列分析显示Eg-cystatin含有cystatin结构域,结构域包括Q-X-V-X-G保守序列,靠近N端的甘氨酸残基,PW发夹环结构。序列比对结果显示,Eg-cystatin与多房棘球绦虫cystatin相似性最高,达到80.66%,与猪带绦虫、牛带绦虫以及亚洲带绦虫的cystatin相似性为72.20%~75.91%,与马来丝虫、日本血吸虫、刚地弓形虫相似性极低(图1)。进化树结果显示,在蠕虫上,Eg-cystatin与多房棘球绦虫(Echinococcusmultilocularis)、微小膜壳绦虫(Hymenolepisnana)、猪带绦虫(Taeniasolium)、牛带绦虫(Taeniasaginata)以及亚洲带绦虫(Taeniaasiatica)等寄生虫的cystatin属于同一支(图2)。
2.2 重组蛋白质的表达与免疫印迹
除去信号肽的Eg-cystatin蛋白质在SDS-PAGE下显示为单一条带,大小约为33 ku,符合预期大小[加上pET28a (+)质粒所表达的His标签蛋白]。免疫印迹显示,rEg-cystatin能被兔抗rEg-cystatin-IgG和细粒棘球蚴病阳性绵羊血清识别(图3),且为单一条带,阴性对照无条带,说明Eg-cystatin具有较好的免疫原性。以兔抗rEg-cystatin-IgG识别原头蚴粗蛋白质提取液,显示有单一条带,大小与天然蛋白质相近(30.8 ku)。
2.3 Eg-cystatin在细粒棘球绦虫各生活史阶段的定位
利用免疫荧光技术,以兔抗rEg-cystatin抗体来测定Eg-cystatin在细粒棘球绦虫各生活史阶段的定位。结果显示,Eg-cystatin分布于原头蚴的表皮以及顶突钩上,广泛分布于成虫虫体的内部,虫卵与表皮上也有少量分布,生发层广泛分布(图4)。

Q-X-V-X-G活性位点用黑字绿底表示。N端保守的甘氨酸残基用白字蓝底表示。PW发夹环结构用黑字红底表示。信号肽用蓝色括弧表示。GenBank登陆号:E.granulosus cystatin (GenBank: EUB63448.1), E. multilocularis cystatin (GenBank: CDS40893.1), T.solium cystatin (GenBank: AIM55117.1), T.saginata cystatin (GenBank: AIM55120.1), T.asiatica cystatin (GenBank: AIM55123.1), H.microstoma cystatin (GenBank: CDS28976.1), B.malayi cystatin (GenBank: XP_001895476.1), S.japonicum cystatin (GenBank: ACU68954.1), and T.gondii cystatin (GenBank: ABR26639.1)The Q-X-V-X-G motif is shown in black letters with a green background. A conserved glycine residue in the N-terminal region is marked as a white letter on a blue background. The P-W hairpin loop in the C-terminal region is marked in black letters with a red background. The signal peptide is marked with the blue bracket. GenBank accession numbers: Echinococcus granulosus cystatin (GenBank: EUB63448.1), Echinococcus multilocularis cystatin (GenBank: CDS40893.1), Taenia solium cystatin (GenBank: AIM55117.1), Taenia saginata cystatin (GenBank: AIM55120.1), Taenia asiatica cystatin (GenBank: AIM55123.1), Hymenolepis microstoma cystatin (GenBank: CDS28976.1), Brugia malayi cystatin (GenBank: XP_001895476.1), Schistosoma japonicum cystatin (GenBank: ACU68954.1), and Toxoplasma gondii cystatin (GenBank: ABR26639.1)图1 Eg-cystatin氨基酸序列比对Fig.1 Amino acid sequence analysis of Eg-cystatin
2.4 ELISA
间接ELISA结果显示,抗原最佳质量浓度为0.8 μg·孔-1,最佳血清稀释度为1∶320。在最适浓度下,得出临界值为0.427。用建立的间接ELISA分别对绵羊抗脑多头蚴血清和山羊抗细颈囊尾蚴阳性血清进行检测,结果显示有8个血清与绵羊脑包虫血清有交叉反应,有7个血清与细颈囊尾蚴有交叉反应,因此,其存在严重的交叉反应。用24份绵羊细粒棘球蚴病阳性血清和24份阴性血清对建立的间接ELISA方法进行临床检测,结果发现有5个假阳性和4个假阴性,特异性为79.1%,敏感性为83.3%,符合率仅为81.25%(图5)。批内重复性试验结果显示,板内的变异系数介于1.332%~1.589%,平均值为1.495%,板间变异系数介于2.318%~4.095%,平均值为3.282%。板内与板间系数均<10%,表明该方法重复性好。
3 讨 论
半胱氨酸蛋白酶抑制剂是一类在生物体内广泛存在的能够可逆性地抑制半胱氨酸蛋白酶的抑制剂超家族[16]。半胱氨酸蛋白酶抑制剂不仅能特异性抑制半胱氨酸蛋白酶的活性,而且是寄生虫产生的重要免疫调节分子[12]。近年来,cystatin备受研究者的关注,在寄生虫领域中,研究得比较深入的是有关线虫cystatin调控宿主的免疫反应方面[9-12]。此外,日本血吸虫cystatin被证明有诱导M2巨噬细胞极化,促进TNF-α和IL-6产生的作用[17]。华支睾吸虫的stefin位于肠上皮,并发现其能调节和加工组织蛋白酶F的活性,防止内源性半胱氨酸蛋白酶对寄生虫造成伤害[18]; cystatin也发现存在于大片吸虫雄虫的睾丸、射精管及精液中,与射精和受精过程相关,这表明半胱氨酸蛋白酶抑制剂在大片吸虫的生殖周期中有重要的调节作用[19]。

物种名称后为该序列的GenBank登录号GenBank accessing numbers were given after the species name图2 Eg-cystatin基因系统进化树(NJ树)Fig.2 The phylogenetic (neighbor-joining) tree of Eg-cystatin
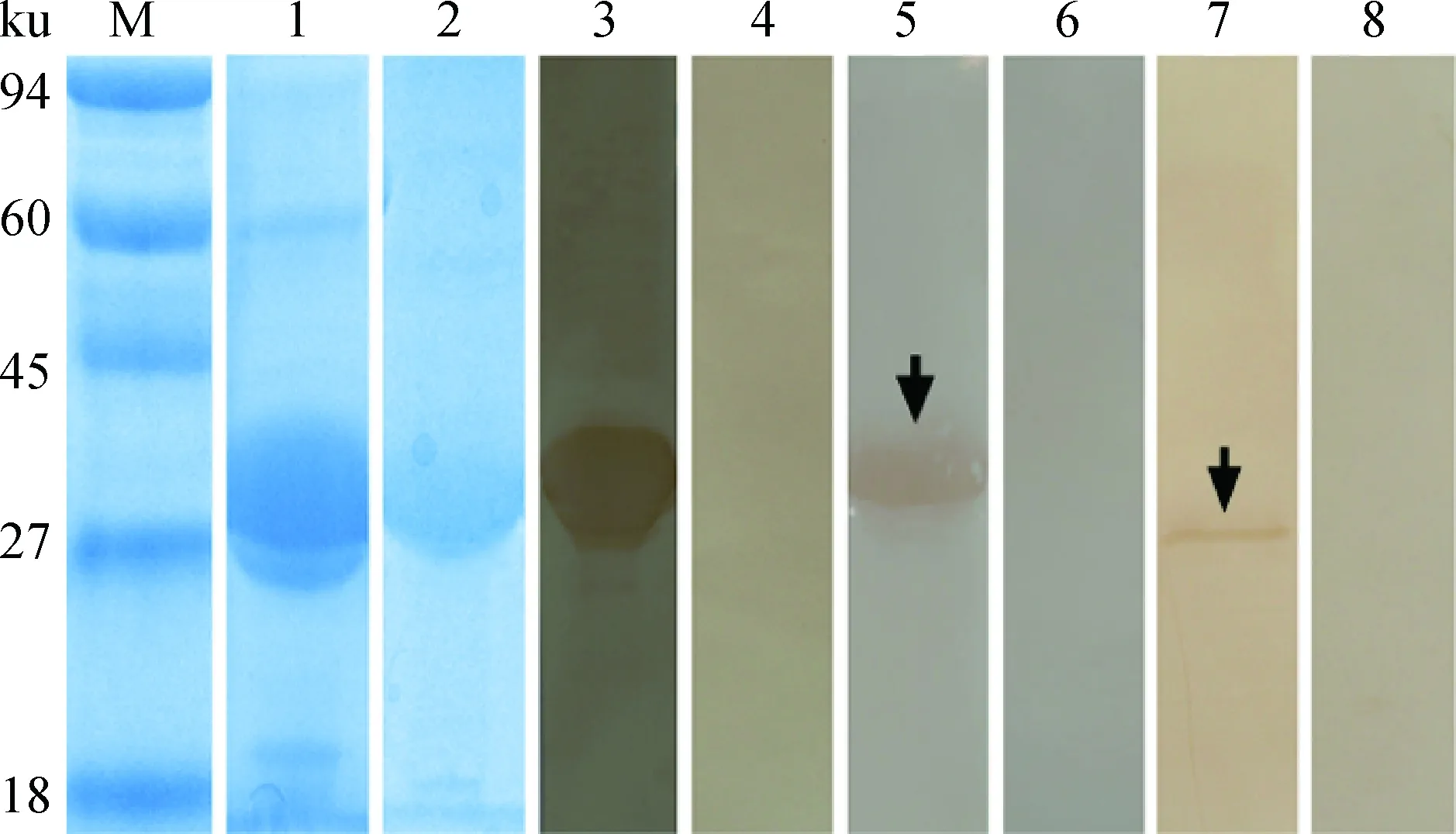
M.蛋白质相对分子质量标准;1.加IPTG诱导大肠杆菌BL21表达重组Eg-cystatin;2.纯化后的重组Eg-cystatin;3.重组Eg-cystatin与高免血清孵育;4. 重组Eg-cystatin与对照兔血清孵育;5. 重组Eg-cystatin与自然感染细粒棘球蚴的绵羊血清孵育;6. 重组Eg-cystatin与健康羊血清孵育;7.原头蚴裂解液与兔重组Eg-cystatin高免血清孵育;8. 原头蚴裂解液与对照兔血清孵育M. Protein molecular weight marker; 1. Lysate of IPTG-induced E. coli BL21 (DE3) expressing recombinant E. granulosus cystatin (rEg-cystatin); 2. Purified rEg-cystatin; 3. Purified rEg-cystatin probed with anti-rEg-cystatin rabbit serum; 4. Purified rEg-cystatin probed with native rabbit serum; 5. Purified rEg-cystatin probed with the serum of E. granulosus infected sheep; 6. Purified rEg-cystatin probed with native sheep serum; 7. Endogenous Eg-cystatin from protoscoleces (PSCs) probed with anti-Eg-cystatin rabbit serum; 8. The total protein extract of PSCs probed with native rabbit serum图3 SDS-PAGE鉴定及Western blot分析Fig.3 SDS-PAGE and Western blot analysis
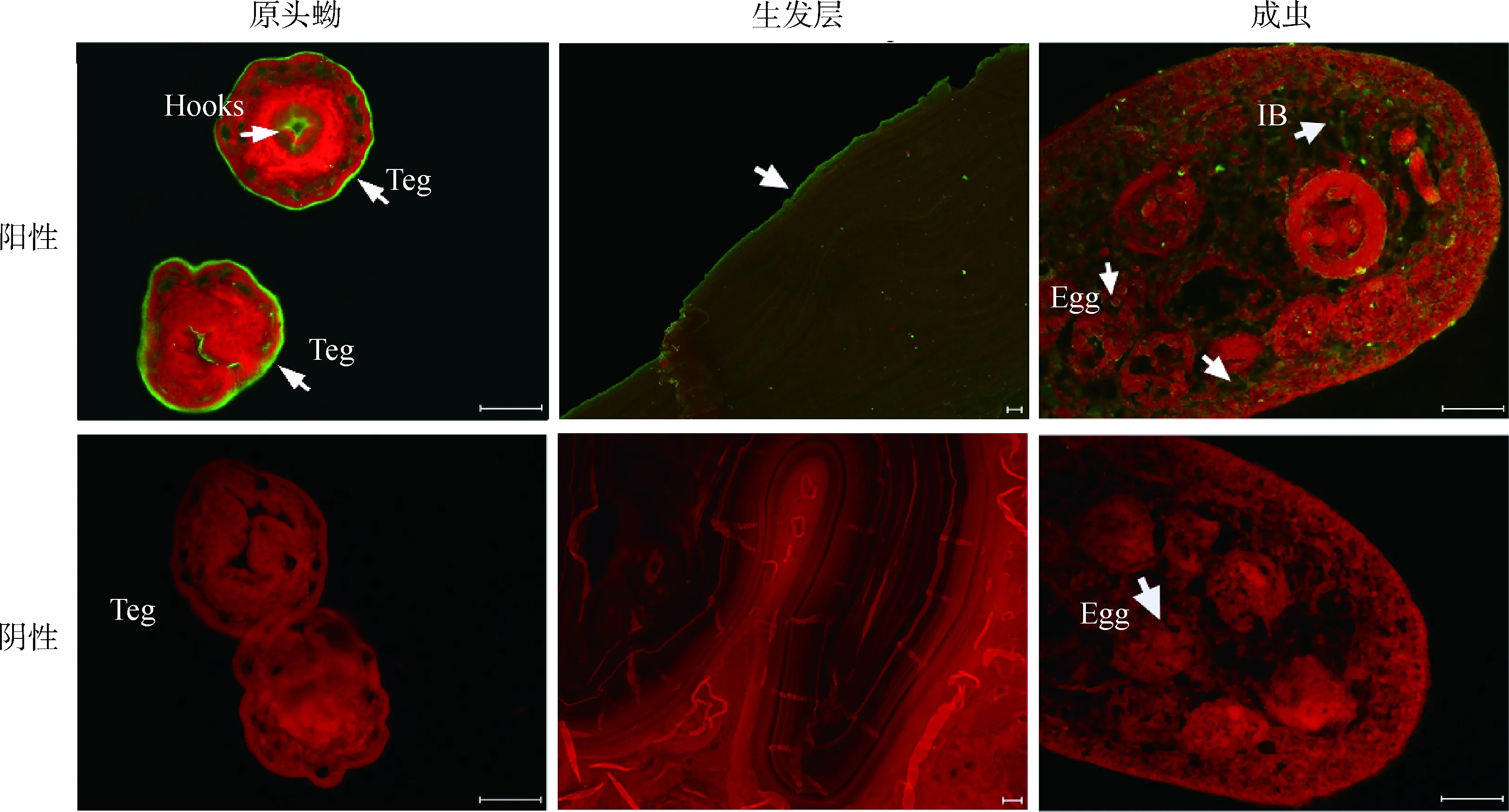
Teg. 表皮;IB. 虫体内部。标尺:50 μmTeg. Tegument; IB. Inner body. Scale bars: 50 μm图4 Eg-cystatin蛋白在各时期虫体上的免疫荧光定位Fig.4 Immunofluorescence localization of Eg-cystatin in different stages of E. granulosus
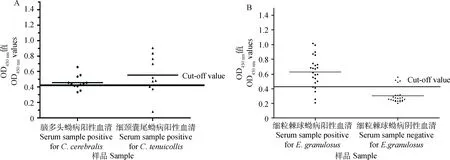
A.ELISA进行交叉反应分析;B. ELISA进行临床试验。实线代表cut-off值为0.427A. The cross-reaction of the iELISA; B. Clinical trial of the iELISA. The bold horizontal line indicates the cut-off value, which was 0.427图5 重组Eg-cystatin间接ELISA分析Fig.5 Indirect ELISA using rEg-cystatin as the antigen
本研究从细粒棘球绦虫中扩增出cystatin,并对其进行生物信息学的预测与分析,发现Eg-cystatin有信号肽,提示该蛋白很可能在细胞外实现其抑制半胱氨酸蛋白酶的活性,同时可能发挥重要的调控功能,这与先前报道的大多数cystatin家族蛋白属于分泌蛋白结果相一致[20]。序列分析显示Eg-cystatin包含典型的半胱氨酸蛋白酶抑制剂保守活性位点:(1)PW位点;(2)Q-X-V-X-G区域;(3)靠近N端的G位点。二级和三级结构预测发现Eg-cystatin都具有保守的中心1个α-螺旋,周围环绕5个反平行的β折叠的片层结构区,这几个保守结构域共同构成一个楔形结构,与蛋白酶的活性位点结合,形成酶-抑制剂复合物从而发挥抑制活性。A. J. Guo[8]对蠕虫的半胱氨酸蛋白酶抑制剂家族进行了结构域进化分析,结果显示绦虫的半胱氨酸蛋白酶抑制剂独立形成一个分支,暗示绦虫的cystatin可能在演化过程中已经形成了一个新的进化支,这与本研究中进化树分析的结果一致。以上结果均说明Eg-cystatin属于cystatin家族,为深入了解Eg-cystatin的功能奠定了基础。
本研究通过对Eg-cystatin进行免疫荧光定位,发现在成虫和幼虫时期均有表达,提示该基因与虫体生命活动息息相关。绦虫直接通过皮层吸收营养物质[21],Eg-cystatin定位于原头蚴的表皮以及顶突钩上,推测其可能与原头蚴的营养物质吸收有关。有研究报道cystatin在寄生虫逃避宿主免疫应答和适应寄生生活中起着重要的作用[9-12],由于原头蚴入侵终末宿主后通过顶突上的钩吸附在宿主肠壁上,因此原头蚴可能通过分泌cystatin调节宿主的免疫反应而发挥免疫逃避作用。同时,宿主肠道内含有大量的消化酶,免疫组化结果显示cystatin在细粒棘球绦虫的成虫表皮及内部均有广泛分布,该蛋白质可能与抑制宿主蛋白酶参与免疫反应及保护虫体免受宿主消化酶的消化有关。
目前可用于家畜包虫病免疫学诊断的抗原研究尚有限[22-24],筛选敏感、特异、易于生产的诊断抗原是目前包虫病防控的重点方向之一[22]。从包囊液提取的8-kDa抗原B具有很高的灵敏度和特异性(>90%)[25-26],但是该天然抗原很难纯化以及规模化的大量生产[27]。而重组抗原具有特异性强、易纯化和成本低等优点[28]。目前已报道重组抗原Eg-DHFR、Eg-Grx1的特异性与敏感性较高,交叉反应率低,可作为诊断抗原候选[29-30]。同时也发现一些重组蛋白抗原的灵敏度与特异性较低,不适合作为诊断抗原[31-32]。虽然Eg-cystatin属于分泌蛋白,但在本试验中经间接ELISA评估,其特异性为79.1%,敏感性为83.3%,同山羊细颈囊尾蚴病血清、绵羊细颈囊尾蚴病血清和绵羊脑包虫病血清交叉反应率为68.2%。因此,提示rEg-cystatin蛋白不适合作为绵羊细粒棘球蚴病的诊断抗原。
4 结 论
原核表达细粒棘球绦虫Eg-cystatin重组蛋白。该蛋白质含有一个N端信号肽以及cystatin结构域,是典型的2型半胱氨酸蛋白酶抑制剂,进化树分析显示Eg-cystatin属于绦虫cystatin Ⅱ型。该蛋白质主要分布在原头蚴的表皮和顶突钩,生发层,成虫虫体内部和虫卵。间接ELISA评估Eg-cystatin蛋白不适合作为绵羊细粒棘球蚴病的诊断抗原候选。
参考文献(References):
[1]MCMANUS D P, GRAY D J, ZHANG W B, et al. Diagnosis, treatment, and management of echinococcosis[J].BMJ, 2012, 344: e3866.
[2]ECKERT J, DEPLAZES P. Biological, epidemiological, and clinical aspects of echinococcosis, a zoonosis of increasing concern[J].ClinMicrobiolRev, 2004, 17(1): 107-135.
[3]MCMANUS D, ZHANG W B, LI J, et al. Echinococcosis[J].Lancet, 2003, 362(9392): 1295-1304.
[4]MORO P, SCHANTZ P M. Echinococcosis: a review[J].IntJInfectDis, 2009, 13(2): 125-133.
[5]DEPLAZES P, RINALDI L, ALVAREZ ROJAS C A, et al. Global distribution of alveolar and cystic echinococcosis[J].AdvParasitol, 2017, 95: 315-493.
[6]VRAY B, HARTMANN S, HOEBEKE J. Immunomodulatory properties of cystatins[J].CellMolLifeSci, 2002, 59(9): 1503-1512.
[7]RAWLINGS N D, BARRETT A J. Evolution of proteins of the cystatin superfamily[J].JMolEvol, 1990, 30(1): 60-71.
[8]GUO A J. Comparative analysis of cystatin superfamily in platyhelminths[J].PLoSOne, 2015, 10(4): e0124683.
[10]SCHNOELLER C, RAUSCH S, PILLAI S, et al. A helminth immunomodulator reduces allergic and inflammatory responses by induction of IL-10-producing macrophages[J].JImmunol, 2008, 180(6): 4265-4272.
[11]HARNETT W, HARNETT M M. Helminth-derived immunomodulators: can understanding the worm produce the pill?[J].NatRevImmunol, 2010, 10(4): 278-284.
[12]KLOTZ C, ZIEGLER T, FIGUEIREDO A S, et al. A helminth immunomodulator exploits host signaling events to regulate cytokine production in macrophages[J].PLoSPathog, 2011, 7(1): e1001248.
[13]李君君, 骆学农, 张少华, 等. 猪带绦虫半胱氨酸蛋白酶抑制剂家族基因的克隆与序列分析[J].中国兽医科学, 2014, 44(7): 678-684.
LI J J, LUO X N, ZHANG S H, et al. Cloning and sequence analysis of cystatin family genes of Taenia solium[J].ChineseVeterinaryScience, 2014, 44(7): 678-684. (in Chinese)
[14]WIEDERSCHAIN G Y. The ELISA guidebook, 2nd edn., Crowther, J. R. (ed.) in Series Springer Protocols. Methods in Molecular Biology, Vol. 516 (Walker, J., Series ed.) Humana Press, New Jersey, 2009, 566 p., MYM129[J].Biochemistry, 2009, 74(9): 1058.
[15]HUANG X, CHEN L, YANG Y D, et al. Expression, tissue localization and serodiagnostic potential ofTaeniamulticepsacidic ribosomal protein P2[J].ParasitVectors, 2015, 8: 613.
[16]李凤梅, 盖雪梅. 半胱氨酸蛋白酶抑制剂的系统发生分析[J].安徽农业科学, 2010, 38(10): 4972-4974.
LI F M, GAI X M. Phylogenetic analysis of cystatin[J].JournalofAnhuiAgriculturalSciences, 2010, 38(10): 4972-4974. (in Chinese)
[17]YANG X, LIU J, YUE Y, et al. Cloning, expression and characterisation of a type II cystatin fromSchistosomajaponicum, which could regulate macrophage activation[J].ParasitolRes, 2014, 113(11): 3985-3992.
[18]KANG J M, LEE K H, SOHN W M, et al. Identification and functional characterization of CsStefin-1, a cysteine protease inhibitor ofClonorchissinensis[J].MolBiochemParasitol, 2011, 177(2): 126-134.
[19]SIRICOON S, GRAMS S V, GRAMS R. Efficient inhibition of cathepsin B by a secreted type 1 cystatin ofFasciolagigantica[J].MolBiochemParasitol, 2012, 186(2): 126-133.
[20]姚菊霞, 付宝权. 寄生性线虫半胱氨酸蛋白酶抑制剂研究进展[J].中国寄生虫学与寄生虫病杂志, 2012, 30(2): 146-151.
YAO J X, FU B Q. Research progress on cystatin of parasitic nematodes[J].ChineseJournalofParasitologyandParasiticDiseases, 2012, 30(2): 146-151. (in Chinese)
[21]王虎. 细粒棘球绦虫合胞体结构与功能的探讨[J].地方病通报, 1998, 13(3): 34-36.
WANG H. A further study on the syncytial structure ofEchinococcusgranulosus(adult and larve)[J].EndemicDiseasesBulletin, 1998, 13(3): 34-36. (in Chinese)
[22]ZHANG W B, MCMANUS D P. Recent advances in the immunology and diagnosis of echinococcosis[J].FEMSImmunology&MedicalMicrobiology, 2006, 47(1): 24-41.
[23]SIMSEK S, KOROGLU E. Evaluation of enzyme-linked immunosorbent assay (ELISA) and enzyme-linked immunoelectrotransfer blot (EITB) for immunodiagnosis of hydatid diseases in sheep[J].ActaTrop, 2004, 92(1): 17-24.
[24]JEYATHILAKAN N, BASITH S A, JOHN L, et al. Development and evaluation of flow through technique for diagnosis of cystic echinococcosis in cattle[J].VetArhiv, 2010, 80(5): 549-559.
[25]JEYATHILAKAN N, BASITH S A, JOHN L, et al. Development and evaluation of flow through technique for diagnosis of cystic echinococcosis in sheep[J].VetParasitol, 2011, 180(3-4): 250-255.
[26]JEYATHILAKAN N, BASITH S A, JOHN L, et al. Evaluation of native 8 kDa antigen based three immunoassays for diagnosis of cystic echinococcosis in sheep[J].SmallRuminRes, 2014, 116(2-3): 199-205.
[27]BARNES T S, DEPLAZES P, GOTTSTEIN B, et al. Challenges for diagnosis and control of cystic hydatid disease[J].ActaTrop, 2012, 123(1): 1-7.
[28]安晓雪, 余华, 严玉宝, 等. 细粒棘球蚴病诊断抗原研究进展[J].动物医学进展, 2010, 31(4): 85-89.
AN X X, YU H, YAN Y B, et al. Progress on diagnostic antigen of echinococcosis granulosa[J].ProgressinVeterinaryMedicine, 2010, 31(4): 85-89. (in Chinese)
[29]SONG X J, HU D D, YAN M, et al. Molecular characteristics and serodiagnostic potential of dihydrofolate reductase fromEchinococcusgranulosus[J].SciRep, 2017, 7: 514.
[30]SONG X J, YAN M, HU D D, et al. Molecular characterization and serodiagnostic potential of a novel dithiol glutaredoxin 1 fromEchinococcusgranulosus[J].ParasitVectors, 2016, 9: 456.
[31]KITTELBERGER R, REICHEL M P, JENNER J, et al. Evaluation of three enzyme-linked immunosorbent assays (ELISAs) for the detection of serum antibodies in sheep infected withEchinococcusgranulosus[J].VetParasitol, 2002, 110(1-2): 57-76.
[32]IBRAHEM M M, RAFIEI A, DAR F K, et al. Serodiagnosis of cystic echinococcosis in naturally infected camels[J].Parasitology, 2002, 125(Pt 3): 245-251.
