肿瘤化疗患者营养风险评估及影响因素分析
2018-04-04毕研霞洪忠新张立红葛智文
毕研霞,洪忠新,张立红,李 伟,葛智文
(首都医科大学附属北京友谊医院营养科,北京 100050)
机体罹患肿瘤时处于应激状态,代谢存在异常,肿瘤消耗营养物质多,再加上抗肿瘤治疗等因素的影响,患者发生恶心呕吐、食欲降低等不良反应,影响营养物质的摄入,进而影响患者自身的营养状况,这时机体常常会出现营养不良[1-2],其中恶性肿瘤患者的营养不良发生率高达45%~80%[3]。化疗治疗的不良反应使患者的营养状况进一步下降,进而影响患者的生活质量[4]。这时患者通常存在营养风险,营养风险的存在可影响并发症发生率、感染发生率、住院时间等,目前对肿瘤患者化疗时营养风险筛查的研究报道还较少,本研究采用营养风险筛查(NRS2002)对进行化疗治疗的肿瘤患者进行营养风险筛查,了解患者的营养状况,筛选出可能影响肿瘤患者营养风险的相关因素,为进行合理的营养干预,提高患者生活质量,更好地配合临床治疗提供科学依据。
1 对象与方法
1.1 研究对象
本研究选取2015年1月—10月我院肿瘤内科收治的236例进行化疗治疗的患者,其中男性患者88例,占50.3%;女性患者87例,占49.7%;入选患者年龄中最年轻的39岁,最年长的83岁,平均年龄是64.8±10.1岁。入选标准:患者经临床诊断为恶性肿瘤;患者神志正常,与之沟通无障碍;患者自愿参与本研究;每个患者调查1次,多次入院时不重复调查。
1.2 调查内容
调查进行化疗的肿瘤患者的一般情况,包括患者的性别、年龄、临床诊断、血红蛋白(HGB)、血清总蛋白(TP)、血清白蛋白(ALB)、身高、体重、吸烟史、饮酒史、发病史、化疗次数等。
1.3 营养风险筛查2002
NRS2002是2002年由欧洲肠外肠内营养学会推荐的营养风险筛查工具,因其能预测营养风险,简单反映患者的营养状态,为合理的营养支持提供依据而被国内外学者认可[5-6]。患者入院后,首先评估患者是否符合NRS2002入选标准,符合入选标准者第2天早晨进行由营养师对其按照 NRS2002方案[7]进行营养风险评分。此表分初筛和终筛,通过初筛者第2天早晨进行终筛。终筛总评分为3个部分的得分相加,包括患者营养状态受损情况调查得分、患者疾病严重程度调查评分和年龄评分。NRS 2002 营养风险筛查中BMI评分采用陈春明推荐的BMI标准[8],BMI<18.5 kg/m2时计3分,对于无法得到准确BMI者,可用白蛋白代替,即血清白蛋白<30g/L,计3分。NRS评分≥3分者认定为存在营养风险。
1.4 营养状况评定
通过人体测量结果BMI、实验室检查、NRS2002的结果综合评定患者的营养状况。根据住院患者入院时的身高和体重计算出其体质指数(BMI)。当BMI<18.5时,提示患者存在营养不良;BMI 介于18.5~23.9时,提示患者营养状况正常;BMI≥24时,提示其存在营养过剩[8]。实验室检查评定方面采用的标准为血浆清蛋白(ALB)<30g /L、血红蛋白(Hb)<90g /L 提示营养不良[7]。
1.5 统计学方法
采用SPSS 16.0统计软件对数据进行统计学处理,计数资料采用率或构成比(%)进行描述,组间比较采用χ2检验;符合正态分布的资料间的相关性应用多元线性相关分析,并作多元线性回归,检验水准α=0.05。
2 结果与分析
2.1 肿瘤化疗患者的一般资料
236例进行化疗治疗的肿瘤患者中,男性患者114例(占48.3%)、女性患者122例(占51.7%);年龄<60岁者69例(占29.2%)、60~69岁者80例(占33.9%)、70岁以上者(包含70岁)87例(占36.9%)。236例患者中患有消化系统肿瘤(胃癌、肝癌、胰腺癌、食管癌、直肠癌、十二指肠癌、胆管癌、结肠癌)的58例(占24.6%);患有呼吸系统肿瘤(肺癌)的75例(占31.8%)、头颈部肿瘤(鼻咽癌、下唇癌、甲状腺癌)21例(占8.9%)、淋巴造血系统肿瘤(淋巴癌)18例(占7.6%)、妇科系统肿瘤(乳腺癌、卵巢癌、宫颈癌)39例(占16.5%)、泌尿系统肿瘤(肾癌、前列腺癌、膀胱癌)25例(占10.6%)表1。
2.2 肿瘤化疗患者的营养风险评定情况
236例进行化疗治疗的肿瘤患者中,NRS评分<3分者94例(占39.8%),NRS评分≥3分者142例(占60.2%)、其中呼吸系统患者的50例(占35.2%)、消化系统患者40例(占28.2%)、头颈部肿瘤患者13例(占9.1%)、淋巴造血系统患者12例(占8.5%)、妇科系统患者13例(占9.2%)、泌尿系统患者14例(占9.8%);各系统疾病化疗患者营养风险发生率分别是66.7%、69.0%、61.9%、66.7%、33.3%、56.0%。
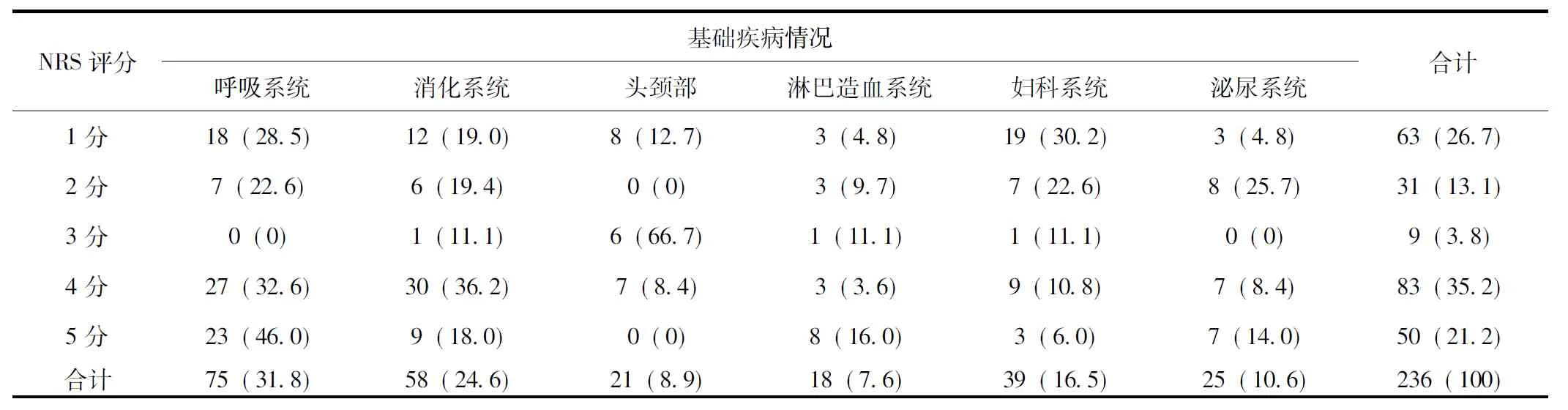
表1 肿瘤化疗患者的营养风险评定情况 单位:n(%)
2.3 肿瘤化疗患者的性别及患病部位与营养风险的关系
分别对有营养风险者与无营养风险者的肿瘤化疗患者的人口学特征、基础疾病情况等可能与营养风险相关的影响因素进行统计分析,结果显示,基础疾病情况是有统计学意义的影响因素(P<0.05),其中消化系统肿瘤患者有营养风险的比率较高(表2)。
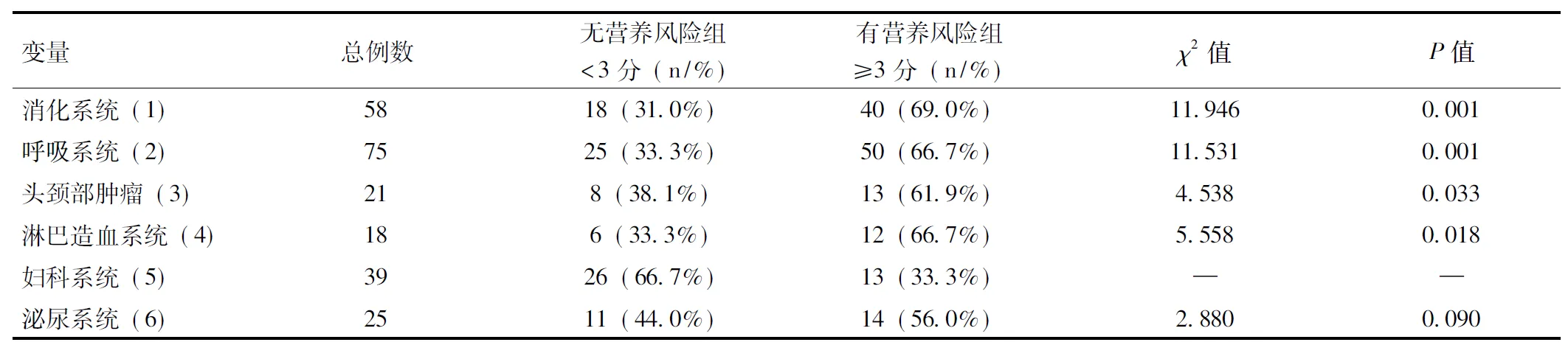
表2 肿瘤化疗患者性别及患病部位与营养风险的关系
注:1=消化系统、2=呼吸系统、3=头颈部肿瘤、4=淋巴造血系统、5=妇科系统、6=泌尿系统;将每个系统的疾病两两分组与有无营养风险进行卡方分析,只有与5组比较时,结果有统计学意义,与5组进行卡方检验结果如上表
2.4 肿瘤化疗患者的营养风险与年龄,BMI、ALB、HGB、TP的相关性分析
建立数据文件,X1表示年龄、X2表示HGB、X3表示ALB、X4表示BMI、X5表示TP,Y表示营养风险数值。将营养风险与年龄、BMI、ALB、HGB,TP等进行相关性分析,与TP作相关性分析时,P=0.572,无统计学意义;剔除TP后重新作相关性分析,发现营养风险与年龄呈正相关(r=0.042,P<0.05),与HGB呈负相关(r=-0.015,P<0.05),与ALB呈负相关(r=-0.103,P<0.05),与BMI呈负相关(r=-0.086,P<0.05),X1、X2、X3、X4的标准化系数分别是0.042、-0.015、-0.103、-0.086,标准化系数的绝对值最大的是ALB,其次是BMI,然后是年龄,最后是HGB,所以对因变量营养风险的作用按大小排列依次是ALB、BMI、年龄、HGB。建立回归方程为Y=7.505+0.042X1-0.015X2-0.103X3-0.086X4,经F检验,F=78.807,P<0.05,回归方程有意义。
2.5 不同方法评定肿瘤患者放化疗治疗期间的营养状况
用不同指标评价肿瘤化疗患者的营养状况,BMI<18.5者49例,占20.8%,血浆清蛋白(ALB)<30g/L者188例,占79.7%;血红蛋白(Hb)<90g/L者169例,占71.6%。
3 讨论
目前的临床治疗中,外科手术的方式应用较多,为提高手术后临床治疗效果或延长拒绝手术患者的生命长度,化疗在肿瘤内科的应用也越来越广泛。当肿瘤患者进行化疗治疗时,由于化疗药物的影响或者说副作用,患者会出现恶心、呕吐的行为,进而产生厌食,导致机体经口摄入的能量不足,有的患者甚至拒绝鼻饲,总能量摄入长期不足,患者的营养状况逐渐变差,营养不良及发生营养风险的几率也增加,临床治疗无法继续,整体治疗效果受到影响。鉴于这些因素,肿瘤的临床治疗中开始把患者的营养风险筛查及其营养状况评估列为肿瘤患者营养治疗的第1个阶段[9]。本研究发现,236例进行化疗治疗的肿瘤患者中,NRS评分<3分者94例(占39.8%)、NRS评分≥3分者142例(占60.2%),与国外研究报道恶性肿瘤患者营养风险发生率高达39%~68%相符。这些患者的疾病覆盖呼吸系统、消化系统、头颈部肿瘤、淋巴造血系统、妇科系统和泌尿系统;各系统疾病的患者化疗时营养风险发生率分别是66.7%、69.0%、61.9%、66.7%、33.3%、56.0%,可见,不同系统肿瘤的营养风险发生率有所不同,其中消化系统肿瘤化疗患者的营养风险发生率较高,说明消化系统肿瘤患者更容易产生营养障碍,发生营养风险[10-11],临床治疗方面更需重视其营养支持的相关问题。消化系统肿瘤患者的营养风险发生率较高,与金三丽等[12]研究发现,胃肠道恶性肿瘤的营养风险发生率高于非消化系统恶性肿瘤患者营养发生率的结论一致。其原因可能是消化系统肿瘤所在位置特殊,影响胃酸、消化酶等分泌,影响营养物质的摄取和吸收;可直接诱发患者出现恶心、呕吐、腹痛、腹泻、厌食等一系列临床症状,导致患者营养不良。因此,在肿瘤患者入院时,营养师就需要采用适合的筛查工具,筛选出有营养风险且需要营养干预的患者,制定出适合每个患者的营养治疗方法,及时给予营养治疗。
恶性肿瘤患者是营养不良及营养风险的高发人群[13],机体肿瘤和临床化疗的双重作用,多数患者存在不同程度的营养不良[14]。本研究采用不同指标评价肿瘤化疗患者的营养状况,BMI<18.5者49例,占20.8%;血浆清蛋白(ALB)<30g /L者188例,占79.7%;血红蛋白(Hb)<90g /L者169例,占71.6%。可见,肿瘤化疗患者普遍存在营养不良或营养代谢紊乱,与以往研究结果一致[15-16]。但是如果在临床工作中如果进行营养状况评估时仅仅依靠简单的体质指数或单纯的血液学指标,很可能漏掉很大一部分存在营养风险的患者,因此在实际的临床工作中,应该扩大肿瘤内科营养风险筛查工作的面,对所有进行肿瘤化疗的患者都应进行营养风险评定,同时结合临床的一些化验指标等进行全面的评估,并对患者的膳食状况进行调查,确定患者的营养干预模式,同时所有临床工作者都应有及时发现患者营养不足或营养风险的意识,为积极进行营养干预提供科学依据[17-18]。
如果肿瘤患者自身已经处于营养不良的状态,再经历多次化疗后,白蛋白水平逐渐下降,机体对化疗治疗的耐受性也会降低,抗肿瘤治疗的有效性下降而并发症增加,甚至无法完成化疗疗程,影响患者生命长度[19]。这些患者营养风险的发生率较高,本研究将患者的营养风险得分与患者年龄、BMI、ALB、HGB、TP等进行相关性分析,发现营养风险与年龄呈正相关,呈现出随着年龄的增长,患者发生营养不良的概率也在增大,这和既往研究[20-21]结果一致,与HGB、ALB、BMI均呈负相关,可见,机体贫血、低蛋白血症、低体重指数都是患者出现营养风险的危险因素。因此,临床工作中关注这些危险因素,控制和降低肿瘤化疗患者营养风险的发生率应该成为临床医生及营养师们关注的重点。
有研究显示,约40%的癌症患者的死亡原因不是由于肿瘤本身,而是死于罹患肿瘤后患者自身营养不良或由营养不良进而导致的相关并发症[22-23]。因此,在积极治疗肿瘤的同时,应高度重视肿瘤患者的营养状况。因此,对住院患者进行入院时的营养风险筛查是很有必要的,有助于发现存在营养风险的患者。对有营养不良高风险的患者,在开始临床治疗后再进行进一步的评估也是非常必要的,通过早期评估、尽早干预,改善营养不良患者的营养状况,从而提高患者的抵抗力,可有效地预防和降低患者营养不良的发生率,减少营养不良引起的相关并发症,促进患者康复,缩短住院时间。综上所述,营养不良普遍存在肿瘤化疗治疗的患者中,建议相关的医务人员都应加强早期营养教育,应早期、动态进行营养状况的评定。◇
[1]梁涛,印义琼,钟静,等.胃肠道肿瘤病人营养风险的筛查[J].肠外与肠内营养,2012,19(4):218-219,222.
[2]蔡文智,盛小燕,周瑾,等.广州市某5 家医院肿瘤化疗患者营养状况及其管理分析[J]. 护理学报,2013,20(11A):6-9.
[3]蒋虹,郑玲.恶性肿瘤患者260 例营养状况评价[J].肿瘤学杂志,2010,16(10):825-826.
[4]Isenring E,Loeliger J,Hodgson B.Nutritional management of patients with cancer improves nutritional and quality of life outcomes[J]. Canc Foru,2011,35(2):88-91.
[5]Ilia P,Tomiskova M,Skrickova J.Nutritional risk screening pre-dicts tumor response in lung cancer patients[J].J Am Coll Nutr,2015,34(5):1-5.
[6]沈珏,赵擎宇,顾葆春,等.肿瘤重症患者的营养状况评估及营养支持现状分析[J].热带医学杂志,2014,14(1):52-55.
[7]Gökcan H,Selçuk H,Töre E,et al.The Nutritional Risk Screening 2002 tool for detecting malnutrition risk in hospitalised patients:perspective from a developing country[J].Turk J Gastroenterol,2014,25 (6):718-723.
[8]陈春明.中国成人体质指数分类的推荐意见简介[J].中华预防医学杂志,2001,35(5):349-350.
[9]石汉平.肿瘤营养疗法[J].中国肿瘤临床,2014,41(18):1141-1145.
[10]刘凯,马恒,李世宽,等.山东省医院普外科营养风险筛查和营养支持状况分析[J].中华普通外科学文献(电子版),2013,7(3):235-239.
[11]余艳,沈琼.胸外科术前患者营养风险及相关因素的调查[J].护理管理杂志,2012,12(3):183-184.
[12]金三丽,路潜,马玲.对胃肠道恶性肿瘤病人手术前后营养状况的研究[J].肠外与肠内营养,2013,20(2):89-92.
[13]于康,周晓容,郭亚芳.恶性肿瘤住院患者营养风险和营养不足发生率及营养支持应用状况调查[J].肿瘤学杂志,2011,17(6):408-411.
[14]Jie B,Jiang ZM,Nolan MT,et al.Impact of nutritional support on clinical outcome in patients at nutritional risk:a multicenter,prospective cohort study in Baltimore and Beijing teaching hospitals[J].Nutrition,2010,26(11 /12):1088-1093.
[15]Johnson-Down L,Labonte M E,Martin I D,et al.Quality of diet is associated with insulin resistance in the Cree (Eeyouch)indigenous population of northern Quebec[J].Nutr Metab Cardiovasc Dis,2015,25(1):85-92.
[16]Yachimski P,Hur C.Evidence-based endoscopic management of Barrett’s esophagus[J].Gastroenterol Rep (Oxf),2015,3(1):54-62.
[17]Jans C,Meile L,Lacroix C,et al.Genomics,evolution,and molecular epidemiology of the Streptococcus bovis/Streptococcus equinus complex (SBSEC)[J].Infect Genet Evol,2015,33(6):419-436.
[18]Cho J S,Baek S H,Kim J Y,et al.Serum phospholipid monounsaturated fatty acid composition and Delta-9-desaturase activity are associated with early alteration of fasting glycemic status[J]. Nutr Res,2014,34(9):733-741.
[19]王东升,夏彩宁,何立新,等.胃癌根治术后肠外肠内联合序贯营养支持疗效观察[J].河北医药,2013,35(16):2477-2478.
[20]朱跃平,丁福,刘欣彤,等.老年住院患者营养风险筛查及营养支持状况[J].中国老年学杂志,2013,33 (11):2609-2611.
[21]樊荣,邹洁,刘俊,等.50例食管癌住院患者营养状况评价及影响因素分析[J]. 中国食物与营养,2016,22(9):76-80.
[22]Zhang L,Lu Y,Fang Y.Nutritional status and related factors of patients with advanced gastrointestinal cancer[J].Br J Nutr,2014,111(7):1239-1244.
[23]Chan M,Kelly J,Batterham M,et al.Malnutrition (Subjective Global Assessment)Scores and Serum Albumin Levels,but not Body Mass Index Values,at Initiation of Dialysis are Independent predictors of mortality:a 10-year clinical cohort study[J].J Ren Nutr,2012,22(6):547-557.
