淹水胁迫对丝瓜和苦瓜幼苗形态及不定根解剖结构的影响
2018-04-04周国林彭玉全
于 斌 朱 进* 周国林 彭玉全
(1长江大学园艺园林学院,湖北荆州 434025;2武汉市农业科学技术研究院蔬菜科学研究所,湖北武汉 430065)
近年来,我国强降雨次数增加,农作物的洪涝灾害面积不断增大(杨卫忠 等,2017),洪涝灾害导致土壤处于缺氧状态(Sairam et al.,2008)。研究表明,缺氧会造成植物乙醇等有害物质积累,矿物质吸收受到阻碍,代谢紊乱等(Geigenberger,2003;Kaelke & Dawson,2003;Visser et al.,2003),最终严重影响植物的生长发育。不定根的形成是植物适应淹水环境的一个重要改变(Lin et al.,2004),不定根内发达的通气组织是植物具有耐淹水能力的重要指标之一,通气组织不仅为缺氧状态下的根呼吸提供输送氧气的通道,而且可以把植物根系组织中积累的乙醇、二氧化碳、甲烷等挥发性化合物从根部向上运输(Vartapetian & Jackson,1997)。如水芹不定根内有发达的裂生型轮辐状通气组织(张霞 等,2016);白茅不定根皮层细胞溶解形成了发达的溶生型通气组织(杨朝东 等,2015a)等。除通气组织外,不定根质外体屏障结构也可以保护植物各种生理代谢过程在稳定的环境中进行(吴小琴 等,2002;杨朝东 等,2013)。研究表明,天胡荽(杨朝东 等,2015b)、狗牙根和双穗雀稗(张霞 等,2013)的不定根均有具凯氏带且栓质化的内皮层、栓质化的外皮层等。这些屏障结构能有效阻碍进入中柱的氧气、离子、水等回流到皮层,有效阻碍通气组织内的氧气向根外扩散,为生命活动提供更多的氧气和离子(吴小琴 等,2002;杨朝东 等,2013)。因此,通气组织和屏障结构是耐淹水植物适应淹水环境的两个重要的原因。
丝瓜(Luffa cylindricaRoem.)和苦瓜(Momordica charantiaL.)同属葫芦科(Cucurbitaceae),营养丰富、药用价值高,随着近年来人们保健意识的增强,丝瓜和苦瓜的需求量逐年增多,因此栽培面积逐渐增大(Leehuang et al.,1995;Grover & Yadav,2004;Manikandaselvi et al.,2016),有关耐涝性的研究也越来越受到重视。前人研究表明,丝瓜幼苗经过淹水胁迫后根系总表面积、总长度等显著提高,且MDA含量差异不显著,说明丝瓜比较耐涝(朱进,2014)。但苦瓜幼苗经淹水胁迫后,株高、叶片数显著降低,MDA含量显著升高,其耐淹水能力有限(朱进和赵莉莉,2016)。本试验在前人研究的基础上,采用组织化学染色技术,利用普通光学显微镜及荧光显微镜技术对丝瓜和苦瓜不定根的通气组织和屏障结构的特征进行研究,旨在明确丝瓜、苦瓜幼苗适应和忍耐淹水环境的解剖结构基础,为今后以丝瓜为砧木嫁接苦瓜提高苦瓜的耐淹水能力提供理论依据。
1 材料与方法
1.1 试验材料
供试丝瓜品种为荆州本地丝瓜,苦瓜品种为香帅5号,均由福州金盛新种子有限公司生产。
1.2 试验方法
试验于2016年4月在长江大学玻璃温室和园艺植物生理实验室进行,采用双因素完全随机设计,因素一为丝瓜、苦瓜2种瓜类蔬菜,2个水平;因素二为淹水和不淹水2个水平;共4个处理,每处理50株幼苗,3次重复。
将丝瓜、苦瓜种子晒种,并用温水浸种12 h,置于30~33 ℃的恒温箱中催芽,待种子发芽后进行穴盘育苗。选取大小均一的二叶一心幼苗移至直径为20 cm、高15 cm的培养盆中进行容器育苗,直至幼苗大部分长至四叶一心时进行淹水处理(水面与子叶齐平)。在淹水0、4、8、12、16 d后,每处理随机取10株幼苗测定各项形态指标,并取完整不定根用75%酒精固定进行切片试验。
1.3 项目测定
1.3.1形态指标的测定采样前,用卷尺测量植株的株高,用游标卡尺测量子叶以下1 cm处茎粗(淹水部位)。采样后,用电子天平测定植株鲜质量。
1.3.2解剖结构的观察切片制作使用徒手切片法:在可调节放大倍数的解剖镜下,用双面刀片在距根尖20、40、60 mm处分别切片。采用甲苯胺蓝(TBO)(胡露洁 等,2016)、苏丹7B(Brundrett et al.,1991)及硫氢酸黄连素-苯胺兰对染(Brundrett et al.,1988)3种染色方法处理切片。
通气组织的观察使用甲苯胺蓝(TBO)染色法:切片浸没于0.05% TBO溶液中,染色2~3 min后,用蒸馏水清洗,盖上盖玻片,在莱卡光学显微镜(Leica DME)下观察,用数码相机(Nikon E5400,Japan)拍照记录。
栓质化的观察使用苏丹7B染色法:切片浸没于0.1%(m/V)苏丹7B溶液1 h或过夜。切片用蒸馏水洗几次,用吸水纸吸净,滴加1滴蒸馏水,盖上盖玻片,在莱卡光学显微镜下观察,用数码相机拍照记录。
凯氏带的观察使用硫氢酸黄连素-苯胺兰对染法:切片浸没于0.1%(m/V)硫氢酸黄连素溶液1 h后,用蒸馏水洗净,滴加0.5%(m/V)苯胺兰溶液0.5 h后,用蒸馏水洗净,滴加1滴蒸馏水,盖上盖玻片,在荧光显微镜(Olympus Ⅸ71)蓝色激发光下观察并拍照记录。
1.4 数据及图片处理
试验数据采用SAS 9.1软件进行分析;图片采用Photoshop 6.0软件进行处理。
2 结果与分析
2.1 淹水胁迫对丝瓜和苦瓜幼苗生长指标的影响
从表1可以看出,丝瓜幼苗淹水胁迫12 d内,株高、叶片数及鲜质量与对照差异不显著,淹水胁迫16 d后上述指标才显著低于对照,其中株高下降了30.89%,叶片数下降了19.23%,鲜质量下降了20.73%。而苦瓜幼苗淹水胁迫下株高、叶片数及鲜质量均显著低于对照,淹水胁迫4、8、12、16 d后株高分别比对照降低10.90%、30.94%、46.97%、54.77%,叶片数分别降低13.95%、13.33%、17.39%、43.02%,鲜质量分别下降了19.47%、47.66%、49.14%、71.95%。在同一时期,苦瓜幼苗株高、叶片数及鲜质量的下降率均高于丝瓜幼苗,说明淹水胁迫对苦瓜幼苗株高、叶片数及鲜质量的抑制程度明显高于丝瓜。
淹水胁迫8、12、16 d后,丝瓜幼苗淹水部位茎粗显著高于对照,分别增长了48.00%、37.58%、54.88%,而淹水胁迫下苦瓜幼苗淹水部位茎粗与对照差异不显著。说明淹水胁迫使丝瓜幼苗淹水部位茎部变粗,但对苦瓜幼苗无明显影响。
2.2 淹水胁迫对丝瓜和苦瓜幼苗不定根解剖结构及屏障结构的影响
图1为距根尖20 mm处(不定根幼嫩部位)显微结构。淹水胁迫16 d后,丝瓜幼苗不定根皮层细胞连接松散,存在大量裂生型气腔,部分皮层细胞拉伸变长,产生大面积气腔(图1-A),但丝瓜对照皮层细胞未出现拉伸变长现象(图1-D);苦瓜幼苗淹水胁迫16 d与对照不定根皮层细胞连接均紧实,仅有少量细胞间隙存在(图1-G、J)。与对照相比,淹水丝瓜幼苗不定根内皮层出现凯氏带(图1-B)且栓质化(图1-C),而丝瓜对照内皮层不具凯氏带(图1-E),也未栓质化(图1-F)。苦瓜幼苗淹水16 d后,不定根内皮层未出现凯氏带(图1-H),也未栓质化(图1-I),与对照相同(图1-K,L)。
图2为苦瓜幼苗距根尖40 mm处不定根显微结构。淹水苦瓜幼苗皮层与距根尖20 mm处无明显变化(图2-A),与对照相同(图2-D)。与20 mm处相比,淹水苦瓜不定根内皮层具微弱凯氏带(图2-B),且轻微栓质化(图2-C);而对照内皮层不具凯氏带(图2-E),也未栓质化(图2-F)。说明淹水苦瓜幼苗不定根在距根尖40 mm处才出现类似丝瓜幼苗距根尖20 mm处的内外侧屏障结构。
图3为距根尖60 mm处(不定根成熟部位)显微结构,与对照相比,淹水丝瓜幼苗不定根表皮出现多处裂口,外皮层3~4层细胞全部向外拉伸变长形成发达的通气组织(图3-A),但对照未出现皮层细胞拉伸变长现象(图3-D);淹水苦瓜幼苗不定根仍未出现发达的通气组织(图3-G),与对照相同(图3-J)。与对照相比,淹水丝瓜与苦瓜幼苗不定根内皮层均具明显凯氏带(图3-B,H)且栓质化(图3-C,I),而对照仅具微弱凯氏带(图3-E,K)且轻微栓质化(图3-F,L)。说明淹水胁迫下丝瓜与苦瓜幼苗不定根成熟部位内侧屏障结构均为内皮层具凯氏带且栓质化;区别在于丝瓜不定根成熟部位皮层有发达的通气组织,但苦瓜没有。
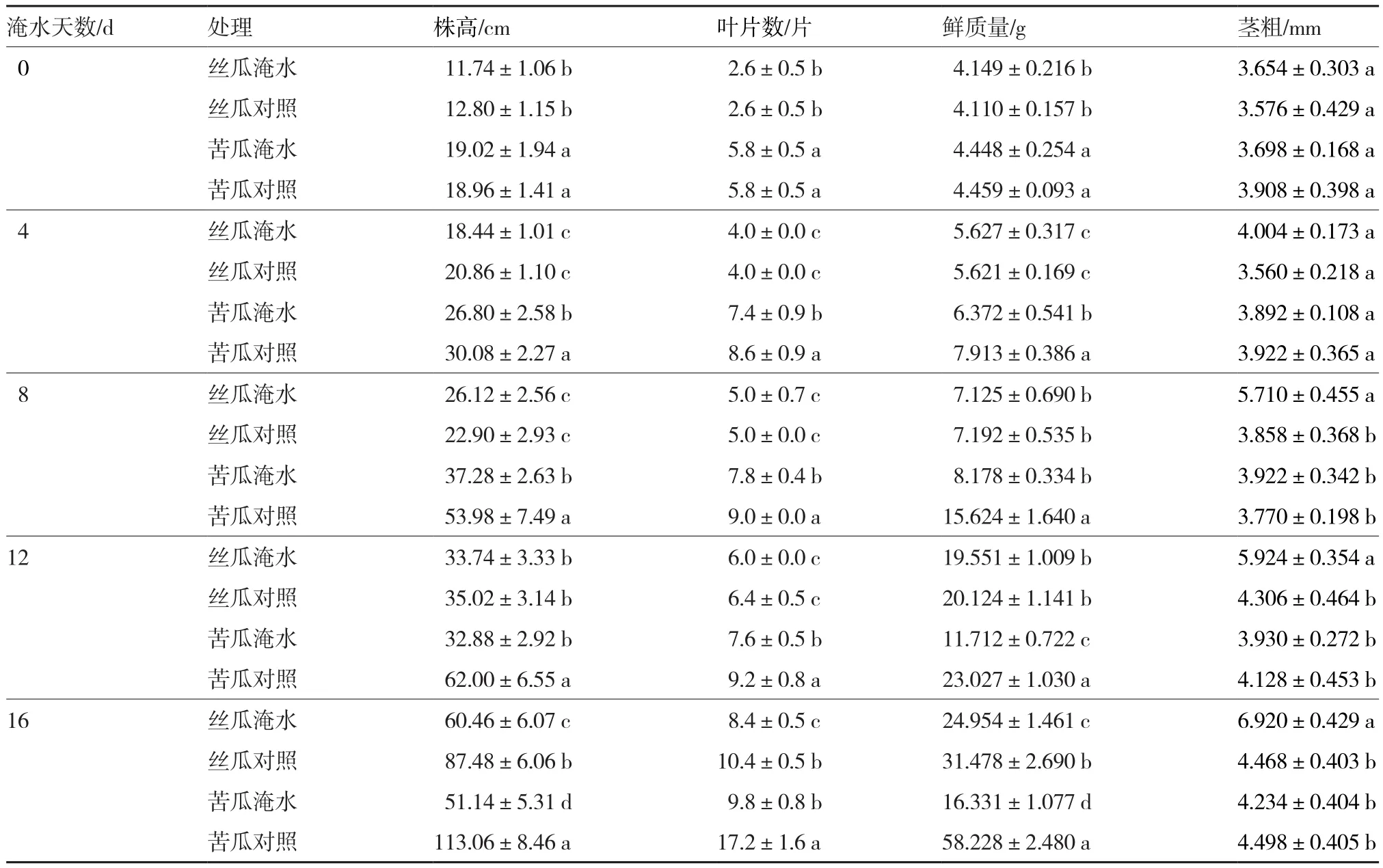
表1 淹水胁迫对丝瓜和苦瓜幼苗生长指标的影响

图1 丝瓜与苦瓜幼苗距根尖20 mm处不定根显微结构(标尺= 50 μm)

图2 苦瓜幼苗距根尖40 mm处不定根显微结构(标尺= 50 μm)

图3 丝瓜与苦瓜幼苗距根尖60 mm处不定根显微结构(标尺= 50 μm)
3 结论与讨论
3.1 淹水胁迫对丝瓜与苦瓜幼苗形态的影响
许多植物淹水后生长受到抑制,耐淹水植物受到的生长抑制较小或不明显(Thomas et al.,2005;Ahsan et al.,2007;Linet al.,2013;Yin & Komatsu,2015)。本试验中,丝瓜幼苗淹水胁迫12 d内株高、叶片数及鲜质量与对照差异不显著,淹水胁迫16 d才显著低于对照,但苦瓜幼苗淹水胁迫4 d后株高、叶片数及鲜质量均显著低于对照,且随淹水时间的延长抑制程度逐渐加重,这与前人的研究结果一致(朱进,2014;朱进和赵莉莉,2016),说明丝瓜比苦瓜耐淹,淹水后丝瓜形成的不定根比苦瓜粗而密集。丝瓜幼苗淹水胁迫8 d后茎粗显著高于对照,但苦瓜幼苗茎粗则与对照无显著性差异,可能是由于丝瓜幼苗淹水后茎部形成通气组织所致。
3.2 淹水胁迫对丝瓜与苦瓜幼苗不定根解剖结构的影响
不定根形成发达的通气组织是耐淹植物适应淹水环境的重要原因之一(Vartapetian & Jackson,1997;潘澜 等,2011)。据报道,丝瓜幼苗淹水后不定根皮层细胞拉伸变长,产生发达的通气组织(Shimamura et al.,2007),本试验中,淹水后丝瓜不定根中既出现裂生性气腔,又出现皮层细胞拉伸变长产生的气腔,并从根尖到基部方向细胞拉伸程度越来越大,且由此产生的气腔逐渐占主导地位。这些气腔形成丝瓜幼苗根系有氧呼吸的重要结构,既可以运输氧气,满足丝瓜幼苗根系生理活动对氧气的需求,还可以把根系组织中积累的乙醇、二氧化碳、甲烷等挥发性化合物从根部向上运输(Vartapetian & Jackson,1997)。本试验还发现,丝瓜幼苗不定根漂浮于水面,且表皮有大量裂口,这些裂口形成通气组织与外界空气进行气体交换的快捷通道,进一步方便了丝瓜幼苗根系的氧气获取及有害气体的排放。而苦瓜幼苗不定根最终未能形成发达的通气组织,不具备较强的氧气获取及有害气体释放能力,因此丝瓜幼苗不定根内发达的通气组织是丝瓜幼苗比苦瓜幼苗耐淹的主要原因之一。
3.3 淹水胁迫对丝瓜与苦瓜幼苗不定根屏障结构的影响
除通气组织外,不定根质外体屏障结构也具有保护植物生理功能的作用,保证植物内部各种生理代谢过程在稳定的环境中进行(Armstrong et al.,2000;Soukup et al.,2007)。本试验中:与对照相比,淹水后丝瓜与苦瓜幼苗不定根内的屏障结构均提前出现。这些屏障结构能有效阻碍进入中柱的氧气、离子、水等回流到皮层,为生命活动提供更多的氧气和离子(吴小琴 等,2002;杨朝东 等,2013)。不同之处在于,丝瓜不定根在距根尖20 mm处就出现了具有明显凯氏带和栓质化的内皮层,而苦瓜在距根尖40 mm处才出现具有微弱凯氏带和栓质化的内皮层。丝瓜幼苗不定根在距根尖20~40 mm处拥有明显的内侧屏障结构,可以保证丝瓜不定根幼嫩部位(距根尖20~40 mm处)中柱内的氧气、离子等不扩散出去,而苦瓜不定根同部位不具备此结构。说明丝瓜不定根距根尖20~40 mm处的内侧屏障结构是丝瓜比苦瓜耐淹的主要原因之一。
3.4 小结
淹水胁迫下丝瓜与苦瓜幼苗的株高、叶片数、鲜质量等形态指标说明了丝瓜幼苗比苦瓜幼苗耐淹水的能力强。丝瓜幼苗不定根内发达的通气组织与距根尖20~40 mm处屏障结构是丝瓜比苦瓜耐淹的两个主要原因。
胡露洁,杨朝东,袁龙义,刘志雄,邓楚洪,谭文胜,张霞.2016.茶树品种利川红不定根的解剖和屏障结构时空发育特征研究.湖北农业科学,55(14):3662-3665.
潘澜,薛晔,薛立.2011.植物淹水胁迫形态学研究进展.中国农学通报,27(7):11-15.
吴小琴,朱锦懋,王钦丽,胡玉熹,林金星.2002.植物凯氏带的研究进展.植物学报,19(3):302-309.
杨朝东,张霞,刘国锋,张俊卫,包满珠,周志翔.2013.植物根中质外体屏障结构和生理功能研究进展.植物研究,33(1):114-119.
杨朝东,李守峰,邓仕明,姚兰,袁龙义,张霞.2015a.白茅解剖结构和屏障结构特征研究.草业学报,24(3):213-218.
杨朝东,李守峰,姚兰,艾训儒,蔡小东,张霞.2015b.天胡荽的解剖和屏障结构特征研究.草业学报,24(7):139-145.
杨卫忠,张葆蔚,符日明.2017.2016年洪涝灾情综述.中国防汛抗旱,27(1):26-29.
张霞,杨朝东,宁国贵.2013.狗牙根和双穗雀稗根中质外体屏障结构发育过程的比较研究.湖北农业科学,52(20):4991-4994.
张霞,胡露洁,周存宇,杨朝东.2016.水芹适应湿地环境的解剖和屏障结构组织化学特征研究.中国蔬菜,(7):52-58.
朱进.2014.涝渍胁迫对丝瓜幼苗生长的影响.湖北农业科学,53(9):2067-2069.
朱进,赵莉莉.2016.淹水胁迫对苦瓜幼苗生长、丙二醛含量和SOD活性的影响.湖北农业科学,55(3):655-657.
Ahsan N,Lee D G,Lee S H,Kang K Y,Bahk J D,Choi M S,Lee I J,Renaut J,Lee B H.2007.A comparative proteomic analysis of tomato leaves in response to waterlogging stress.Physiologia Plantarum,131(4):555-570.
Armstrong W,Cousins D,Armstrong J,Turner D W,Beckett P M.2000.Oxygen distribution in wetland plant roots and permeability barriersto gas-exchange with the rhizosphere:a micro-electrode and modelling study withPhragmites australis.Annals of Botany,86:687-703.
Brundrett M C,Enstone D E,Peterson C A.1988.A berberineaniline blue fluorescent staining procedure for suberin,lignin,and callose in plant tissue.Protoplasma,146(2):133-142.
Brundrett M C,Kendrick B,Peterson C A.1991.Efficient lipid staining in plant material with Sudan red 7B or fluoral yellow 088 in polyethylene glycol-glycerol.Biotechnic & Histochemistry,66(3):111-116.
Geigenberger P.2003.Response of plant metabolism to too little oxygen.2003.Current Opinion in Plant Biology,6:247-256.
Grover J K,Yadav S P.2004.Pharmacological actions and potential uses ofMomordica charantia:a review.Journal of Ethnopharmacology,93(1):123-132.
Kaelke C M,Dawson J O.2003.Seasonal flooding regimes influencesurvival,nitrogen fixation,and the partitioning of nitrogenand biomass inAlnus incanassp. rugosa.Plant and Soil,254:167-177.
Leehuang S,Huang P L,Chen H C,Huang P L,Bourinbaiar A,Huang H I,Kung H F.1995.Anti-HIV and anti-tumor activities of recombinant MAP30 from bitter melon.Gene,161(2):151-156.
Lin K H,Kuo W S,Chiang C M,Hsiung T C,Chiang M C,Lo H F.2013.Study of sponge gourd ascorbate peroxidase and winter squash superoxide dismutase under respective flooding and chilling stresses.Scientia Horticulturae,162(3):333-340.
Lin K H R,Weng C C,Lo H F,Chen J T.2004.Study of the root antioxidative system of tomatoes and eggplants under waterlogged conditions.Plant Science,167:355-365.
Manikandaselvi S,Vadivel V,Brindha P.2016.Review onLuffa acutangulaL.:ethnobotany,phytochemistry,nutritional value and pharmacological properties.International Journal of Current Pharmaceutical Review & Research,7(3):151-155.
Sairam R K,Kumutha D,Ezhilmathi K,Deshmukh P S,Srivastava G C.2008.Physiology and biochemistry of waterlogging tolerance inplants.Biologia Plantarum,52(3):401-412.
Shimamura S,Yoshida S,Mochizuki T.2007.Cortical aerenchyma formation in hypocotyl and adventitious roots ofLuffa cylindricasubjected to soil flooding.Annals of Botany,100(7):1431-1439.
Soukup A,Armstrong W,Schreiber L,Franke R,Votrubov á O.2007.Apoplastic barriers to radial oxygen loss and solute penetration:a chemical and functional comparison of the exodermis of two wetland species,Phragmites australisandGlyceria maxima.New Phytologit,173:264-278.
Thomas A L,Guerreiro S M C,Sodek L.2005.Aerenchyma formation and recovery from hypoxia of the floodedroot system of nodulated soybean.Annals of Botany,97:1191-1198.
Vartapetian B B,Jackson M B.1997.Plant adaptation to anaerobic stress.Annals of Botany,79:3-20.
Visser E J W,Voesenek L A C J,Vartapetian B B,Jackson M B.2003.Flooding and plant growth.Annals of Botany,91:107-109.
Yin X,Komatsu S.2015.Quantitative proteomics of nuclear phosphoproteins in the root tip of soybean during the initial stages of flooding stress.Journal of Proteomics,119(4):183-195.
