北京、山东和广东黄瓜病毒检测
2018-04-04史利雪张圣平薄凯亮顾兴芳
史利雪 张圣平 苗 晗 薄凯亮 谢 庆 王 烨 顾兴芳
(中国农业科学院蔬菜花卉研究所,北京 100081)
黄瓜(Cucumis sativusL.)是我国重要的保护地栽培蔬菜之一。近年来,病毒病已成为影响黄瓜生产的重要病害,黄瓜受到病毒侵染后,早期心叶出现明脉,逐渐引起花叶和重花叶,严重时叶片皱缩畸形,有的果实呈螺旋状扭曲,果面凹凸不平,果肉僵硬且苦涩,产量和品质严重降低(周健,2012;田桂丽,2015)。
关于侵染葫芦科作物病毒病的各种病毒种类,Lovisolo(1980)首次报道了侵染葫芦科作物的病毒有25种。国际病毒分类委员会(ICTV)在第七次分类报告中指出,经确认的能侵染葫芦科作物的病毒有38个确定种、9个暂定种和1个类病毒确定种(古勤生 等,2002)。顾兴芳等(2005)报道了从瓜类作物上分离和鉴定的病毒有28种,侵染黄瓜的主要有7种。Romay等(2014)的研究表明,在自然条件下侵染葫芦科作物的病毒至少有59种。
目前,在国内发现侵染黄瓜的病毒主要有:西瓜花叶病毒(WMV)、黄瓜花叶病毒(CMV)、小西葫芦黄花叶病毒(ZYMV)、番木瓜环斑病毒(PRSV)、黄瓜绿斑驳花叶病毒(CGMMV)、南瓜花叶病毒(SqMV)和瓜类褪绿黄化病毒(CCYV)等(古勤生 等,2003;陈红运 等,2006;青玲 等,2010;Gu et al.,2011)。李淑菊等(2003)利用RT-PCR技术对天津98份黄瓜病毒病样本进行病毒种类检测,结果表明,天津地区黄瓜主要毒原种类有CMV、WMV、烟草花叶病毒(TMV)3种,且CMV检出率最高,存在病毒复合侵染现象。文朝慧和南志标(2013)对甘肃省河西地区瓜类作物病毒病进行鉴定,发现该地区瓜类病毒病主要病原为WMV、CMV、ZYMV和PRSV,自然条件下常发生复合侵染。熊艳等(2017)采用RT-PCR法对采自重庆地区的黄瓜病毒病样品进行病毒种类检测,检测到CMV、WMV、ZYMV、SqMV和芜菁花叶病毒(TuMV)5种病毒,且为4种病毒以上的复合侵染。
到目前为止,关于黄瓜主要病毒种类的检测仍然不够系统,这给生产上防治黄瓜病毒病带来困难。本试验在北京顺义和昌平、山东寿光及广东深圳地区采集了284份黄瓜病毒病样本,并采用酶联免疫吸附(ELISA)法对病毒样本进行鉴定,从而确定这些地区黄瓜病毒病的发病情况和毒原种类,为病毒病的防治和抗病育种工作提供依据。
1 材料与方法
1.1 样品采集
本试验于2017年分别在北京顺义和昌平地区、山东寿光、广东深圳等黄瓜生产田,采集具有病毒病症状的黄瓜幼嫩叶片和果实作为样品,将采集后的样品放入冰盒中,带回实验室放入-70 ℃冰箱保存备用。
1.2 病毒病的ELISA检测
采用酶联免疫吸附(ELISA)法对黄瓜叶片的病毒种类进行检测。购买了5种常见黄瓜病毒病ELISA试剂盒,分别为WMV、CMV、ZYMV、PRSV、CGMMV。具体操作步骤如下:
① 包被抗体:取包被抗体加入包被缓冲液(Coat Buffer),混合,吸取100 μL⋅孔-1抗体溶液于微孔板,酶标板于湿润盒中室温培养4 h,或冰箱中4 ℃过夜进行孵育,洗板。
② 加待测样品:按照1∶10的比例在待测样品中加入提取缓冲液(GEB),研磨后收集到离心管,3 000 r⋅min-1离心5 min,取上清液,吸取100 μL⋅孔-1加于酶标板中。室温培养2 h,或4℃过夜进行孵育,洗板。
③ 加酶标抗体:分加酶标抗体溶液,吸取100 μL⋅孔-1溶液于酶标板中。室温培养2 h进行孵育,洗板。
④ 加酶反应底物显色:其PNP底物,用PNP缓冲液溶解,吸取100 μL⋅孔-1底物溶液于酶标板中。在湿润盒中培养60 min。
⑤ 检测:采用酶标仪测定法,使用分光光度计,分别测定其在405 nm下的OD值,样品OD值/阴性对照OD值≥2.0,则该样品判断为阳性,反之,则为阴性。
1.3 数据分析
利用Excel 2007软件进行数据统计,采用单方面分类的方差分析法对北京顺义和昌平地区检测到的病毒进行差异显著性分析,所用软件为SAS 9.2分析软件。
2 结果与分析
2.1 黄瓜病毒病的发病情况
本试验共采集到黄瓜感病样品284份,其中顺义126份、昌平124份、寿光28份、深圳6份。感病材料症状主要表现为叶片重花叶,皱缩畸形,果实表面斑驳畸形(图1),发病后期整体植株矮化,结果率低。调查发现,在顺义地区采集的126份感病黄瓜材料叶片均有感病症状,其中38份材料的果实有病症;在昌平地区采集的124份感病样品的叶片都有感病症状,有33份材料的果实有病症。在寿光地区采集的28份黄瓜材料中,叶片均有感病症状,果实无病症。深圳地区感病材料大部分为水果型黄瓜,且叶片有症状,果实无病症。

图1 黄瓜病毒病田间症状
2.2 黄瓜病毒种类的差异与比较
对北京顺义和昌平、山东寿光及广东深圳采集到的284份黄瓜感病材料进行ELISA检测,结果表明,在北京顺义和昌平地区的感病叶片上均检测出CMV、WMV、ZYMV 3种,在感病的黄瓜果实上只检测出CMV病毒。在顺义地区,CMV的检出率最高,为100.00%,WMV、ZYMV的检出率分别为51.59%、80.95%。在昌平地区,CMV的检出率同样最高,为100.00%,WMV、ZYMV的检出率分别为53.23%、66.94%。北京顺义和昌平地区黄瓜病毒病的病毒种类没有差异,均为CMV、WMV、ZYMV,这2个地区CMV、WMV的检出率差异不大,但ZYMV的检出率具有显著差异(表1)。
在山东寿光采集的感病叶片上检测到CMV、WMV、ZYMV、PRSV 4种 病 毒, 且CMV的 检出 率 最 高, 为 100.00%,WMV、ZYMV、PRSV的检出率分别为35.71%、35.71%、17.86%。在深圳地区采集的6份黄瓜感病材料中,检测到CMV、WMV、PRSV 3种病毒,其检出率分别为100.00%、50.00%、50.00%(表1)。
2.3 黄瓜病毒复合侵染分析
ELISA检测结果显示,顺义和昌平地区分别有122份(96.83%)和104份(83.87%)材料检测到2种或2种以上的病毒,说明北京地区黄瓜病毒种类比较丰富,复合侵染率很高。在黄瓜病毒复合侵染中,CMV和ZYMV的复合检出率最高,在顺义和昌平分别为45.24%和30.65%;另外,CMV和WMV的复合检出率分别为15.87%和16.93%,WMV和ZYMV的复合检出率分别为0和1.61%。CMV、WMV、ZYMV 3种病毒的复合侵染率分别为35.71%和34.68%(表2)。
寿光地区有17份(60.71%)材料检测到2种或2种以上的病毒,其中CMV和WMV的复合检出率为25.00%,CMV和ZYMV的复合检出率为17.85%,CMV、ZYMV、PRSV 3种病毒的复合检出率为7.14%,CMV、WMV、ZYMV、PRSV 4种病毒的复合侵染率为10.71%(表2)。
深圳地区有3份(50%)材料检测到2种或2种以上的病毒,其中CMV、WMV的复合检出率为16.67%,CMV、WMV、PRSV 3种病毒的复合侵染率为33.33%(表2)。
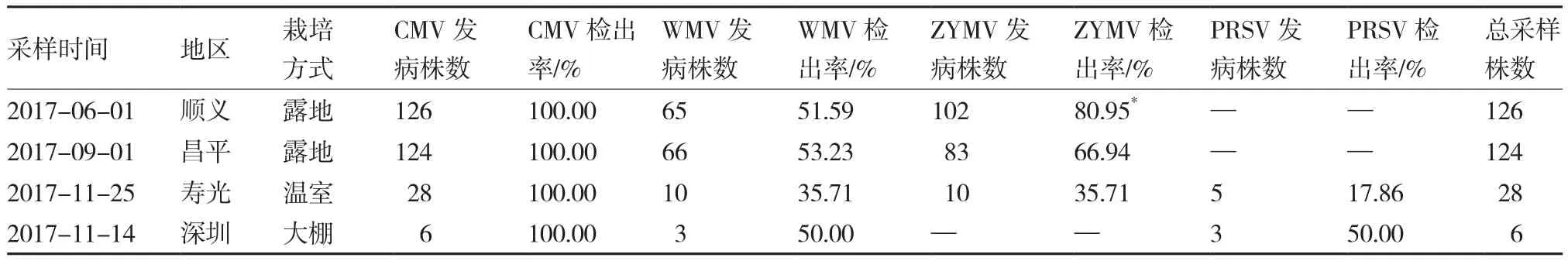
表1 我国不同地区黄瓜病毒病发病情况

表2 黄瓜病毒病复合侵染类型和检出率
3 结论与讨论
近年来,病毒病严重影响黄瓜的产量和品质。本试验对北京露地、寿光温室、深圳大棚的黄瓜病毒病发病情况进行调查,发现病毒病对黄瓜露地栽培品种的危害最为严重,这可能与病毒病主要依靠蚜虫、粉虱等刺吸式口器昆虫传播有关(秦小庆等,2017)。由于不同病毒侵染黄瓜表现出的病症极其相似,无法根据病症判断病毒种类(David &Mizuki,1987),因此本试验利用ELISA检测法对北京、寿光及深圳地区黄瓜病毒病进行病毒种类鉴定,结果发现,在这3个地区均检测出CMV且检出率最高,在北京感病黄瓜果实上也检测出CMV,说明CMV是北京、寿光及深圳的黄瓜优势病毒。
李淑菊等(2003)对天津黄瓜病毒病进行病毒种类鉴定,发现该地区黄瓜主要毒原种类有CMV、WMV、TMV 3种病毒,且存在病毒复合侵染。熊艳等(2017)对重庆地区黄瓜病毒病进行病毒种类检测,检测到CMV、WMV、ZYMV、SqMV和TuMV 5种病毒,同样存在复合侵染。以上研究结果与本试验黄瓜病毒病发病情况和病毒种类具有一定的相似性。并且我国大部分地区存在黄瓜田间病毒复合侵染现象(熊艳 等,2014;Hameed et al.,2014;Abrahamian et al.,2015)。
本试验在不同地区的黄瓜上检测出不同的病毒种类,可能是病毒的毒源分布具有地区性的原因。ZYMV的检出率在北京顺义和昌平地区存在一定的差异,这可能与当地的环境、气候条件、昆虫的种类有关。黄瓜绿斑驳花叶病毒(CGMMV)是严重威胁葫芦科作物生产的重要种传病毒,是我国农业植物检疫性有害生物和进境检疫性有害生物,本试验在北京、山东及广东地区并未检测到该病毒。本试验只采用了5种常见黄瓜病毒抗体对我国北京、山东及广东地区黄瓜病毒病进行检测,还需进一步鉴定是否存在其他病毒。
陈红运,白静,朱水芳.2006.黄瓜绿斑驳花叶病毒辽宁分离物外壳蛋白基因与3′非编码区的序列分析.中国病毒学,21(5):516-518.
古勤生,范在丰,李怀方.2002.葫芦科作物病毒名录.中国西瓜甜瓜,(1):45-47.
古勤生,Piero Roggero,Marina Ciuffo,Riccardo Lenzi,黄学森,李怀方.2003.我国北方地区葫芦科作物病毒病的调查与病原鉴定.云南农业大学学报,18(4):88-89.
顾兴芳,张圣平,冯兰香,杨宇红,杨翠荣.2005.黄瓜抗病毒病材料的鉴定与筛选.中国蔬菜,(6):21-23.
李淑菊,王慧哲,霍振荣,庞金安.2003.利用RT-PCR对黄瓜病毒病毒原种类进行检测.华北农学报,19(3):100-102.
秦小庆,冯妮,吉根林,刘园.2017.黄瓜病毒病综合防控.西北园艺,(5):53-54.
青玲,包凌云,周常勇.2010.重庆南瓜病毒病病原ELISA检测及CMV变异分析.园艺学报,37(3):405-412.
田桂丽.2015.黄瓜抗西瓜花叶病毒和番木瓜环斑病毒基因定位研究〔硕士论文〕.北京:中国农业科学院.
文朝慧,南志标.2013.甘肃省河西地区瓜类作物病毒病的病原鉴定.西北农林科技大学学报:自然科学版,41(12):131-137.
熊艳,周常勇,李茵.2014.Pa LCu CNV和TYLCCNV复合侵染引起更严重的番茄黄化曲叶病.园艺学报,41(2):268-276.
熊艳,孙淼,王鹤冰,向华丰,陈新中,张洪成,青玲.2017.重庆黄瓜病毒病病原分子鉴定及序列分析.农业生物技术学报,25(4):650-658.
周健.2012.黄瓜西瓜花叶病毒病(WMV)抗性的遗传研究和基因定位〔硕士论文〕.青岛:青岛农业大学.
Abrahamian P,Sobh H,Seblani R,Yusuf A J.2015.Co-infection of two criniviruses and a begomovirus enhances the disease severity in cucumber.European Journal of Plant Pathology,142(3):521-530.
David R F,Mizuki M K.1987.Detection of cucurbit viruses in New Jersey.Plant Disease,71(1):40-44.
Gu Q S,Liu Y H,Wang Y H.2011.First report ofCucurbit chlorotic yellows virusin cucumber,melon and watermelon in China.Plant Disease,95(1):73.
Hameed A,Iqbal Z,Asad S.2014.Detection of multiple potato viruses in the field suggests synergistic interactions among potato viruses in Pakistan.The Plant Pathology Journal,30(4):407-415.
Lovisolo O.1980.Virus and viroid disease of cucurbits.Acta Horticultirae,88:33-82.
Romay G,Lecoq H,Geraud-Pouey F,Chirinos D T,Desbiez T.2014.Current status of cucurbit viruses in Venezuela and characterization of Venezuelan isolates ofZucchini yellow mosaic virus.Plant Pathology,63(1):78-87.
