人结直肠癌耐药细胞株HCT-8/L-OHP的构建及HOXB8过表达的探讨
2018-04-03徐宗斌张逸羿卢星榕
徐宗斌, 张逸羿, 卢星榕, 池 畔
结直肠癌(colorectal cancer, CRC)是临床最常见的恶性肿瘤之一,在全世界癌症相关死亡原因中排第3位[1]。2011年我国CRC的发病率和病死率分别为23.03/100 000和11.11/100 000,且发病率较以往明显升高,多数患者确诊时已属中晚期[2]。2017年美国国立综合癌症网络(national comprehensive cancer network,NCCN)指南推荐,晚期转移性结肠癌(metastatic colorectal cancer, mCRC)患者采取以手术为主、化疗为辅的综合治疗方案,含有奥沙利铂(L-OHP)的FOLFOX及CAPOX方案为一线化疗方案。然而,采用标准化治疗方案的晚期患者5年生存率不足10%[3],主要原因是肿瘤细胞对化疗药物的抵抗作用,导致L-OHP的应用受到较大的限制。目前,针对L-OHP耐药的研究仍缺乏有效进展,其耐药机制仍在探索中。
HOX基因又名Ⅰ型同源异形盒基因,是一类在进化上高度保守的基因家族。HOX基因通过调控凋亡、增殖等参与脊椎动物胚胎发育和器官形成过程。近年研究发现,HOX基因表达的改变与肿瘤的发生、发展密切相关[4]。笔者前期研究显示,在术前接受含L-OHP化疗方案的mCRC患者中,基因芯片发现响应与不响应组中HOXB8基因呈现显著的差异表达,免疫组织化学检测也验证了上述发现[5-6]。但目前尚无研究显示,HOXB8在肠癌耐药细胞系中是否有相同的差异表达。因此,本研究拟建立人CRC的L-OHP耐药细胞模型,并初步探讨HOXB8在耐药细胞株的表达是否存在差异,为进一步探索L-OHP的耐药机制打下基础。
1 材料与方法
1.1材料 人CRC细胞HCT-8(上海吉凯基因化学技术有限公司);1640培养液(美国Gibco公司);标准胎牛血清(厦门鹭隆生物工程材料有限公司);TRIzol、cDNA合成试剂盒(美国Invitrogen公司);噻唑蓝(MTT,中国上海华舜生物工程有限公司);AnnexinⅤ-cy5凋亡和周期检测试剂盒(美国BD Pharmingen公司);qPCR扩增试剂盒(上海诺伦生物医药技术有限公司),PCR各引物由上海生工生物公司合成;兔抗人多药耐药相关蛋白(multidrug resistance-associated protein, MRP)、核苷酸切除修复交叉互补基因1(excision repair cross completion gene 1, ERCC1)、P-糖蛋白(P-glycoprotein, P-gp)、谷胱甘肽-巯基-转移酶-π(glutathione-s-transferase-π, GST-π)及HOXB8单克隆抗体(美国Abcam公司);辣根酶标记山羊抗兔IgG二抗(北京中杉金桥生物技术有限公司)。
1.2方法
1.2.1细胞培养及HCT-8/L-OHP的建立 癌细胞株HCT-8培养于含10%胎牛血清的1640完全培养液中。取对数生长期的细胞,调整细胞密度为1×105mL-1,加入终浓度为2 μmol/L(约1/3 IC50)的L-OHP培养液连续作用48 h,弃上清液,加入不含L-OHP的新鲜培养液继续培养,待细胞恢复正常生长后,消化传代,复用2 μmol/L的L-OHP溶液连续作用48 h。重复上述步骤,一个浓度反复3~4次,如此反复换液、传代,逐步提高L-OHP的浓度至20 μmol/L,最终获得能耐受20 μmol/L L-OHP的细胞株,并将其维持培养在含10 μmol/L L-OHP的完全培养液中,建立人CRC耐药细胞株HCT-8/L-OHP,直至细胞可在含10 μmol/L的 L-OHP培养液中稳定生长。对应的野生细胞进行同样的传代,但不加药处理。
1.2.2MTT法检测各种抗癌药的细胞毒作用 取对数生长期的HCT-8和HCT-8/L-OHP细胞,消化离心后调整细胞浓度为5×104mL-1。每孔100 μL细胞悬液接种于96孔培养板。培养24 h后,加入倍比稀释成5种浓度的各种抗癌药物[L-OHP,5-氟尿嘧啶(5-FU)、伊立替康(CPT-11)、顺铂(CDDP)及长春新碱(VCR)]各20 μL,每一浓度重复5孔,并设置空白对照和隐形对照组。培养48 h后,吸去上清液,每孔加无血清培养液200 μL及5 mg/mL的MTT 20 μL,继续培养4 h,吸去上清液,每孔加100 μL的DMSO,置于微量振荡器上振荡5 min,在570 nm波长处计算各组的IC50。
1.2.3细胞形态学观察 (1)光镜观察:收集HCT-8和HCT-8/L-OHP细胞,接种至内铺小玻片的24孔培养板内,培养72 h后,光镜下观察、拍照。(2)透射电镜观察:收集HCT-8和HCT-8/L-OHP细胞,用2.5%戊二醛固定,继续用2%四氧化锇固定,脱水、包埋、切片和染色,透射电镜观察、拍照。
1.2.4细胞群体倍增时间和细胞生长曲线测定 取对数生长期的HCT-8和HCT-8/L-OHP细胞,消化离心,制成细胞悬液,调整细胞浓度为5×104mL-1。取2 mL细胞悬液接种至25 mL培养瓶内。自第1天开始用台盼蓝拒染法,以血球计数板进行活细胞计数,每日取3瓶细胞,计算均值,连续观察7 d。调整2种细胞浓度为5×103mL-1,接种8块96孔板,每孔200 μL(1×103),各设6个平行孔,每天用MTT法测2种细胞的吸光值。以培养时间为横坐标、吸光值为纵坐标,绘制细胞生长曲线。
1.2.5流式细胞仪(flow cytometry,FCM)分析细胞周期分布及细胞凋亡情况 收集HCT-8和HCT-8/L-OHP细胞,加入-20 ℃预冷的70%乙醇,固定1 h。将等体积的细胞悬液和PI染液混合,4 ℃下放置30 min。以激发波长为488 nm测定,并用ModFit LT2.0软件分析细胞周期分布。取HCT-8和HCT-8/L-OHP细胞,均予以20 μmol/L的L-OHP培养液作用48 h,收集培养液以及细胞,根据试剂盒说明书的操作步骤加入凋亡检测试剂,检测细胞凋亡情况。
1.2.6检测HCT-8及HCT-8/L-OHP细胞株ERCC1,ABCB1,ABCC1,GST-π及HOXB8基因的表达
1.2.6.1qPCR检测 TRIzol法提取各组总RNA,取1 μg RNA反转录为cDNA,反转录条件为:42 ℃ 60 min→70 ℃ 5 min。产物进行荧光定量PCR扩增,反应条件如下:94 ℃ 2 min,1个循环;94 ℃ 15 s→62 ℃ 40 s,40个循环。采用ΔΔCt相对定量法分析结果,差异水平用2-ΔΔCt表示。
ΔΔCt=实验组(Ct目的基因-Ct管家基因)-对照组(Ct目的基因-Ct管家基因)
GAPDH(Human):
F:5′-GGGAAACTGTGGCGTGAT-3′
R:5′-GAGTGGGTGTCGCTGTTGA-3′
ABCC1(MRP or MRP1):
F:5′-ATCTTGGTCACGCACAGCAT-3′
R:5′-GCATAGGTACGCAGGAACTCA-3′
ABCB1(P-gp):
F:5′-AACACCACTGGAGCATTGACTAC-3′
R:5′-ATTACAGCAAGCCTGGAACCTAT-3′
GSTP1:
F:5′-ACCGTGGTCTATTTCCCAGTTC-3′
R:5′-AGGTGACGCAGGATGGTATTG-3′
ERCC1:
F:5′-TTTGGCGACGTAATTCCCG-3′
R:5′-TCCGCTGGTTTCTGCTCATAG-3′
HOBX8:
F:5′-CAGACCTACAGCCGCTACCA-3′
R:5′-CGCCGCTTACGAGTCAGATA-3′
1.2.6.2Western-blot检测 细胞加入裂解液RIPA(100 μL/106个细胞)和1 μL蛋白酶抑制物PMSF,吹打冰浴30 min,4 ℃高速离心15 min,收集上清液。以20~40 μg蛋白上样量进行SDS-聚丙烯酰胺凝胶电泳,蛋白转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,TBST洗3次,每次10 min。分别加入ERCC1,ABCB1,ABCC1,GST-π及HOXB8一抗,4 ℃孵育过夜。TBST洗膜后加入羊抗鼠或羊抗兔二抗,室温孵育2 h。用Bio-Rad凝胶成像仪显影。
1.3统计学处理 采用SPSS 20.0软件进行统计学处理。计量资料采用或中位数表示,并用t检验、秩和检验进行统计学分析;计数资料采用率(或构成比)表示,采用卡方检验进行统计学分析。检验水准α设定为0.05。
2 结 果
2.1耐药细胞系构建成功鉴定
2.1.1成功建立人CRC多药耐药细胞株HCT-8/L-OHP 培养7月后,获得生长良好的、能耐受20 μmol/L L-OHP的耐药细胞株HCT-8/L-OHP,可在含10 μmol/L L-OHP的培养液中稳定生长。MTT法检测结果显示,亲本株对L-OHP的IC50值为5.78 μmol/L,耐药株的IC50为62.33 μmol/L、RI为10.78。使用未加L-OHP的培养基培养1月后,测得耐药株的IC50为56.41 μmol/L,RI为9.75。将HCT-8/L-OHP细胞冻存,3月后经细胞复苏,仍能稳定增殖和生长,IC50为58.21 μmol/L,RI为10.07,耐药性基本保持不变。HCT-8/L-OHP细胞不仅对L-OHP产生耐药性,而且对另外4种临床常用的抗癌药物(5-FU,CPT-11,CDDP及VCR)也产生不同程度的耐药性,具有多药耐药特征(表1)。
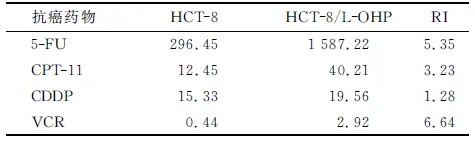
表1 HCT-8/L-OHP细胞的多药耐药检测
FU:5-氟尿嘧啶; CPT-11:伊立替康; CDDP:顺铂; VCR:长春新碱.
2.1.2HCT-8及HCT-8/L-OHP的细胞形态
2.1.2.1光镜观察 HCT-8细胞贴壁生长,呈上皮样单层排列,细胞大小一致,为圆形或椭圆形,边界清楚,胞核大而圆,颜色深,胞质内含颗粒;HCT-8/L-OHP细胞也呈上皮样单层排列,但形态发生明显改变,细胞大小不均,细胞变大,多呈梭形,部分细胞变圆,折光性变强,核大、色深、不规则(图1)。

A:HCT-8细胞(×100);B:HCT-8细胞(×200);C:HCT-8/L-OHP细胞(×100);D:HCT-8/L-OHP细胞(×200). HCT-8细胞大小一致,边界清楚;HCT-8/L-OHP细胞大小不均,呈梭形,折光性变强,核大、色深、不规则.图1 HCT-8和HCT-8/L-OHP光镜观察Fig 1 HCT-8 and HCT-8/L-OHP in light microscope
2.1.2.2透射电镜观察 HCT-8细胞核清晰,形态不规则,核仁明显,核内可见较多的常染色质,未见异染色质;线粒体丰富,其结构及板块嵴清楚完整,细胞表面微绒毛比较丰富。耐药株细胞核大,多见核畸型,染色质增多,少量异染色质,胞质内出现脂滴,线粒体出现肿胀、空泡,粗面内质网扩张,细胞表面微绒毛减少、变短(图2)。
2.1.3细胞生长曲线的绘制和细胞群体倍增时间的检测 通过MTT实验绘制生长曲线,HCT-8细胞:y=0.176 3x-0.052 8,R2=0.990 8;HCT-8/L-OHP细胞:y=0.056 1x+0.082 1,R2=0.984 4。耐药细胞增殖减慢;群体倍增时间HCT-8和HCT-8/L-OHP分别为28.76和64.57 h(图3)。
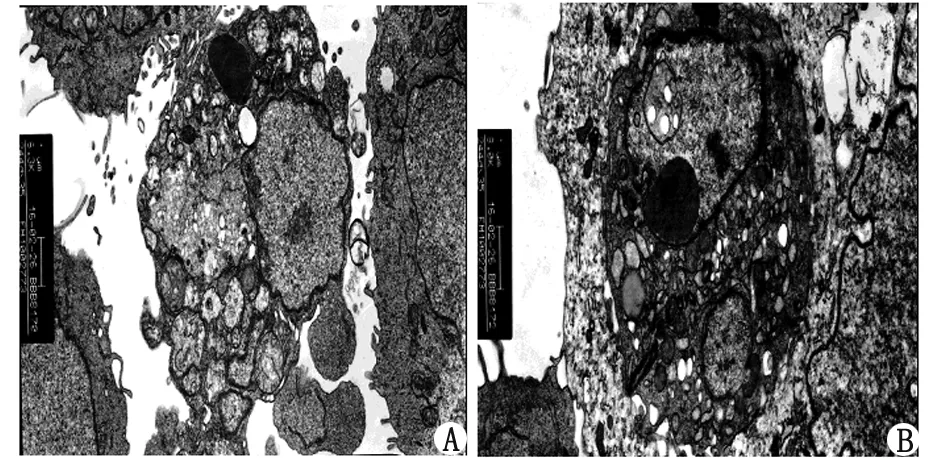
A:HCT-8细胞(×16 300); B:HCT-8/L-OHP(×28 000). HCT-8细胞核清晰,未见异染色质;HCT-8/L-OHP核大,多见核畸型,染色质增多,少量异染色质.图2 HCT-8和HCT-8/L-OHP透射电镜观察Fig 2 HCT-8 and HCT-8/L-OHP in electron microscope

HCT-8/L-OHP细胞增殖较HCT-8减慢,群体倍增时间延长.图3 HCT-8和HCT-8/L-OHP细胞的生长曲线Fig 3 The growth curve of HCT-8 and HCT-8/L-OHP
2.1.4细胞周期分布和凋亡检测
2.1.4.1细胞周期分布 细胞周期分布分析显示,HCT-8/L-OHP细胞在G2/M期所占比例(18.97%)较HCT-8细胞(4.48%)增多(P<0.01),同时在S期(26.43%)及G0/G1期(64.33%)所占比例减少,与HCT-8细胞比较,差别具有统计学意义(P<0.01)。
2.1.4.2细胞凋亡检测结果 凋亡情况检测结果显示,HCT-8/L-OHP细胞早期和晚期凋亡合计约43.47%,而HCT-8细胞的凋亡率约75.47%。提示耐药株的凋亡率明显低于亲本株,二者差别有统计学意义(P<0.01,图4)。
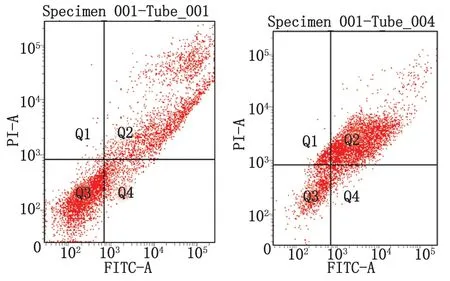
Tube001为HCT-8,Tube004为HCT-8/L-OHP.图4 HCT-8和HCT-8/L-OHP细胞凋亡情况Fig 4 The apoptosis of HCT-8 and HCT-8/L-OHP
2.2HOXB8以及ABCC1(MRP or MRP1),ABCB1(P-gp),GSTP1,ERCC1的mRNA表达情况 耐药株HCT-8/L-OHP的ABCC1(MRP or MRP1),ABCB1(P-gp),ERCC1及HOXB8的mRNA表达均上调,与亲本株HCT-8比较,差别具有统计学意义(P<0.05,表2,图5);而GSTP1 mRNA的表达二者间差别无统计学意义(P>0.05)。

表2 各基因mRNA的相对表达量
与HCT-8细胞株比较,☆:P<0.05,☆☆:P<0.01.

与HCT-8细胞株比较,☆:P<0.05,☆☆:P<0.01.图5 各基因mRNA的相对表达量Fig 5 The relative of indicate gene mRNA expression
2.3HOXB8,ABCC1(MRP or MRP1),ABCB1(P-gp),GSTP1及ERCC1蛋白表达情况 Western-blot检测结果显示,HCT-8/L-OHP细胞的HOXB8,ABCC1(MRP or MRP1),ABCB1(P-gp),GSTP1及ERCC1蛋白均呈现相对高表达,与HCT-8细胞比较,差别具有统计学意义(P<0.01,图6)。
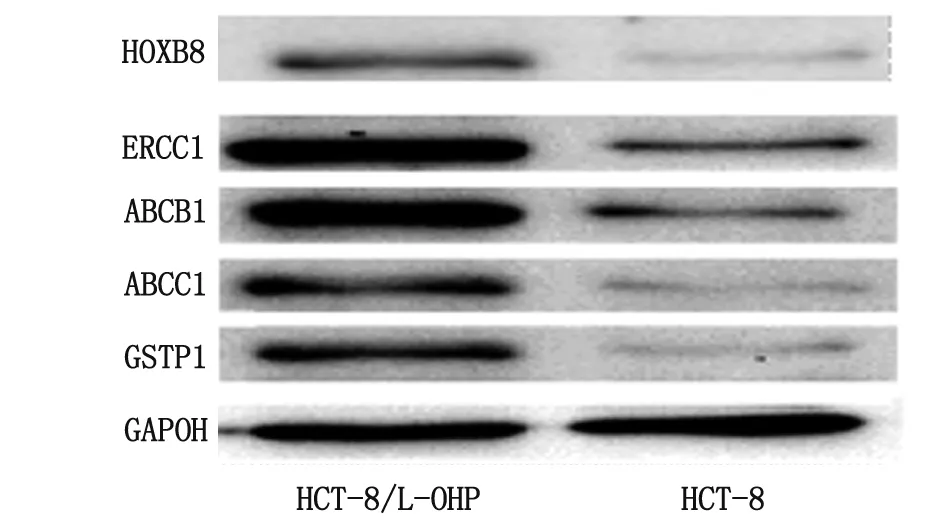
图6 各基因蛋白表达结果Fig 6 The Western-blot analysis of indicate gend
3 讨 论
CRC是临床最常见的恶性肿瘤之一,全球每年新发病例数达94.5万例,每年有近50万人死于CRC[3]。根据2017年NCCN指南,mCRC患者的标准治疗为姑息化疗,其中含L-OHP的FOLFOX及CAPOX方案为一线化疗方案,可获得近50%的缓解率[7],但仍有近一半的患者对化疗不敏感,且绝大部分初期化疗敏感的患者终因肿瘤获得性耐药导致化疗失败。因此,寻找肿瘤细胞对化疗药物抵抗的靶点,探索肿瘤细胞对化疗抵抗的机制是克服肿瘤细胞耐药性、提高化疗药物疗效的关键。成功构建能够稳定耐药的细胞系是研究耐药的产生、预防和逆转的重要研究模型[8-10]。
目前,常见的建立耐药细胞株方法有以下2种:采用递增药物浓度持续作用和恒定药物浓度周期作用来进行诱导。研究显示,前者比后者诱导细胞耐药性更强且更稳定[11]。本研究采用前者建立耐药细胞株,结果发现,耐药细胞的形态发生明显改变,细胞代谢率降低,生物活力减弱,群体倍增时间是亲本细胞株的2.25倍,说明耐药细胞株增殖速度减慢,与张立阳等的研究结果类似[12]。随着肿瘤细胞倍增时间的延长,细胞对化疗药物的敏感性降低[13]。从细胞周期的分布发现,耐药株细胞在G2/M期所占比例增多,提示细胞发生G2/M期阻滞,这与其他研究者所建立的耐药细胞株结果相似[14]。另外,细胞凋亡检测发现,耐药细胞株在相同浓度的L-OHP作用下凋亡率更低,进一步佐证了耐药细胞株对L-OHP有更强的抵抗作用。耐药细胞株不仅对L-OHP有抗性,对5-FU,CPT-11,CDDP及VCR也具有一定抗性,产生多药耐药。研究显示,5-FU及CPT-11在CRC患者体内的血药浓度常维持在30和10 μg/L左右[15-16]。本研究中耐药细胞株对5-FU及CPT-11相对耐药可达1 587.22和40.21 μg/L,可见本研究所建立的耐药细胞株可抵抗临床用药浓度。
肠癌细胞对L-OHP的抵抗可能与DNA损伤修复系统的过表达以及蛋白质差异表达相关,其中核苷酸切除修复(nucleotide excision repair,NER)过表达、膜转运体蛋白过表达以及GST-π过表达等可能通过其调控的基因及其下游事件发挥相应作用[17-19]。本研究还发现,在耐药细胞株中,ABCC1(MRP or MRP1),ABCB1(P-gp),GSTP1及ERCC1等常见耐药基因表达呈现显著性的差异上调。由于在产生对L-OHP耐药的同时,上述机制的表达异常引起耐药细胞株对其他药物产生抵抗,本研究也证实了该结果。
HOX基因家族是动物胚胎发育过程中的主控基因,目前有较多的研究证实,HOX基因表达异常与肿瘤的发生发展有关[20-23]。HOXB8基因是HOX 基因家族的成员之一,位于17p21.3,编码同源框DNA结合域的核蛋白,参与细胞的正常分化、发育。兰鸿波等研究显示,HOXB8的过表达与肿瘤的发生发展呈现正相关,并可能通过miR-196调控,miR-196可能与AKT通路的激活相关[24-25]。Ding等研究也显示,HOXB8的过表达可能与胃癌的发生发展以及转移侵袭能力呈正相关[26]。本课题组在评估接受含L-OHP方案的CRC患者的疗效时发现,在响应与不响应组中,HOXB8基因呈现显著的差异表达[5]。本研究成功构建L-OHP耐药细胞株,并通过qPCR以及Western-blot揭示了HOXB8基因在耐药细胞株呈现明显差异表达。进一步证实了HOXB8的过表达可能与L-OHP耐药相关,但尚未明确HOXB8通过何种方式调控耐药的产生。
本研究成功构建了L-OHP耐药细胞株,发现其与耐药蛋白的过表达、DNA修复系统的过表达以及GST-π过表达相关,并发现HOXB8基因在耐药株中呈现过表达,但其参与耐药机制尚需进一步研究。
[1] Edwards B K, Noone A M, Mariotto A B,etal. Annual report to the nation on the status of cancer, 1975-2010, featuring prevalence of comorbidity and impact on survival among persons with lung, colorectal, breast, or prostate cancer[J].Cancer, 2014,120(9):1290-1314.
[2] 中华人民共和国卫生和计划生育委员会医政医管局, 中华医学会肿瘤学分会. 结直肠癌诊疗规范(2015年版)[J]. 中华外科杂志, 2015,53(12):881-894.
[3] Weitz J, Koch M, Debus J,etal. Colorectal cancer[J].Lancet, 2005,365(9454):153-165.
[4] Vider B Z, Zimber A, Chastre E,etal. Deregulated expression of homeobox-containing genes, HOXB6, B8, C8, C9, and Cdx-1, in human colon cancer cell lines[J].BiochemBiophysResCommun, 2000,272(2):513-518.
[5] Li S, Lu X, Chi P,etal. Identification of HOXB8 and KLK11 expression levels as potential biomarkers to predict the effects of FOLFOX4 chemotherapy[J].FutureOncol, 2013,9(5):727-736.
[6] Shen S, Pan J, Lu X,etal. Role of miR-196 and its target gene HoxB8 in the development and proliferation of human colorectal cancer and the impact of neoadjuvant chemotherapy with FOLFOX4 on their expression[J].OncolLett, 2016,12(5):4041-4047.
[7] Goldberg R M, Sargent D J, Morton R F,etal. A randomized controlled trial of fluorouracil plus leucovorin, irinotecan, and oxaliplatin combinations in patients with previously untreated metastatic colorectal cancer[J].JClinOncol, 2004,22(1):23-30.
[8] Zhang X, Xiao W, Wang L,etal. Deactivation of signal transducer and activator of transcription 3 reverses chemotherapeutics resistance of leukemia cells via down-regulating P-gp[J].PLoSOne, 2011,6(6):e20965.
[9] Yun M, Lee D, Park M N,etal. Cinnamaldehyde derivative (CB-PIC) sensitizes chemo-resistant cancer cells to drug-induced apoptosis via suppression of MDR1 and its upstream STAT3 and AKT signalling[J].CellPhysiolBiochem,2015,35(5):1821-1830.
[10] Rad S M, Langroudi L, Kouhkan F,etal. Transcription factor decoy: a pre-transcriptional approach for gene downregulation purpose in cancer[J].TumourBiol, 2015,36(7):4871-4881.
[11] 王开雷, 李乐平, 靖昌庆. 两种人大肠癌多药耐药株的建立及耐药性比较[J]. 山东大学学报(医学版), 2011,49(4):75-79.
[12] 张立阳, 赵玉沛, 吴元德, 等. 胰腺癌阿霉素耐药细胞株SW1990/ADM的建立及其耐药机理研究[J]. 中国普外基础与临床杂志, 2005,12(1):46-50.
[13] 钱 静, 陈不尤, 刘贤称, 等. 人肺腺癌厄洛替尼耐药细胞系PC-9/ER的建立及其特性[J]. 临床与病理杂志, 2015,35(6):1080-1086.
[14] Smith V, Rowlands M G, Barrie E,etal. Establishment and characterization of acquired resistance to the farnesyl protein transferase inhibitor R115777 in a human colon cancer cell line[J].ClinCancerRes, 2002,8(6):2002-2009.
[15] 宋卫峰, 王 雷, 蔡 讯, 等. 晚期结直肠癌患者氟尿嘧啶剂量与血药浓度和生存的关系[J]. 肿瘤, 2013,33(9):820-826.
[16] 鞠晓宇, 罗雪梅, 葛卫红, 等. 高效液相色谱法测定血中伊立替康及活性代谢物SN-38浓度[J]. 药学与临床研究, 2015,23(3):267-270.
[17] Cohen R, Cervera P, Svrcek M,etal. DNA mismatch repair and BRAF status in colorectal cancer: Interest for the therapeutic management[J]?BullCancer, 2015,102(6 Suppl 1):72-81.
[18] Redmond K M, Wilson T R, Johnston P G,etal. Resistance mechanisms to cancer chemotherapy[J].FrontBiosci, 2008,13:5138-5154.
[19] Noda E, Maeda K, Inoue T,etal. Predictive value of expression of ERCC 1 and GST-p for 5-fluorouracil/oxaliplatin chemotherapy in advanced colorectal cancer[J].Hepatogastroenterology, 2012,59(113):130-133.
[20] Cillo C, Barba P, Freschi G,etal. HOX gene expression in normal and neoplastic human kidney[J].IntJCancer, 1992,51(6):892-897.
[21] Miller G J, Miller H L, van Bokhoven A,etal. Aberrant HOXC expression accompanies the malignant phenotype in human prostate[J].CancerRes, 2003,63(18):5879-5888.
[22] López R, Garrido E, Vázquez G,etal. A subgroup of HOX Abd-B gene is differentially expressed in cervical cancer[J].IntJGynecolCancer, 2006,16(3):1289-1296.
[23] De Vita G, Barba P, Odartchenko N,etal. Expression of homeobox-containing genes in primary and metastatic colorectal cancer[J].EurJCancer, 1993,29A(6):887-893.
[24] 兰鸿波, 潘 杰, 卢星榕, 等. miR-196b mRNA和HoxB8 mRNA在结直肠癌组织中的表达及其临床意义[J].中国普外基础与临床杂志, 2013,20(4):400-405.
[25] Schimanski C C, Frerichs K, Rahman F,etal. High miR-196a levels promote the oncogenic phenotype of colorectal cancer cells[J].WorldJGastroenterol, 2009,15(17):2089-2096.
[26] Ding W J, Zhou M, Chen M M,etal. HOXB8 promotes tumor metastasis and the epithelial-mesenchymal transition via ZEB2 targets in gastric cancer[J].JCancerResClinOncol, 2017,143(3):385-397.
