腰臀比性状的全基因组通路关联分析研究
2018-04-03张苗苗StruanGrantHakonHakonarsonArlenPrice李卫东焦红肖
张苗苗 ,Struan Grant,Hakon Hakonarson,R.Arlen Price,张 愿 ,李卫东 ,焦红肖
(1.天津医科大学遗传学系,天津300070;2.美国费城儿童医院应用基因组学中心,费城PA 19104;3.美国宾夕法尼亚大学医学院精神医学系,费城PA 19104;4.天津医科大学基础医学研究中心,天津300070)
腰臀比(waist to hip ratio,WHR)反映人体腹部皮下脂肪及内脏脂肪的聚集程度,是判断中心性肥胖的重要测量标准。最近研究表明,人体脂肪分布是一种重要的代谢健康量度,不同的脂肪分布与不同的代谢风险相关[1]。腰围(waist circumference,WC)与腰臀比作为判定中心性肥胖的测量指标是高度遗传的[2]。多个影响腰臀比的常见遗传变异位点已经通过全基因组关联分析研究(Genome-wide association study,GWAS)确认。Lindgren 等[3]确认 2个与WC相关的基因位点(TFAP2B和MSRA)及1个在女性中与WHR相关的基因位点(LYPLAL1)。Heid等[4]在欧洲人群中确认了14个基因位点与脂肪分布相关,其中包括已经确认的LYPLAL1基因。WHR作为复杂性状,由多种基因控制。传统的GWAS由于其有限的检测效能,一些与WHR相关的微效基因在多重检验校正后变得不显著,同时也忽略了基因之间的交互作用,致使一些利用GWAS筛选出来的基因不足以解释WHR性状的较高遗传度[4]。为了弥补传统GWAS的不足,许多新的分析方法应运而生,Wang等[5]在基因集合富集分析GSEA(Gene Set Enrichment Analysis)算法的基础上开发出应用于GWAS数据进行全基因组通路关联分析的方法GenGen[6]。本研究采用GenGen软件检测与WHR相关的基因集合/通路,通过已有的生物学通路知识确定与WHR相关的基因集合/通路,为挖掘WHR候选基因提供一定的科学依据。
1 资料与方法
1.1研究对象本研究收集1 071名无血缘关系的欧洲裔美国人作为研究对象,其中526名极度肥胖者 (BMI>35 kg/m2),545 名体质量正常者(BMI<25 kg/m2且一生中未超过25kg/m2)。极度肥胖者全部选自肥胖三联体和肥胖家系中的先证者。肥胖三联体要求父母双方至少有一个正常;肥胖家系要求同时具备肥胖同胞对和正常-肥胖同胞对。选取正常体质量者与极度肥胖者间无血缘关系,且匹配性别、年龄和地理分布。研究对象中,1 058例样本含有腰围/臀围资料,其中女性1017例,男性41例。调查取样均已征得本人同意并签署知情同意书,该研究获得美国宾夕法尼亚大学人类研究委员会批准。
1.2腰臀比分组腰臀比病例/对照分析时,根据1999年世界卫生组织WHO对中心性肥胖的诊断定义,将 WHR:男>0.90,女>0.85 样本作为病例组,WHR:男≤0.90,女≤0.85样本作为对照组。
1.3方法
1.3.1提取全基因组DNA采用高盐法获取人外周血全基因组DNA,紫外分光光度计测定DNA浓度及纯度确保质量,DNA样本于-80℃保存。
1.3.2基因分型及质量控制采用Illumina公司Illumina HumanHap 550 SNP array对大约55万个SNP位点进行基因分型,其中剔除次等位基因频率(MAF)小于0.01或哈迪-温伯格平衡(HWE)检测值小于0.001的SNP位点,共计约518 230个SNPs,17 437个基因,基因分型结果保存于Illumina BeadStudio 3.0进行整理。
1.4统计学分析应用SPSS17.0软件对样本表型资料进行统计学描述。运用GenGen软件对全基因组约55万个SNP位点进行腰臀比二分类变量(病例/对照)全基因组通路关联分析,运算方法如下:(1)经χ2检验确定病例/对照试验中每一个SNP位点对应χ2值,选取每个基因内SNP位点最大χ2值作为该基因的统计值;(2)利用GSEA运算法则计算基因集/通路 S 富集值 ES(S);(3)为了调整不同基因的大小和同一基因内不同SNP位点之间的连锁不平衡,进行以下校正:①随机对样本进行1 000次表型重排(每次重排后病例/对照组样本量不变),计算每次重排后相应富集值 ES(S,π),②根据1 000次表型重排富集值计算标准化富集值NES,NES=[ES(S)-mean(ES(S,π))]/SD[ES(S,π)],从而不同基因集/通路S间可进行比较;(4)计算实验P值(empirical P),重排后 ES(S,π)值大于实际 ES(S)值的次数的百分比即为实验P值;(5)对所得结果进行多重假设检验,其中假阳性发现率(false-discovery rate,FDR)用来控制预期的假阳性发现比例小于一定阈值,参照Aravind等[7]的GSEA法分析研究,本次研究FDR显著性标准设定为FDR≤0.25。
2 结果
2.1WHR基本特征描述本研究共纳入研究对象1 058例,其中病例组700例,对照组358例,对照组与病例组间WHR水平差异显著(P<0.0001),见表1。

表1 病例/对照组WHR特征描述Tab 1 Traits distributions of WHR in cases and controls
2.2统计结果分析通过对腰臀比性状在约55万个SNP位点、1 347条通路/基因集合中全基因组通路关联分析研究发现:65条通路/集合达到显著水平(P<0.05),其中3条通路经多重检验校正后FDR≤0.25。如图1、表2所示。在65条通路/集合中,rasPathway(Ras信号通路)最为显著(empirical P=0.003,FDR=0.238)。另外,ceramidePathway(神经酰胺信号通路)和hcmvPathway(人巨细胞病毒与MAPK通路)是另外两条结果显著的通路(分别为empirical P=0.004,FDR=0.196、empirical P=0.005,FDR=0.203)。如表3所示,Ras信号通路包含23个基因,其下游分支PI3K/AKT途径相关基因BAD、AKT1、PIK3CA、PIK3CG、PIK3R1;MAPK/ERK 途 径相关基因 RAF1、MAP3K1、MAPK1、MAPK3、MAP2K1和IKKβ/NF-κB途径相关基因NFKB1和RELA等均广泛分布于与WHR性状相关的ceramidePathway和hcmvPathway中,提示rasPathway基因集合与WHR性状可能存在一定的关联性。
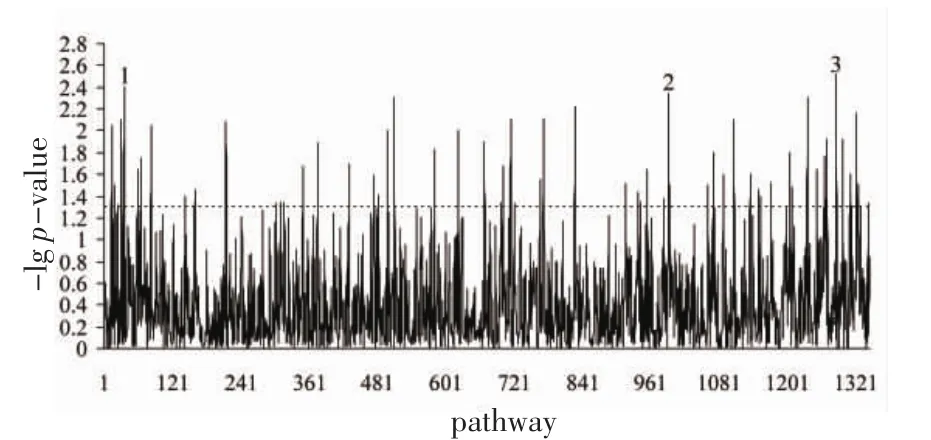
图1 WHR(case/control)通路分析empirical P值分布图Fig 1 Distribution of empirical P value of WHR related pathways in cases and controls
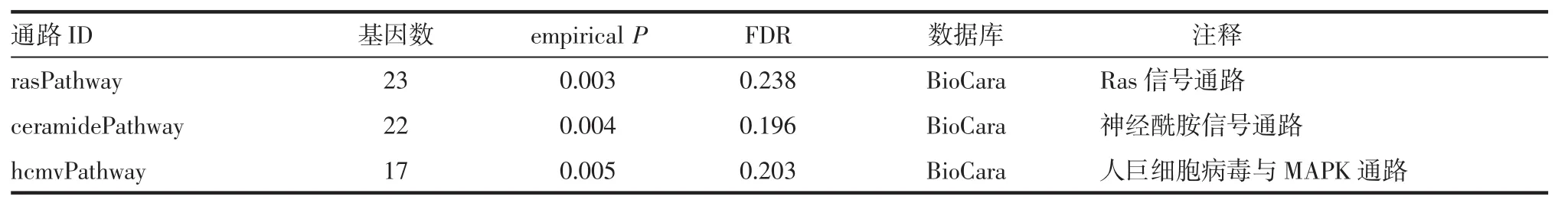
表2 WHR(case/control)显著相关通路Tab 2 Significant pathways of WHR in cases and controls

表3 信号通路基因集合Tab 3 Gene set of pathways
3 讨论
脂肪中心性积累与一系列的疾病如糖尿病、高血压和心脏病等相关[8-10],其关联性甚至超出了广义肥胖[11]。研究发现[12],腹部肥胖者脂肪在腹腔内脏分布,内脏脂肪的聚集及分泌代谢多种细胞因子进入循环系统,包括IL-6、TNF-α、脂联素、瘦素等,导致一系列代谢异常,如胰岛素抵抗、血脂代谢异常、糖调节受损、慢性炎症反应等。1999年WHO将中心性肥胖(WHR:男>0.90,女>0.85 和(或)BMI>30 kg/m2)作为代谢综合征MS的诊断标准之一。2005年,国际糖尿病联盟工作组IDF将中心性肥胖作为MS的必要诊断条件。作为一项重要的临床指标,复杂性状WHR群体水平的遗传学研究具有深刻的意义。本研究中,利用改良后的基因集合富集分析法对复杂性状WHR进行全基因组通路关联分析,研究发现Ras信号通路与WHR显著相关,其下游分支PI3K/AKT途径、MAPK/ERK途径和NF-κB途径位于多条与WHR相关的通路中,如神经酰胺信号通路和人巨细胞病毒与MAPK通路,提示Ras信号通路基因集合与WHR性状存在一定的关联性。
PI3K/AKT途径和MAPK/ERK途径及其它们的下游途径NF-κB途径影响细胞内多种生物学功能,如细胞增殖、凋亡、细胞迁徙、细胞周期、免疫炎症等。PI3K/AKT途径是胰岛素信号通路中的经典途径,胰岛素主要通过PI3K途径介导胰岛素对葡萄糖、蛋白质及脂肪代谢的调控作用。最近的研究发现胰岛素和瘦素信号可通过 PI3K/AKT、Foxo1、MAPK和mTOR通路相互作用共同调节能量代谢。MAPK/ERK途径同样与细胞的增殖、分化和凋亡相关,并参与炎症、肿瘤等疾病的发生。NF-κB途径作为PI3K/AKT途径和MAPK/ERK途径的下游分支,可调控多种炎症因子的表达,在细胞凋亡、免疫、炎症等生物学进程中发挥作用。Zhang等[13]证实下丘脑内侧基底部的IKKβ/NF-κB途径激活可导致中央胰岛素和瘦素抵抗。Yuan等[14]研究发现炎症反应和IKKβ/IκB/NF-κB途径激活是造成肥胖和饮食诱导的胰岛素抵抗的主要原因。整体、器官和组织对胰岛素作用的反应性降低,可促进肌肉、脂肪等外周组织摄取和利用葡萄糖,抑制肝糖输出,促进糖原与脂肪的合成,造成一系列代谢紊乱。越来越多的证据表明外周组织的脂肪累积与肥胖和2型糖尿病中发现的胰岛素抵抗相关。在之前的通路关联研究中,我们已经证实Ras信号通路与欧洲裔美国人群中血浆脂联素水平相关[15]。人体脂联素水平与糖尿病、肥胖呈负相关,在人体内具有广泛的调节功能,可促进脂肪酸氧化、增强葡萄糖摄取和改善胰岛素抵抗等,提示Ras信号通路中PI3K/AKT途径和MAPK/ERK途径及其它们的下游途径NF-κB途径可能借助脂联素、胰岛素等信号进行一系列代谢调控,造成糖代谢紊乱,脂肪合成增加与代谢减少,造成腹部脂肪累积,进而影响腰臀比。
总之,本研究利用全基因组通路关联分析全面展示了与复杂性状WHR相关的通路网络,提示Ras信号通路可能与欧洲裔美国人群中复杂性状腰臀比具有关联。我们准备扩大样本量进一步验证,并进行相关的功能性研究。
参考文献:
[1]Booth A,Magnuson A,Foster M.Detrimental and protective fat:body fat distribution and its relation to metabolic disease[J].Horm Mol Biol Clin Investig,2014,17(1):13
[2]Schleinitz D,Böttcher Y,Blüher M,et al.The genetics of fat distribution[J].Diabetologia,2014,57(7):1276
[3]Lindgren C M,Heid I M,Randall J C,et al.Genome-wide association scan meta-analysis identifies three Loci influencing adiposity and fat distribution[J].PLoS Genet,2009,5(6):e1000508
[4]Heid I M,Jackson A U,Randall J C,et al.Meta-analysis identifies 13 new loci associated with waist-hip ratio and reveals sexual dimorphisminthegeneticbasisoffatdistribution[J].NatGenet,2010,42(11):949
[5]Lai Y,Zhang F,Nayak T K,et al.Concordant integrative gene set enrichment analysis of multiple large-scale two-sample expression data sets[J].BMC Genomics,2014,15(Suppl 1):S6
[6]Wang K,Li M,Bucan M.Pathway-based approaches for analysis of genomewideassociationstudies[J].AmJHumGenet,2007,81(6):1278
[7]Subramanian A,Tamayo P,Mootha V K,et al.Gene set enrichment analysis:a knowledge-based approach for interpreting genomewide expression profiles[J].Proc Natl Acad Sci U S A,2005,102(43):15545
[8]Khan A,Faheem M,Shah S T,et al.Frequency of abdominal obesity anditsassociationwithdiabetesmellitusamongpeopleofpeshawar[J].J Ayub Med Coll Abbottabad,2015,27(3):617
[9]De Oliveira C M,Ulbrich A Z,Neves F S,et al.Association between anthropometric indicators of adiposity and hypertension in a Brazilian population:Baependi Heart Study[J].PLoS One,2017,12(10):e0185225
[10]Keihani S,Hosseinpanah F,Barzin M,et al.Abdominal obesity phenotypes and risk of cardiovascular disease in a decade of followup:the Tehran Lipid and Glucose Study[J].Atherosclerosis,2015,238(2):256
[11]Myint P K,Kwok C S,Luben R N,et al.Body fat percentage,body mass index and waist-to-hip ratio as predictors of mortality and cardiovascular disease[J].Heart,2014,100(20):1613
[12]Reilly M P,Rader D J.The metabolic syndrome:more than the sum of its parts[J].Circulation,2003,108(13):1546
[13]Zhang X Q,Zhang G,Zhang H,et al.Hypothalamic IKK beta/NF-kappa B and ER stress Link overnutrition to energy imbalance and obesity[J].Cell,2008,135(1):61
[14]Yuan M,Konstantopoulos N,Lee J,et al.Reversal of obesity-and diet-induced insulin resistance with salicylates or targeted disruption of Ikkbeta[J].Science,2001,293(5535):1673
[15]Li W D,Jiao H,Wang K,et al.Pathway-Based genome-wide association studies reveal that the Rac1 pathway is associated with plasma adiponectin levels[J].Sci Rep,2015,5:13422
