基于石墨烯海绵的固相萃取-液相色谱法测定化妆品中6种紫外吸收剂
2018-04-02王雪梅杜彤彤马晓敏卢小泉西北师范大学化学化工学院甘肃兰州730070甘肃省生物电化学与环境分析重点实验室甘肃兰州730070
王雪梅, 王 娟, 杜彤彤, 马晓敏, 卢小泉,2(. 西北师范大学化学化工学院, 甘肃 兰州 730070; 2. 甘肃省生物电化学与环境分析重点实验室, 甘肃 兰州 730070)
随着人们生活水平的不断提高,化妆品的种类逐渐多样化,防晒也成为当今化妆品领域的热门话题之一。太阳中的紫外线分为UVA(400~320 nm)、UVB(320~290 nm)和UVC(280 nm以下),通常,280 nm以下的紫外线可导致皮肤晒黑、晒伤,甚至会诱发皮肤癌[1]。目前,欧盟及各国对紫外线吸收剂的使用量已做出了限量要求[2];日本禁止把甲氧基肉桂酸异戊酯与一些特定成分(乙基戊酯、对氨基苯甲酸乙酯等)一起使用[2];美国要求4-甲基苄亚基樟脑在防晒霜等化妆品基质中的使用限量为4%[2]。我国2007版《化妆品卫生规范》对28种防晒剂的限量值也做了明确规定,例如二苯酮类防晒剂在化妆品中的使用量应小于10%[3]。
目前,紫外吸收剂的检测方法有高效液相色谱法[4-6]和气相色谱法[7]等。化妆品形态多样,成分复杂,基质干扰物多,因此必须在分析检测前选择合适的样品前处理技术以分离富集样品中的目标化合物。传统的化妆品前处理方法有消解法、液液萃取法和浊点萃取法等[8],但这些方法操作复杂,耗时长,有机溶剂用量大。近几年一些新型技术被用于化妆品的样品前处理中,如固相萃取(SPE)、搅拌棒吸附萃取(SBSE)、液相微萃取(LPME)、分散液液微萃取(DLLME)、超声辅助萃取(UAE)和微波辅助萃取(MAE)等[8-10]。其中,SPE具有操作简便、选择性好等优点,减少了环境污染,是化妆品前处理领域应用较为广泛的一种方法,固相萃取剂是该技术的核心,根据不同的目标物选择合适的固相萃取剂可提高其对目标物的选择性和分析的灵敏度。
本文以自制的石墨烯海绵(GS)为固相萃取剂,结合高效液相色谱测定了不同形态化妆品中6种新型紫外吸收剂,同时优化了实验条件,得到了较宽的线性范围,较低的检出限和定量限,提高了方法的灵敏度。
1 实验部分
1.1 仪器和试剂
Agilent 1260高效液相色谱仪(美国安捷伦公司); FD-1A-50冷冻干燥机(北京博医康实验仪器有限公司); Ultra plus热场发射扫描电镜(德国蔡司公司); AS1Win比表面积分析仪(美国康塔仪器公司); SMART-N超纯水机(上海康雷分析仪器有限公司)。
硝酸为分析纯(太仓沪试试剂有限公司);硫酸、高锰酸钾、丙酮均为分析纯(北京化工厂);硝酸钠为分析纯(烟台市双双化工有限公司);过氧化氢(纯度30%,上海沃凯生物技术有限公司);乙醇为分析纯(天津凯通化学试剂有限公司);水合肼(纯度≥85%,上海中秦化学试剂有限公司);多壁碳纳米管(MWCNT,纯度>97%,深圳市纳米科技有限公司); C18填料(美国安捷伦科技有限公司);甲醇为色谱纯(美国赛默飞世尔科技有限公司);石墨为化学纯(上海山浦化工有限公司)。标准物质:2-(2′-羟基-5′-甲基苯基)苯并三氮唑(UV-P)、2-(2′-羟基-3′,5′双(a,a-二甲基苄基)苯基)苯并三唑(UV-234)、2′-(2′-羟基-3′-叔丁基-5′-甲基苯基)-5-氯苯并三唑(UV-326)、2-(2′-羟基-3′,5′-二特丁基苯基)-5-氯苯并三唑(UV-327)、2-[2-羟基-3,5-二(1,1-二甲基丙基苯基)]-2H-苯并三唑(UV-328)和2-[2-羟基-5-(1,1,3,3-四甲丁基)苯基]苯并三唑(UV-329),纯度均>98.0%,均购自梯希爱化成工业发展有限公司。
护肤水、乳、美白霜、防晒霜和隔离霜均为市售。
1.2 标准溶液的配制
标准储备液:分别准确称取6种标准物质1 mg,用甲醇配制成质量浓度均为10 mg/L的标准储备液,于4 ℃保存;标准工作液:移取适量标准储备液,用甲醇逐级稀释至所需浓度。混合标准储备液:分别准确称取6种标准物质1 mg,用甲醇配制成质量浓度为10 mg/L的混合标准储备液,于4 ℃保存,实验中用甲醇将其稀释至所需浓度。
1.3 石墨烯海绵的制备
首先根据改进的Hummers法[11]制备氧化石墨。将制备好的氧化石墨用去离子水配成5 000 mg/L的溶液,超声分散得到氧化石墨烯(GO)分散液,然后在冰箱中冷冻48 h,使其完全冷冻结冰;将其快速转移至-50 ℃的冷冻干燥机中冷冻48 h,得到海绵状固体,此时称其为氧化石墨烯海绵(GOS)。最后将GOS置于大烧杯中,并在烧杯内壁滴入2 mL水合肼;将烧杯放入干燥箱中,于90 ℃持续干燥1 h,氧化石墨烯海绵的部分含氧官能团在肼蒸气的氛围下被还原,GOS被还原形成石墨烯海绵。
1.4 固相萃取柱的制备
称取15 mg GS,填入下部装有筛板的2 mL SPE小柱中,再盖上筛板,适当挤压,使填充密实,防止样品从材料与萃取柱的边缘漏出,影响吸附效果,然后分别用10 mL超纯水和甲醇清洗小柱。
1.5 样品前处理
分别取各护肤品1 g,置于不同离心管中,加入10 mL甲醇,超声分散15 min,以8 000 r/min离心10 min,上清液用0.2 μm聚丙烯微孔滤膜过滤,所有样品于4 ℃保存待用。
分别移取上述样品溶液800 μL于SPE柱中,用洗耳球将溶液吹出后,用800 μL丙酮洗脱目标化合物,收集洗脱液,待仪器分析。
1.6 分析条件
色谱柱:Agilent Zorbax SB-C18柱(150 mm×4.6 mm, 5 μm,美国Agilent公司);柱温:30 ℃;流动相:甲醇-水(95∶5, v/v);等度洗脱;进样量:20 μL;流速:0.7 mL/min,检测波长:340 nm。
2 结果与讨论
2.1 石墨烯海绵的表征
图1为石墨烯海绵的光学照片和扫描电镜图。由图1可知,石墨烯海绵是由二维石墨烯片相互搭接构筑成的三维多孔网状结构,由石墨烯复合纳米片充当“孔壁”相互交联后形成了许多大孔结构,孔的尺寸在100 μm左右;在肉眼下即可看到GS具有疏松、多孔的结构。石墨烯纳米片之间主要是依靠范德华力、π-π相互作用力相连。这种多孔的结构增大了材料的比表面积,有利于增强材料的吸附性能。

图 1 石墨烯海绵的(a)光学照片和(b)扫描电镜图Fig. 1 (a) Optical photograph and (b) scanning electron microscope image (SEM) of graphene sponge (GS)
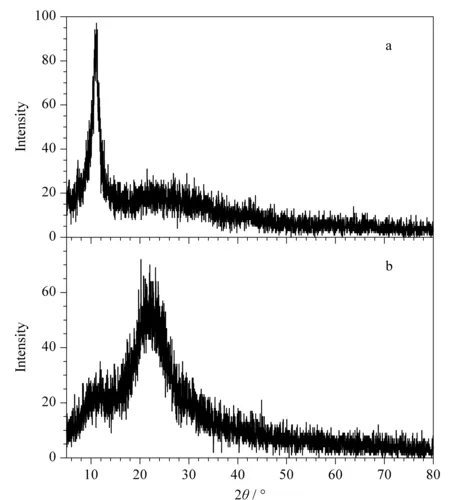
图 2 (a)氧化石墨烯海绵和(b)石墨烯海绵的X射线衍射图Fig. 2 X-ray diffraction patterns of (a) graphene oxide sponge (GOS) and (b) GS
图2为氧化石墨烯海绵和石墨烯海绵的X射线衍射图。由图2可知,GOS在2θ=11°有一个明显的峰,这是由于GOS含有较多的含氧官能团,因而导致层间距增大,产生了明显的衍射峰,说明获得了氧化完全的GOS; GS在2θ=25°有尖锐的特征衍射峰,该衍射峰代表石墨烯的(002)晶面衍射峰,此时单层碳原子紧密堆积,说明成功地制备了石墨烯海绵。
2.2 洗脱剂种类和体积的选择
以1 mg/L的混合标准溶液(800 μL)为目标溶液进行分析,优化洗脱剂的种类和体积。
6种紫外线吸收剂属不同取代基的苯并三唑类化合物,均为弱极性或非极性物质,不溶于水,易溶于甲醇、丙酮、苯、四氢呋喃、甲苯等有机溶剂,且在苯、甲苯中的溶解性较强。鉴于甲苯和苯具有较强的毒性,实验中未予以考虑。实验考察了甲醇、丙酮和正己烷作为洗脱剂时6种紫外线吸收剂的洗脱情况(见图3)。可以看出,相对于正己烷和甲醇,丙酮对目标物有更强的洗脱能力,故选择丙酮作为洗脱剂。

表 1 6种分析物的线性方程、相关系数、线性范围、检出限和定量限Table 1 Linear equations, correlation coefficients (r), linear ranges, limits of detection (LODs) and limits of quantification (LOQs) of the six analytes
Y: peak area;X: mass concentration, μg/L.
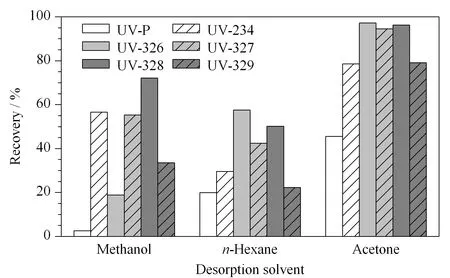
图 3 不同洗脱剂对6种紫外吸收剂回收率的影响Fig. 3 Effect of different eluent on the recoveries of the six UV filters UV-P: 2-(2′-hydroxy-5′-methyl-phenyl) benzotriazole; UV-234: 2-(2-hydroxy-benzotriazole-2-yl)-4,6-bis(1-methyl-1-phenylethyl)phenol; UV-326: 2-tert-butyl-6-(5-chloro-2-hydroxy-benzotriazole-2-yl)-4-methylphenol; UV-327: 2-(2′-hydroxy-3′,5′-di-tert-butylphenyl)-5-chlorobenzotriazole; UV-328: 2-(2′-hydroxy-3′,5′-dipentylphenyl) benzotriazole; UV-329: 2-(2-hydroxy-benzotriazole-2-yl)-4-(1,1,3,3-tetramethylbutyl)phenol.
考察了丙酮的体积(200、500、800和1 000 μL)对6种紫外吸收剂回收率的影响(见图4)。结果表明,采用800 μL丙酮时,可获得最佳的萃取效率。
同时考察了溶剂的pH值和离子强度对吸附解析过程的影响,结果表明,二者对目标化合物峰面积的影响不大,所以后续的实验过程不对此进行改变。

图 4 丙酮的体积对6种紫外吸收剂回收率的影响Fig. 4 Effect of volume of acetone on the recoveries of the six UV filters
2.3 吸附能力对比
本实验选用商品化的多壁碳纳米管和C18填料进行对比,按照优化的固相萃取条件,以未检测到目标物的空白样品进行加标回收试验。采用不同吸附材料时的色谱图见图5。可以看出,GS的吸附效率高于多壁碳纳米管和C18填料,这是由于紫外吸收剂与GS除表面吸附作用外,紫外吸收剂具有的苯环、五元环或六元环结构与GS的π电子体系易形成π-π共轭作用,因此GS对紫外吸收剂具有较好的吸附能力,回收率高,净化效果好。

图 5 采用不同吸附材料时6种紫外吸收剂的色谱图Fig. 5 Chromatograms of the six UV filters using different materials as SPE adsorbents MWCNT: multiwalled carbon nanotube. Peaks: 1. UV-P; 2. UV-329; 3. UV-326; 4. UV-324; 5. UV-328; 6. UV-327.
2.4 线性关系和检出限
按1.2节所述方法配制系列标准溶液,以化合物的峰面积为纵坐标、对应的质量浓度为横坐标绘制标准曲线(见表1)。6种目标化合物除UV-P外,相关系数(r)均>0.999,说明各目标化合物在线性范围内线性关系良好。根据国际纯粹和应用化学联合会(IUPAC)对检出限的定义[12],计算6种目标物的检出限(S/N=3)和定量限(S/N=10),分别为0.08~1.82 μg/L和0.26~6.07 μg/L。
2.5 回收率和精密度
按1.5节和1.6节方法对实际样品进行处理和分析,得到的检测结果见表2。结果显示,除了护肤水外,6种紫外吸收剂在其余护肤品中均有不同程度的检出,其中防晒霜和隔离霜中检测到紫外吸收剂的种类最多。

表 2 实际样品的检测结果Table 2 Test results of real samples
ND: not detected.
在经测定不含6种紫外线吸收剂的空白护肤水样品中添加低、中、高3个水平的混合标准溶液,同样按1.5节和1.6节方法进行样品处理和分析。6种紫外线吸收剂的平均回收率为61.1%~119.0%,相对标准偏差(RSD)均小于1%(n=6)(见表3)。由此可见,该方法具有良好的准确性和精密度。
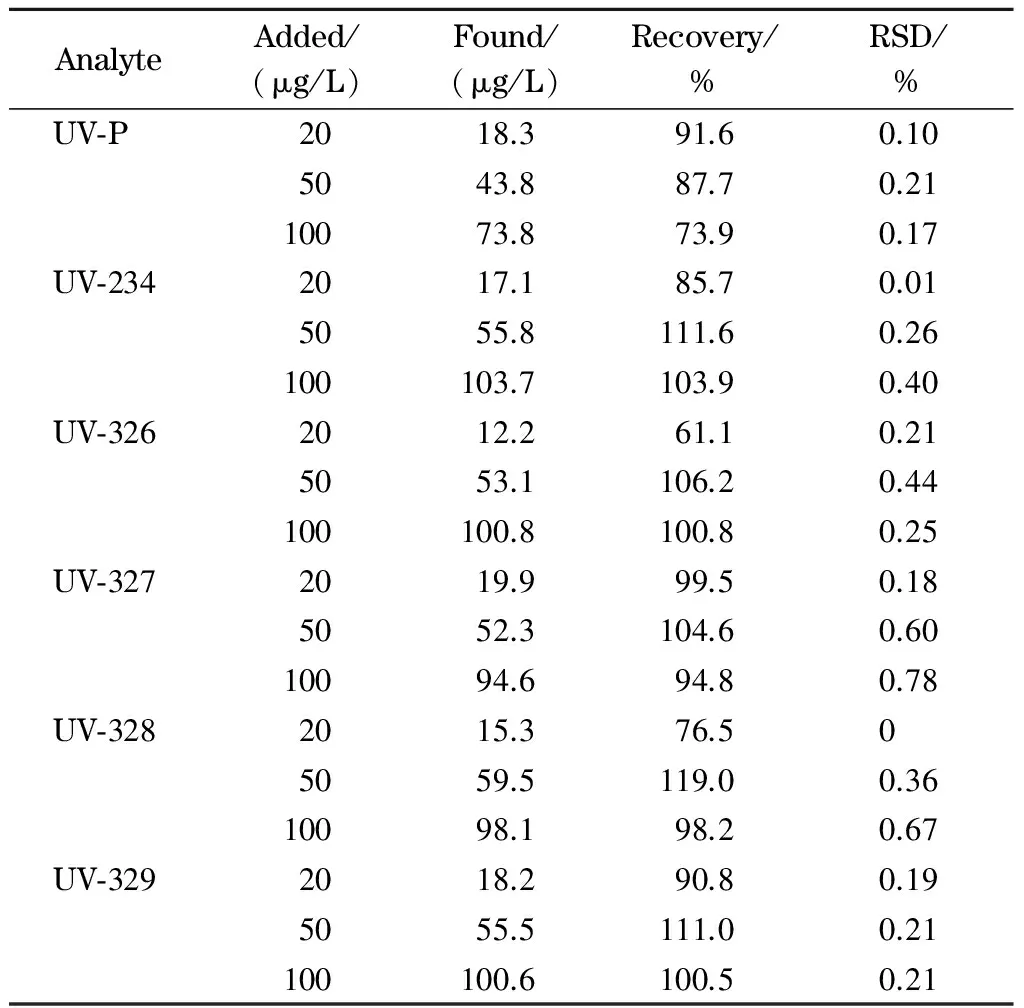
表 3 护肤水样品中6种紫外线吸收剂的加标回收率和精密度(n=6)Table 3 Spiked recoveries and precisions of the six UV filters in skin lotion samples (n=6)
3 结论
本实验制备了石墨烯海绵固相萃取剂,并建立了固相萃取-高效液相色谱测定不同化妆品中6种紫外线吸收剂的方法。方法的灵敏度、回收率及重复性均符合残留分析要求。该方法前处理过程简单,具有良好的线性关系和精密度,可为定性和定量分析化妆品中的紫外线吸收剂提供一种准确有效的检测方法。该方法的建立能为进一步研究苯并三唑类紫外线吸收剂的暴露水平和环境行为奠定基础。
参考文献:
[1]Huang X F, Liu L Y, Jin Y, et al. Chinese Journal of Analytical Chemistry, 2014(12): 1846
黄雄风, 刘绿叶, 金燕, 等. 分析化学, 2014(12): 1846
[2]He Q S, Xu N, Li J, et al. Chinese Journal of Chromatography, 2011, 29(8): 762
何乔桑, 徐娜, 李晶, 等. 色谱, 2011, 29(8): 762
[3]Ministry of Health of the People’s Republic of China. Hygienic Standard for Cosmetics (2007 Edition). (2007-01-04) [2017-11-08]. http://www.gov.cn/zwgk/2007-01/26/content_508651.htm
中华人民共和国卫生部. 化妆品卫生规范(2007版). (2007-01-04) [2017-11-08]. http://www.gov.cn/zwgk/2007-01/26/content_508651.htm
[4]Noriya O, Hidehiro H, Rie I, et al. Anal Sci, 2008, 24: 627
[5]Mao X Q, Bian H T, Qu B C. Chinese Journal of Chromatography, 2013, 31(8): 775
毛希琴, 边海涛, 曲宝成. 色谱, 2013, 31(8): 775
[6]Barbara K H, Richard M D, Alan J G. Anal Bioanal Chem, 2008, 391: 1293
[7]Li J, Xu L Y, Xue S W, et al. Chinese Journal of Chromatography, 2014, 32(10): 1138
李建, 徐兰英, 薛舒文, 等. 色谱, 2014, 32(10): 1138
[8]Zhang Y S, Lin Z H, Hu Y L, et al. Journal of Instrumental Analysis, 2016, 35(2): 127
张艳树, 林振华, 胡玉玲, 等. 分析测试学报, 2016, 35(2): 127
[9]Cabaleiro N, De la Calle I, Bendicho C, et al. TrAC-Trends Anal Chem, 2014, 57: 34
[10]Mei M, Huang X J. J Chromatogr A, 2017, 1525: 1
[11]Zhang L, Shi G Q. J Phys Chem, 2011, 115(34): 17206
[12]International Union of Pure and Applied Chemistry (IUPAC). Compendium of Analytical Nomenclature. 3rd ed. Oxford: Blackwell Science Ltd., 1998
