1′-H-螺(吲哚-3,4′-哌啶)的合成
2018-04-02古金华腾星星杨梦蝶叶连宝
古金华,腾星星,韩 超,冯 钰,吴 杰,杨梦蝶,叶连宝
(广东药科大学 药学院,广东 广州 510006)
近年来螺哌啶类结构的治疗应用引起了较大的关注[1-4].1’-H-螺(吲哚-3,4’-哌啶)为很多螺哌啶类活性化合物的基本母核,在化合物活性结构中发挥很重要的作用(图1),如MK-0677、伊布莫仑是潜在的拟肽类生长激素促分泌素(GHS)[5]、丝氨酸受体拮抗剂和黑色素皮质素受体的兴奋剂的重要中间体[5,6,7],同时在CMet/ALK双重抑制剂[8]、组蛋白去乙酰化酶(HDAC)抑制剂[9]、杀虫活性[10]、11-β羟类固醇脱氢酶(11βHSD1)抑制剂[11]、P2Y1拮抗剂[12]等中也发现该类化合物.有文献报道螺-(吲哚啉-3,4′-哌啶)类物质是大多数G-蛋白偶联最匹配的配体[13].因此1’-H-螺(吲哚-3,4’-哌啶)的合成具有最要的意义.现有方法将双氯乙基胺盐酸盐甲基化或BOC保护后与2-氟-苯乙腈反应,后再脱保护,步骤较多,按照文献方法[14,15]研究合成,产率也没有文献报道的高,后处理时,不经过柱层析,很难直接进行后续反应.文献方法成本高,产业化难.
研究对文献[15]方法进行工艺改进,直接以双氯乙基胺盐酸盐为原料与2-氟-苯乙腈进行亲电取代,在还原剂作用下还原环合得到1’-H-螺(吲哚-3,4’-哌啶)(图 2),其结构经1HNMR,13C NMR,EI-MS确证,对4-(2-氟-苯基)-哌啶-4-甲腈的合成过程中反应时间、投料比及1’-H-螺(吲哚-3,4’-哌啶)的合成过程中反应时间进行研究.结果表明:在最佳反应条件下,2-氟-苯乙腈与双氯乙基胺盐酸盐及NaH的摩尔比为1:1:10,1’-H-螺(吲哚-3,4’-哌啶)的合成反应时间为10h,总收率达80%以上.
1 实验过程
1.1 仪器与试剂
Bruker-400MHz型核磁共振仪(CDCl3为溶剂,TMS内标);Waters/micromass ZQ4000质谱仪配有电喷雾离子源(ESI);DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);SHZ-95B型循环水式多用真空泵(巩义市予华仪器有限责任公司);IKA-RV8旋转蒸发仪(德国IKA公司).
2-氟-苯乙腈(98%,安耐吉);双(2-氯乙基)胺盐酸盐(98%,J&K);NaH(60%,麦克林);甘二醇二乙醚(99.5%,阿拉丁);氢化铝锂(97%,麦克林);硼氢化钠(98%,阿拉丁);三叔丁氧基氢化锂铝(97%,阿拉丁);三氯化铝、正丁醇、二氯甲烷、N,N-二甲基甲酰胺、四氢呋喃、碘化钾、氯化铵均为天津百世化工所产AR级试剂.
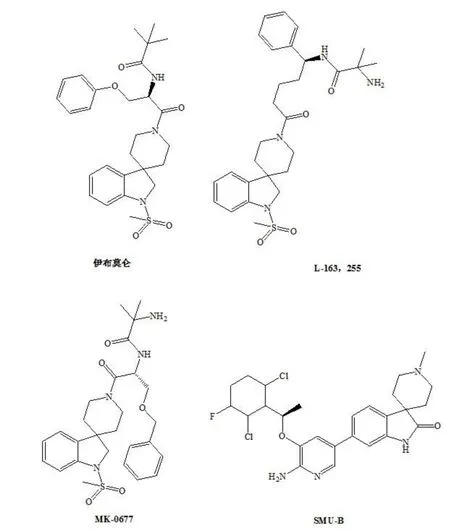
图1 含有1’-H-螺(吲哚-3,4’-哌啶)结构的药物分子

图2 1’-H-螺(吲哚-3,4’-哌啶)的合成
1.2 化合物的合成
1.2.14-(2-氟-苯基)-哌啶-4-甲腈的合成
在反应瓶中依次加入2-氟-苯乙腈0.27g(2mmol),无水THF4mL,冰浴降温至0℃以下,缓慢加入氢化钠(60%)520mg(13mmol).移开冰浴,反应体系升至室温反应30min.体系再次冰浴降温0℃以下,滴加入用2 mLDMF溶解的双(2-氯乙基)胺盐酸盐356mg(2mmol),缓慢升温至回流,反应3小时,TLC监控反应完全.将反应液降至室温,减压浓缩至干,加入冰冻的饱和氯化铵水溶液10 mL,用二氯甲烷萃取3次,合并有机层,用纯化水洗涤1次,无水硫酸钠干燥过夜,抽滤,滤液浓缩至干,得0.35g油状固体即为产物,可以直接用于下一步反应.摩尔收率85%.1HNMR(CDCl3,400Hz):δ9.31(s,1H),7.51-7.52(m,2H),7.34-7.40(m,2H),3.51(d,J=12Hz,2H),3.35(s,2H),3.08-3.14(t,2H),2.35(s,1H),2.38(S,1H);13CNMR(CDCl3,100MHz):δ21.7,33.5,42.41,115.7,121.6,124.4,125.8,127.6,129.8,160.6;ESI-MS,m/z:205.5[M+H]+.
1.2.21’-H-螺(吲哚-3,4’-哌啶)的合成
称取三叔丁氧基氢化锂铝1.5 g(8.8mmol)和碘化钾30 mg于反应瓶中,加入6 mL四氢呋喃,将反应体系升温至回流,加入用四氢呋喃溶解的4-(2-氟-苯基)-哌啶-4-甲腈0.3g(1.47 mmol),回流反应10小时.TLC监控反应完全,反应液减压浓缩至干,冰浴降温至0℃,滴加入1 mL水,6 mL二氯甲烷,搅拌,抽滤,滤饼用二氯甲烷洗涤至滤液无色,分出水层.有机层用碳酸氢钠水溶液洗涤3次,合并水层,水层用正丁醇萃取,正丁醇层浓缩至干即得1.57 g目标产物.摩尔收率95%.1HNMR(CDCl3,400MHZ):δ7.15(m,2H),7.11(m,2H),3.52(s,2H),3.17(d,2H),2.81(s,1H),2.26(d,2H),1.92(m,4H);13CNMR(CDCl3,100MHz):δ43.2,43.4,47.8,63.4,98.6,116.8,121.8,126.4,133.3,148.1;ESI-MS:189[M+H]+.
2 实验结果
2.1 合成化合物4-(2-氟-苯基)-哌啶-4-甲腈反应条件的改进
合成化合物4-(2-氟-苯基)-哌啶-4-甲腈是整个反应路线的关键,查阅现有文献报道通过2-氟-苯乙腈直接与双(2-氯乙基)胺盐酸盐合成此化合物是很难进行的,大多数采用将双(2-氯乙基)胺盐酸盐进行保护,脱保护后合成.通过对文献的路线条件进行改进由起始原料2-氟-苯乙腈直接与双(2-氯乙基)胺盐酸盐进行反应,产物摩尔收率高达85%,并且不需要经过柱层析或重结晶来纯化,可以直接用于下一步的原料,减少了操作步骤,缩短了工艺路线,此步骤创新之处主要是加入双(2-氯乙基)胺盐酸盐的方式.为了验证此结论,对加入双(2-氯乙基)胺盐酸盐的加入方式进行了系统的研究,结果如表1所示:

表1 加双(2-氯乙基)胺盐酸盐时所用的溶解溶剂对4-(2-氟-苯基)-哌啶-4-甲腈合成的影响
通过实验对比:如果直接加入双(2-氯乙基)胺盐酸盐固体或将其用非碱性有机溶剂溶解,均得不到产物4-(2-氟-苯基)-哌啶-4-甲腈,而将双(2-氯乙基)胺盐酸盐用碱性的有机溶剂溶解后加入反应液中能得到所需的产物,这可能是xie[15]等得不到产物的原因.为了进一步探讨xie[15]等直接用双(2-氯乙基)胺盐酸盐固体得不到产物4-(2-氟-苯基)-哌啶-4-甲腈的原因,将双(2-氯乙基)胺盐酸盐用碳酸氢钠固体的二氯甲烷溶液去除盐酸盐后再反应,发现反应液中产物4-(2-氟-苯基)-哌啶-4-甲腈的量生成较少,原因可能是碱性有机碱除在溶解双(2-氯乙基)胺盐酸盐时充当缚酸剂,还对反应有催化作用.
2.2 合成化合物1’-H-螺(吲哚-3,4’-哌啶)反应条件的优化
通过研究不同还原剂对反应的影响,最终确立了三叔丁氧基氢化锂铝/碘化钾体系反应,10 h即能反应完全,大大缩短了文献中72 h的反应时间,且实验采用文献中方法几乎得不到所需产物,而主要生成副产物4-氨甲基-4-(2'-氟苯基)-哌啶.研究不同还原剂对合成化合物1’-H-螺(吲哚-3,4’-哌啶)的影响,结果见表2所示.

表2 不同还原剂对合成化合物1’-H-螺(吲哚-3,4’-哌啶)的影响
从表2可见,三叔丁氧基氢化锂铝/碘化钾混合体系作为还原剂明显缩短了反应时间,另外在对xie[15]等还原剂进行考察时,发现温度和湿度对反应的影响也很大,反应温度过低,湿度超过50%,完全得不到产物,几乎100%得到4-氨甲基-4-(2'-氟苯基)-哌啶.
3 结论
以Jian-Shu Xie[15]小组的研究为基础,对以廉价的2-氟-苯乙腈为起始原料合成1'-H-螺(吲哚-3,4'-哌啶)的工艺进行了改进.考察了4-(2-氟-苯基)-哌啶-4-甲腈的合成反应中最适的溶解双(2-氯乙基)胺盐酸盐的溶剂为N,N-二甲基甲酰胺,还原环合的最佳还原试剂是三叔丁氧基氢化锂铝/碘化钾的混合物,总摩尔收率大于80%,较文献的67%摩尔收率有很大提高,而且总工艺路线由原来的4步缩短为现在的2步,中间处理不需要柱层析分离,在由4-(2-氟-苯基)-哌啶-4-甲腈合成1’-H-螺(吲哚-3,4’-哌啶)过程的时间缩短为小于1/7不到,成本大大减少,对工业化有很大的指导意义.
参考文献:
[1]PLUCKI B L,FEIGHNER S D,PONG S S,et al.Spiro(indoline-3,4-piperidine)-growth hormone secretagogues as ghrelin mim-etics[J].Bioorg.Med.Chem.Lett,2001,11(14):1955-957.
[2]MEYER C,KERNS A,HABERTHUR K,et al.Improving immunity in the elderly:current and future Lessons from nonhuman primate models[J].AGE,2012,34(5):1157-1168.
[3]YE L B,TIAN Y X Y,LI Z H,et al.Design,synthesis and molecular docking studies of some novel spiro[indoline-3,4'-piperidine]-2(1H)-ones as potential c-Met inhibitors[J].European Journal of Medicinal Chemistry,2012,50:370-375.
[4]AVERY V M,BASHYAM S,BURROWS J N,et al.Screening and hit evalution of a chemical library against blood-stage Plasmodium falciparum[J].Malaria Journal,2014,13(1):190-201.
[5]AVERY V M,BASHYAM S,BURROWS J N,et al.Screening and hit evalution of a chemical library against blood-stage Plasmodium falciparum[J].Malaria Journal,2014,13(1):190-201.
[6]BEDNAREK M A,FEIGHNER S D,PONG S S,et al.Structure-function studies on the new growth hormone releasing peptide,ghrelin:minimal sequence of ghrelin necessary for active-etion of growth hormone secretagogue receptor 1[J].J.Med.Chem,2000,43(23):4370-4376.
[7]QI X L,QUN E,ZHANG J T,et al.A facile synthesis of the spiroindoline-based growth hormone secretagogue,MK-677[J].Chinese Chemical Letters,2012,23(6):661-664.
[8]ELLIOTT J M,BROUGHTON H,CASCIERI MA,et al.Serine derived NK1 antaganIs-ts2:a pharmacophore mode for arylsulfonamide binding[J].J.Med.Chem.Lett.,1998,8(1):851-856.
[9]LI J R,WU N,TIAN Y X,et al.Aminopyridyl/pyrazinyl Spiro[inndoline-3,4’-piperidine]-2-ones As Highly selective and efficacious C-Met/ALK Inhibitors[J].Med.Chem.Lett,2013,4(8):806-810.
[10]HAMBLETT C,KATTAR S,MAMPREIAN D,et al.Aryl-Fused Spirocyclic compounds:WO,2007136605[P],2007-04-14.
[11]CASSAYRE J,MOLLEYRES L P,MAIENFISCH P,et al.Use of(3-(1-(3-phenyl-propeny l)-piperidin-4-yl)-2,3-dihydro-indol-1-yl)-(pyridin-4-yl)-methanone derivatives and related compou-nds as insecticides:WO,2005058035[P],2005-06-30.
[12]HISASHI N,TAKAAKIA,TAKAHISAO,et al.Novel spirooxyindole compounds and drugs containing same:US,2008030610-2[P].2008-12-11.
[13]PATCHETT A A.Natural products and design:interrelated approaches in drug discovery[J].J.Med.Chem,2002,45(26):5609-5616.
[14]QIAO J X,WANG T C,THIBEAULT C,et al.Conformationally constrained ortho-Anilino Diaryl Ureas:Discovery of 1-(2-(1-Neopentylspiro[indoline-3,4’-piper idine]1-yl)phenyl)-3-(4-(trifluoromethoxy)-phenyl)urea,a potent,selective,and bioavailable P2Y1Antagonist
[15]XIE J S,HUANG C Q,FANG YY,et al.A convenient synthesis of 1’-H-spiro-(indoline-3,4-piperidine)and its derivatives[J].Tetrahedron,2004,60(22):4875-4878.
