三种紫苏子的红外光谱分析与鉴定
2018-04-02杨兰芬孙素琴周群马芳
杨兰芬 孙素琴 周群 马芳
引言
紫苏子为唇形科植物紫苏Perilla frutescens (L.) Britt.的干燥成熟果实[1]。中药紫苏子味微辛、性温,具有降气化痰、止咳平喘、润肠通便等作用[2]。化学成分研究表明,紫苏子中富含油脂、蛋白质,还含有多种氨基酸、粗纤维以及大量不饱和脂肪酸[3-6]。我国紫苏资源分布广泛,魏长玲等[7]调查结果表明我国各地野生与栽培资源均十分丰富,但栽培紫苏资源存在栽培类型多样性和复杂性的问题。
中药“多级红外光谱宏观指纹分析法”融合了中药学与分析化学,是一种基于中药材红外光谱宏观指纹特征的综合分析方法[8]。相较于传统的中药分析法,此方法最大程度保留了样品的原始状态,能够得到药材的整体化学成分信息。本文运用红外光谱三级鉴定法和整体解析法对三种紫苏子进行了快速无损的分析和鉴定。
1 实验部分
1.1 仪器设备
傅里叶变换红外光谱仪:Perkin-Elmer公司的Spectrum One型红外光谱仪,DTGS检测器。光谱范围为4000~400 cm-1,光谱分辨率为4 cm-1,扫描次数为16次,测定过程中实时扣除H2O、CO2的干扰。
变温控制附件:北京市朝阳自动化仪表厂生产的CKM-Ⅱ 型程序升温仪。控温范围为50~120 ℃,升温速度为 2 ℃ .min-1。
1.2 样品来源
三个紫苏子样品来源地均为河北,2016年种植在北京药用植物研究所实验地。样品编号分别为AG-1,AG-12,BJ-6。
1.3 方法与数据处理
将紫苏子样品研磨成粉末,再与KBr混合研磨,压片,用傅里叶变换红外光谱仪扫描得到样品红外光谱图。二阶导数红外光谱采用Spectrum v5.0.1数据处理软件获得,平滑点数为13。另将样品薄片放入变温控制附件,温度从50℃上升到120℃,每10℃测定一次红外光谱。二维相关红外光谱采用清华大学分析中心自行设计的二维相关分析软件获得。
2 结果与讨论
2.1 紫苏子的红外光谱分析
根据文献报道,紫苏子含有大量的油脂和蛋白质,因此采用红外光谱法对紫苏子进行主体成分解析,得到高度相似的红外图谱,分析其相似性;运用多级红外光谱,分析其差异性。如图1所示,三种紫苏子样品的红外光谱整体峰形相似,但部分谱峰的峰形、峰位和峰强存在差别,这可能与各种紫苏子所含化学成分的含量差异有关。根据文献[9-14]对红外光谱吸收峰进行指认和归属。3334~3302 cm-1主要是多糖类中O-H的伸缩振动和蛋白质、氨基酸中N-H的伸缩振动吸收峰;3011 cm-1为烯烃C-H的伸缩振动吸收峰,可能来自于不饱和脂肪酸及酯类物质;2927、2854 cm-1分别为亚甲基C-H 反对称和对称伸缩振动吸收峰;1746~1745 cm-1对应于酯羰基C=O 的伸缩振动吸收峰;1162~1160 cm-1为油脂和多糖(O)C-O伸缩振动吸收峰;723~721 cm-1是长链亚甲基(nC>4)C-H 的弯曲振动吸收峰。上述一系列吸收峰为饱和与不饱和脂肪酸酯类分子的特征峰,说明紫苏子中含有大量的油脂。红外光谱中,还有1657~1655 cm-1和1636~1535 cm-1的较强吸收峰,这组峰是表征蛋白质酰胺I带和酰胺II带的主要特征峰,说明紫苏子还含有丰富的蛋白质。
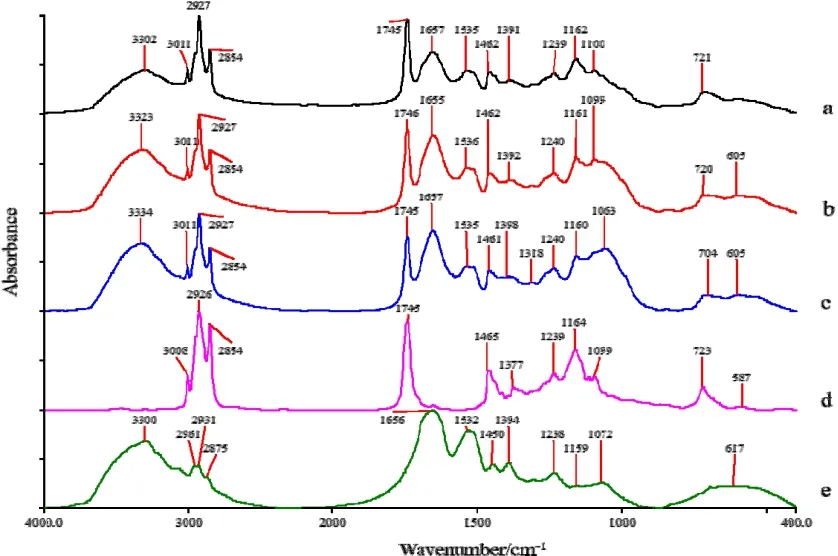
图 1 AG-1(a),BJ-6(b),AG-12(c),油脂 (d)和蛋白质(e)的红外光谱
综上分析,紫苏子主体成分为油脂和蛋白质,另含有一定量的多糖,与文献报道相符。此外,采用COMPARE比对软件比较三种紫苏子样品的红外谱图,以AG-1紫苏子为标准,得到三个紫苏子样品AG-1、BJ-6、AG-12的相关系数依次为:1.0000,0.9848,0.9703,三者谱图比较相似,但部分谱峰形状和相对强度存在一定差异。如表1所示,紫苏子AG-1、BJ-6、AG-12的1746 cm-1附近油脂特征峰与1655 cm-1附近蛋白质特征峰的相对高度不同,分别为1.5489,1.0900,0.9309,说明三种紫苏子油脂、蛋白质的相对含量存在差异。AG-1紫苏子中油脂特征峰与蛋白质特征峰之间相对峰强度值最大,表明AG-1紫苏子油脂的相对含量最高,BJ-6次之,AG-12所含油脂最低;蛋白质的相对含量则是AG-12最高,BJ-6次之,AG-1则相对最低。此外,三种紫苏子样品1100 cm-1左右吸收峰的峰位、峰形存在差异,AG-1、BJ-6吸收峰位置分别为1100 cm-1,1099 cm-1,而AG-12的吸收峰则向低波数偏移至1063 cm-1,且AG-1峰形较尖,BJ-6,AG-12样品峰形较宽。通过红外光谱不仅可以分析出紫苏子的主体成分,也可看出不同紫苏子的差异。
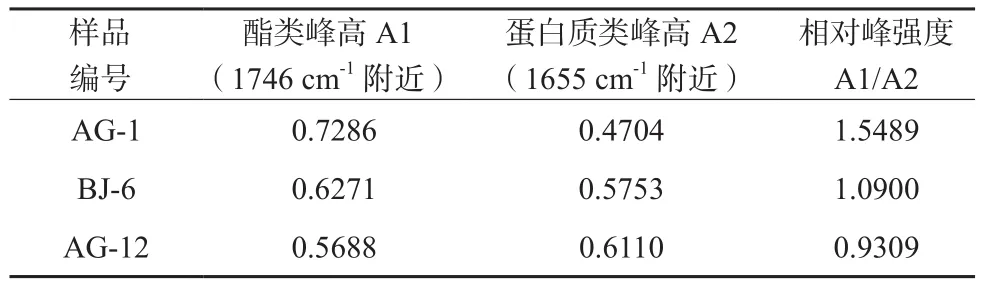
表1 三种紫苏子特征吸收峰之间的相对峰强度
2.2 紫苏子的二阶导数红外光谱分析
二阶导数谱能够使原始光谱中互相重叠的一部分吸收峰得到分离,增强谱图的分辨能力[15-16]。如图2所示,紫苏子在1720~1530 cm-1,1400~1020 cm-1两个波段的二阶导数谱中谱峰特征显著增多,如经典红外光谱中酰胺I带和酰胺II带吸收峰为单峰,但在二阶导数谱中,酰胺带吸收峰在1700~1500 cm-1波段内分解为多个峰,说明了紫苏子中不同二级结构蛋白质的存在[17]。此外,三种紫苏子样品的二阶导数谱中均出现了经典红外谱图中没有的1709cm-1左右的吸收峰;该峰对应于有机酸类分子C=O 的伸缩振动吸收峰[18],再结合经典红外光谱中3011,2927,2854,720 cm-1附近的吸收峰,说明紫苏子中含有一定量的不饱和脂肪酸,与文献报道一致。不同之处在于,AG-12紫苏子1709 cm-1附近的吸收峰在1720~1530 cm-1波段为中强吸收峰,但AG-1和BJ-6中该峰为弱吸收峰。此外,在1720~1530 cm-1波段,三种紫苏子样品在1694,1629,1562 cm-1等处的谱峰有显著的差异,明显体现出三者蛋白质、氨基酸等成分的不同。在1400~1020 cm-1波段,BJ-6,AG-12紫苏子样品有1318 cm-1左右的吸收峰,AG-1中该峰并不明显;但AG-1出现了1067 cm-1吸收峰,相比较而言,BJ-6,AG-12该峰并不明显。在由此可知,随着表观分辨率的提高,三种紫苏子之间的许多差异更加明显。
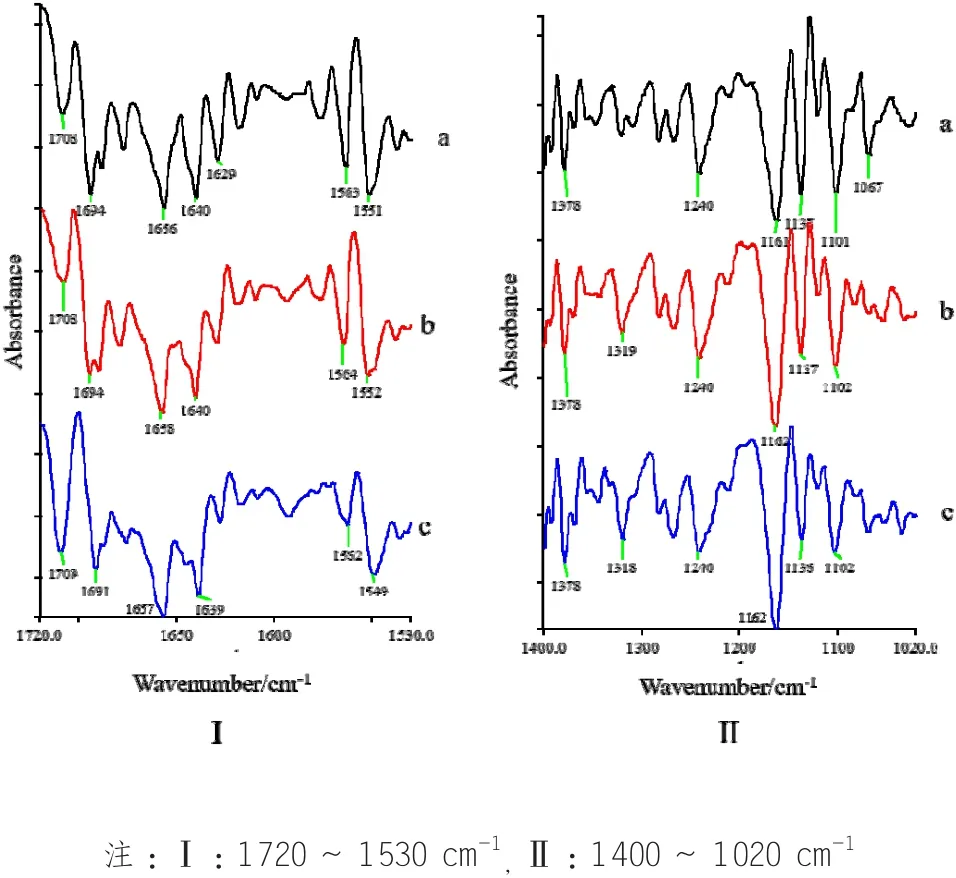
图 2 AG-1(a), BJ-6(b), AG-12(c) 的二阶导数红外光谱
2.3 紫苏子的二维相关红外光谱分析
利用二维相关红外光谱可以获得测试样品在不同外界微扰的动态变化信息,将光谱在第二维上展开,能够更加明显表现出样品成分间的差异[19-20]。实验以温度变化为微扰,选取1400~1800 cm-1,900~1300 cm-1两个波段对三种紫苏子进行二维相关红外光谱分析。1400~1800 cm-1区域的谱峰主要对应于C=O伸缩振动吸收峰、蛋白质酰胺带振动吸收峰及芳香类化合物的骨架振动吸收峰。如图3所示,在此区域AG-1紫苏子的二维相关红外光谱主要自动峰有10个,分别在1465,1492,1556,1567,1625,1634,1645,1653,1739,1759 cm-1附近,最强自动峰为1739 cm-1;BJ-6紫苏子主要自动峰有7个,分别在1466,1490,1556,1627,1655,1740,1759 cm-1, 其 中 1627,1740 cm-1强度相当,为该波段的强自动峰;AG-12紫苏子主要自动峰有7个,分别在1465,1495,1556,1629,1656,1742,1760 cm-1,最强自动峰在1629 cm-1。该波段二维相关红外光谱的差异说明了三者油脂、蛋白质、氨基酸及芳香类物质等化学成分存在差异,同时进一步佐证了三种紫苏子油脂和蛋白质的相对含量存在差别。
900~1300 cm-1区域主要为C-O伸缩振动吸收峰,这组峰主要对应于多糖类吸收峰。如图4所示,在此波段二维相关红外光谱中,AG-1紫苏子有6个主要的自动峰,分别在1011,1103,1133,1138,1167,1216 cm-1附近,最强自动峰为1216 cm-1;BJ-6紫苏子有4个主要自动峰,分别在942,1008,1141,1216 cm-1,最强自动峰为1216 cm-1;AG-12紫苏子有5个主要自动峰,分别在942,1007,1091,1144,1214 cm-1,最强自动峰为 1214 cm-1。该波段二维相关红外光谱的不同主要体现出三种紫苏子多糖类成分存在差异。
3 结论
利用红外光谱三级鉴定法和整体解析法,对来源地均为河北的三种紫苏子进行主体成分解析和鉴定。结果显示,三种紫苏子的红外光谱、二阶导数谱和二维相关谱差异都较为明显,可据此进行有效区分,同时还可对其中所含主要成分进行定性和相对含量分析。紫苏子主体成分为油脂、蛋白质,通过比较二者特征吸收峰之间的相对强度,得出三种紫苏子中油脂、蛋白质的相对含量存在差异。进一步利用二阶导数谱,得到1709 cm-1附近属于有机酸类的特征吸收峰;运用二维相关红外光谱,得到样品受温度变化影响显著的成分间的差别,进一步区分鉴别三种不同紫苏子。该研究工作可为紫苏子种质鉴别和紫苏资源的开发利用提供研究思路和方法。

图3 AG-1(a),BJ-6(b),AG-12(c)的二维相关红外光谱及对应自动峰 (1400~1800 cm-1)

图4 AG-1(a),BJ-6(b),AG-12(c)的二维相关红外光谱及对应自动峰 (900~1300 cm-1)
[1] 国家药典委员会.中华人民共和国药典:2015年版.一部[S].北京:中国医药科技出版社,2015:338.
[2] 谷丽华,林晨,吴弢,等. 紫苏子药材质量标准研究[J].中国中药杂志,2010,35(16):2087-2090.
[3] 唐雪阳,安琪,孙道涵,等. 基于药物体系的紫苏子特征图谱质量表征关联分析研究[J]. 北京中医药大学学报,2015,34(4):241-246.
[4] 刘洪旭,陈海滨,吴春敏.紫苏子的研究进展[J].海峡药学,2004,16(4):5-7.
[5] 王永奇,赵宇峰,李曼杰,等.紫苏的研究Ⅺ.紫苏子的化学成分[J].中草药,1995,26((5):236-238.
[6] 熊运海,王玫.化学计量学法对紫苏叶与紫苏子挥发油共有组分分析[J].食品科学,2010,31(2):203-207.
[7] 魏长玲,郭宝林,张琛武,等.中国紫苏资源调查和紫苏叶挥发油化学型研究[J].中国中药杂志,2016,41(10):1823-1834.
[8] LIU X H, XU H J, SUN S Q, et al. Analysis and identification of Chinese drugs by three-step infrared spectroscopy-A case study of Danshen[J]. Anal. Methods, 2012, 4:3344-3350.
[9] 孙素琴,周群,陈建波.中药红外光谱分析与鉴定[M].北京:化学工业出版社,2010:67-75.
[10] 杜娟,彭惜媛,马芳,等.黑豆和牵牛子红外光谱的分析与鉴定[J].光谱学与光谱分析,2014,34(9):2429-2433.
[11] SUN S Q, ZHOU Q, CHEN J B. Infrared Spectroscopy for Complex Mixtures-Applications in Food and Traditional Chinese Medicine[M]. Beijing: Chemical Industry Press,2011:157-169.
[12] LI J R, SUN S Q, WANG X X, et al. Differentiation of five species of Danggui raw materials by FTIR combined with 2D-COS IR[J]. J Mol Struct, 2014, 1069:229-235.
[13] XIANG L, WANG J J, ZHANG G J, et al. Analysis and identification of two similar traditional Chinese medicines by using a three-stage infrared spectroscopy: Ligusticum chuanxiong, Angelica sinensis and their different extracts[J]. J Mol Struct, 2016, 1124:164-172.
[14] WANG Y, WANG P, XU C H, et al. Macro-fingerprint analysisthrough-separation of licorice based on FT-IR and 2DCOSIR[J]. J Mol Struct, 2014, 1070:1-9.
[15] HU W, GUO X X, WANG X C, et al. Rapid Discrimination of Different Grades of White Croaker Surimi by Tri-Step Infrared Spectroscopy Combined with Soft Independent Modeling of Class Analogy (SIMCA) [J]. Food Anal Methods, 2016, 9:831–839.
[16] WANG L X, WU Y Q, MEERSMAN F. Clarification of the thermally-induced pretransition of ribonuclease A in solution by principal component analysis and two-dimensional correlation infrared spectroscopy[J]. Vib Spectrosc. 2006, 42:201-205.
[17] BYLER D M, SUSI H. Examination of the secondary structure of proteins by deconvolved FTIR spectra [J]. Bioploymers,1986,25(3):469-487.
[18] PAVIA D L, LAMPMAN G M, KRIZ G S. Introduction to spectroscopy: a guide for students of organic chemistry[M].Brooks/Cole, 2009:50-72.
[19] CHEN J B, ZHOU Q, SUN S Q. Exploring the chemical mechanism of thermal processing of herbal materials by temperature-resolved infrared spectroscopy and twodimensional correlation analysis[J]. Anal. Methods, 2016,8:2243-2250.
[20] SUN S Q, CHEN J B, ZHOU Q, et al. Application of midinfrared spectroscopy in the quality control of traditional Chinese medicines[J]. Planta Med, 2010, 76:1987-1996.
