不同基原紫苏子及炮制品的化学成分差异性研究
2020-06-03马瑞瑞罗宇琴杨小龙官永河李国卫孙冬梅陈向东
马瑞瑞,罗宇琴,杨小龙,官永河,李国卫,孙冬梅,陈向东
(广东一方制药有限公司/广东省中药配方颗粒企业重点实验室,广东 佛山 528244)
唇形科紫苏属一年生草本植物紫苏Perillafrutescens(L.) Britt.有1个种、3个变种和7个变型,3个变种分别为白苏Perillafrutescens(L.) Britt var typica (Makino) Makino、紫苏Perillafrutescens(L.) Britt var acuta (Thunb.) Kudo和皱紫苏Perillafrutescens(L.) Britt var crispa(Thunb.) Decne。本植物变异极大,我国古书上称叶全绿的为白苏,称叶两面紫色或面青背紫的为紫苏,白苏的花通常白色,紫苏花常为粉红至紫红色,白苏被毛通常稍密,果萼稍大,香气亦稍逊于紫苏[1]。2015年版《中国药典》仅收载紫苏子作为药用植物来源[2],因药材细小,历来混伪品较多。孙俊英[3]等对山东省市售的51批紫苏子进行质量分析,结果显示市售紫苏子饮片不合格率较高,掺伪掺杂现象较严重。
目前,研究紫苏子及其变种白苏子鉴别的文献较少,樊宝和等[4]通过紫外光谱及薄层色谱法研究紫苏子和白苏子成分的差异,发现紫苏子与白苏子成分虽有相同之处,但也有差异,不宜等同入药。王雪利等[5]对目前市场上流通的紫苏子及其伪品的微性状进行真伪对比鉴别,得到在网眼大小、表面是否存在向上凸起的网脊以及是否存在腺鳞等性状方面紫苏子及其混伪品存在较大差异。黄亮辉等[6]采用HPLC法测定白苏子和紫苏子生品及其不同炮制品中迷迭香酸的含量,通过苏子的HPLC图中特征峰的强弱,可以区分白苏子与紫苏子。李燕等[7]对基于HPLC指纹图谱的紫苏子及其炮制品的质量进行研究,通过苏子的HPLC图中特征峰(峰)的缺失区分紫苏子与其炮制品炒紫苏子。以上研究均未考察紫苏子及白苏子化学成分的差异性,本文通过建立紫苏子的UPLC特征图谱,对紫苏子、白苏子及炒紫苏子进行对比分析,为紫苏子药材的鉴别提供依据。
1 材料与仪器
1.1 仪器
Waters H-Class型超高效液相色谱仪(沃特世公司),Agilent SB C18色谱柱(2.1 mm×100 mm,1.8 μm);ME204E型万分之一天平(梅特勒-托利多公司);XP26型百万分之一天平(梅特勒-托利多公司);HWS-28型电热恒温水浴锅(上海一恒科技有限公司);KQ-500型数控超声波清洗仪(昆山市超声仪器有限公司);Milli-Q Direct型超纯水系统(默克股份有限公司)。
1.2 材料
紫苏子及白苏子药材由广东一方制药有限公司提供,经广东一方制药有限公司魏梅主任中药师鉴定分别为紫苏子Perillafrutescens(L.) Britt.及白苏子Perillafrutescens的干燥成熟果实,其中炒紫苏子为实验室自制,样品信息见表1。

表1 样品信息表Table 1 Sample information table
1.3 试药
咖啡酸对照品(批号:110885-201703,质量分数99.7%)、迷迭香酸对照品(批号:110871-201706,质量分数90.5%)、木犀草素对照品(批号:111520-201605,质量分数99.6%)、芹菜素对照品(批号:111901-201603,质量分数99.2%)均由中国食品药品检定研究院提供;乙腈为色谱纯,水为超纯水,其他试剂为分析纯。
2 方法
2.1 色谱条件
以Agilent SB C18(2.1 mm×100 mm,1.8 μm)为色谱柱;以乙腈为流动相A,0.1%甲酸溶液为流动相B,梯度洗脱(0~6 min,10%→18%A;6~15 min,18%→50%A);流速为0.3 mL/min;检测波长为330 nm;柱温为30 ℃;进样量为2 μL。
2.2 对照品溶液的制备
精密称取咖啡酸、迷迭香酸、木犀草素及芹菜素对照品适量,加80%(体积分数,下同)甲醇溶液制成含每1 mL含咖啡酸32.6617 μg、迷迭香酸256.658 μg、木犀草素36.364 μg、芹菜素37.751 μg的混合对照品储备液。取混合对照品储备液1 mL,加80%甲醇定容于10 mL,得到每1 mL含咖啡酸3.266 μg、迷迭香酸25.666 μg、木犀草素3.636 μg、芹菜素3.775 μg的混合对照品溶液。置于4 ℃冰箱中保存,备用。
2.3 供试品溶液的制备
取紫苏子饮片(过2号筛)适量,取约0.5 g,精密称定,置具塞锥形瓶中,精密加入80%甲醇25 mL,称定质量,加热回流60 min,放冷,用80%甲醇补足减失质量,摇匀,滤过,取续滤液,即得。
2.4 方法学考察
2.4.1 专属性试验 取紫苏子药材按“2.3”项方法制备供试品溶液,分别取空白溶剂、对照品溶液及供试品溶液,各进样2 μL,色谱图见图1。可见,该分析方法能正确检测所指认的特征峰,阴性无干扰。
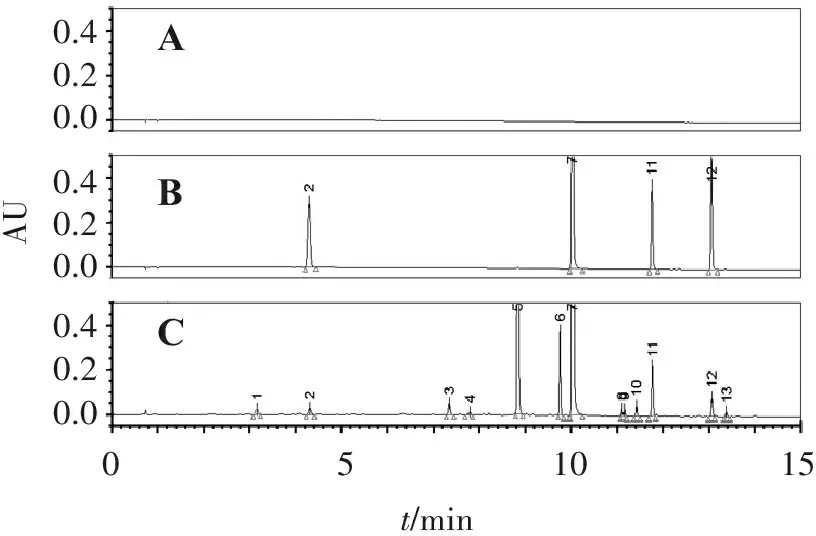
ABC0.40.20.00.40.20.00.40.20.0AU051015t/min
A.空白溶液; B.混合对照品溶液; C.紫苏子供试品溶液;峰2.咖啡酸;峰7.迷迭香酸;峰11.木犀草素;峰12.芹菜素。
图1紫苏子特征图谱专属性考察
Figure1The specificity of characteristic chromatograms ofPerillasubplants
2.4.2 精密度试验 取紫苏子药材,按“2.3”项方法制备供试品溶液,按“2.1”项色谱条件重复进样6次。以迷迭香酸峰为参照峰S,计算各特征峰与S峰的相对保留时间及相对峰面积,结果各色谱峰相对保留时间RSD值均<1%,相对峰面积的RSD值均<5%,表明仪器精密度良好。
2.4.3 稳定性试验 取紫苏子药材,按“2.3”项方法制备供试品溶液,按“2.1”项色谱条件,分别在0、2、4、6、8、12 h进样。以迷迭香酸峰为参照峰S,计算各特征峰与S峰的相对保留时间及相对峰面积,结果各色谱峰相对保留时间的RSD值均<1%,相对峰面积的RSD值均<5%,表明供试品溶液在12 h内稳定。
2.4.4 重复性试验 取同一批紫苏子药材,按“2.3”项方法平行制备6份供试品溶液,按“2.1”项色谱条件进样测定。以迷迭香酸峰为参照峰S,计算各特征峰与S峰的相对保留时间及相对峰面积,结果各色谱峰相对保留时间的RSD值均<1%,相对峰面积的RSD值均<5%,表明方法重复性较好。
2.4.5 中间精密度试验 不同人员在不同时间,取同一批紫苏子按“2.3”项方法平行制备6份供试品溶液,按“2.1”项色谱条件在不同仪器分别进样。以迷迭香酸峰为参照峰S,计算各特征峰与S峰的相对保留时间及相对峰面积,结果各色谱峰相对保留时间的RSD值均<1%,相对峰面积RSD值均<5%,表明方法中间精密度较好。
2.5 样品测定
基于已建立的特征图谱方法对紫苏子不同炒制品进行测定,以迷迭香酸峰为参照峰,分别计算各色谱峰相对保留时间和相对峰面积。
3 结果与分析
3.1 样品测定结果
对上述23批样品的特征图谱进行测定,以迷迭香酸峰为参照峰,分别计算各色谱峰相对峰面积,结果见表2。可见:不同基原紫苏子及其炮制品相对峰面积的RSD值在35.15%~162.59%范围,表明不同基原紫苏子及其炮制品之间有明显差异。从不同产地紫苏子来看,河北省安国市的3批紫苏子(Z8、Z9、Z10)与炒紫苏子(C8、C9、C10)表现为峰4缺失,说明不同产地间的样品也存在成分差异。
3.2 单因素方差分析
对不同基原紫苏子及其炮制品的特征图谱相对峰面积通过SPSS V 20.0统计软件进行方差齐性检验及单因素方差分析,结果见表3。方差齐性检验中,峰2、峰3不满足方差齐性的假设(P<0.05),考虑到这两个峰数据较小,所以剔除;单因素方差分析中,峰1、峰2、峰3、峰5、峰6、峰10、峰11及峰12在不同基原紫苏子及其炮制品存在显著差异(P<0.05),推断基于上述特征峰可实现对不同基原紫苏子及炮制品进行有效区分。
3.3 多重比较
基于单因素方差分析结果,采用最小显著差数法LSD进一步对不同基原紫苏子及其炮制品进行多重比较[8],结果见表4。
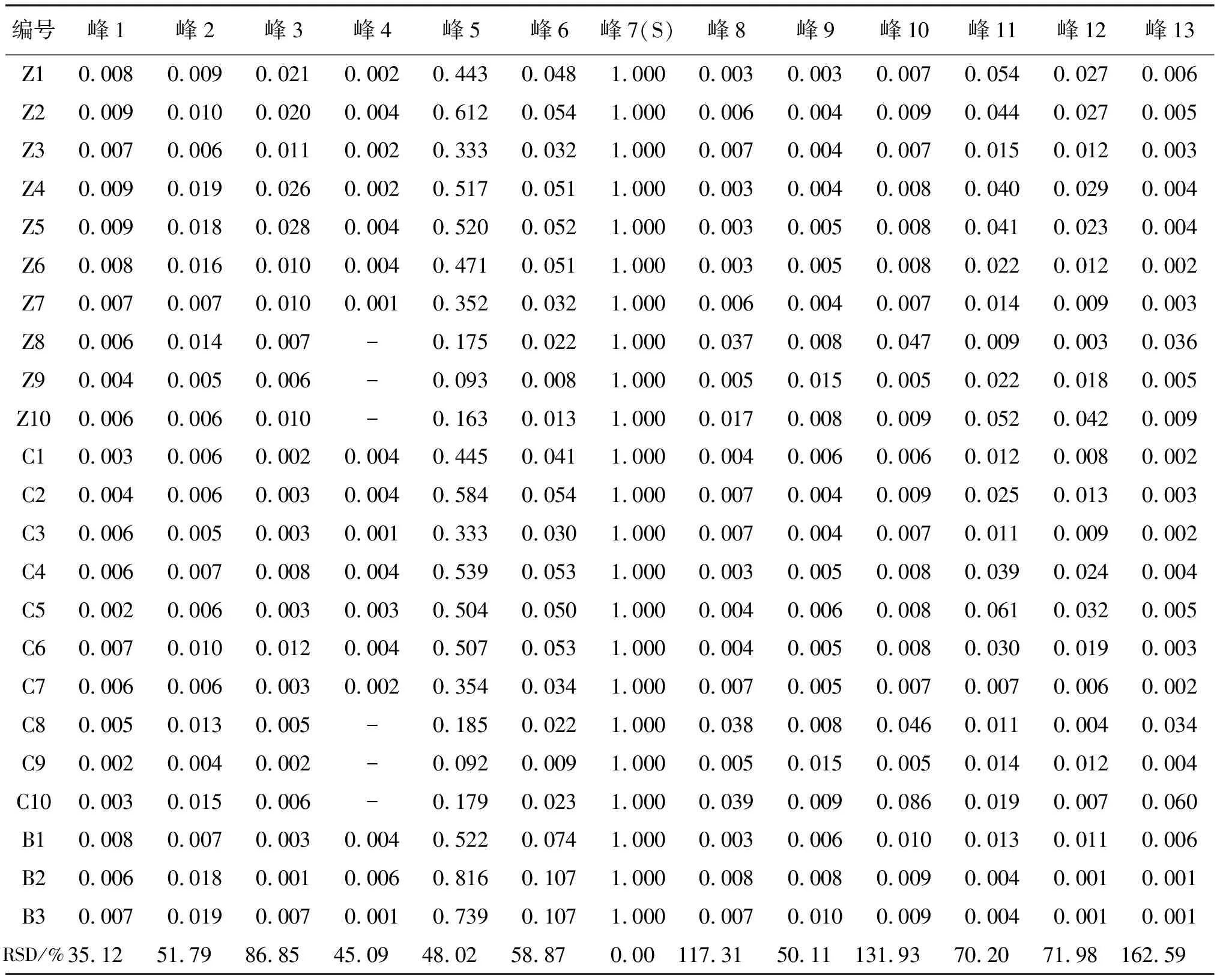
表2 23批样品特征图谱相对峰面积测定结果Table 2 The relative peak area of 23 lots of sample characteristic chromatograms
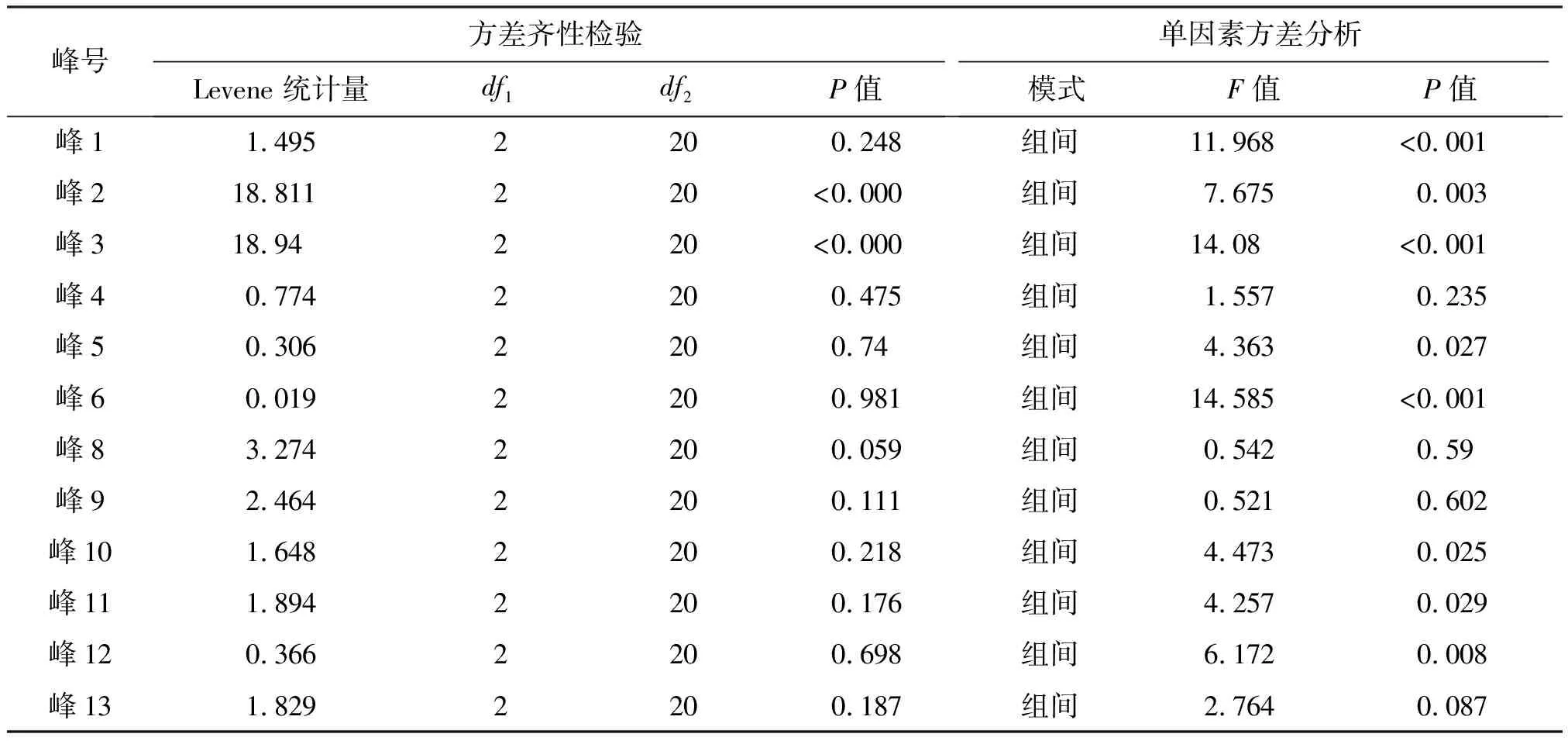
表3 方差齐性检验和单因素方差分析Table 3 Homogeneity of variance test & One-way anova
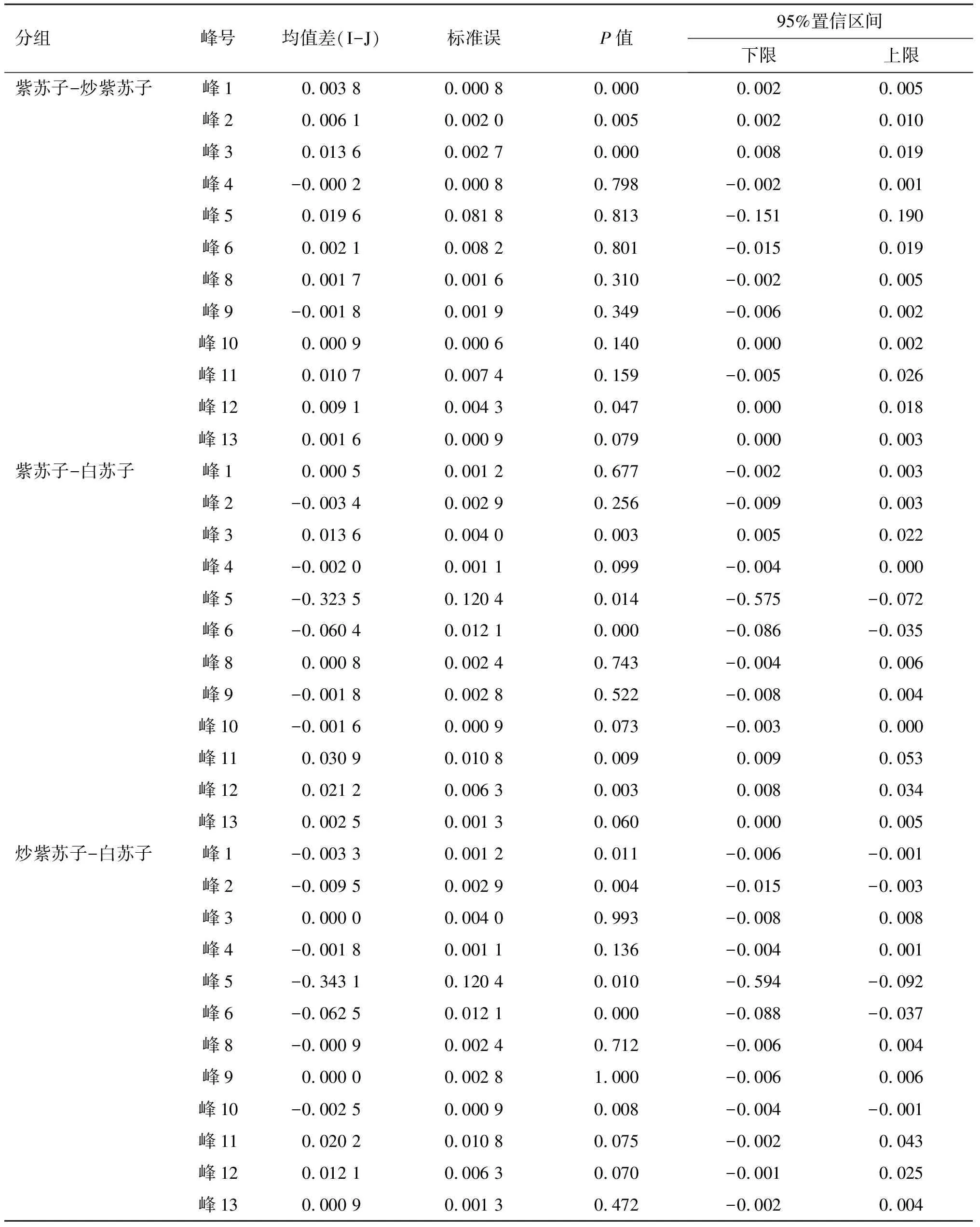
表4 多重比较结果Table 4 Results of multiple comparisons
由表4可见,不同基原紫苏子及其炮制品间的差异具有统计学意义(P<0.05),将多重比较相关信息整理,可以得出3组不同样品之间存在显著差异的特征峰,结果见表5。
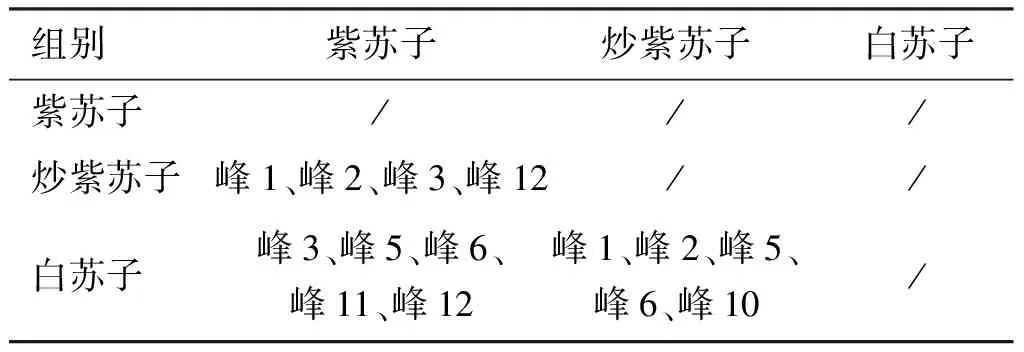
表5 组间差异特征峰Table 5 The characteristic peaks of difference between groups
由表5和图2可见,紫苏子与炒紫苏子的峰1、峰2、峰3及峰12,紫苏子与白苏子的峰3、峰5、峰6、峰11及峰12,炒紫苏子与白苏子的峰1、峰2、峰5、峰6及峰10之间的差异均具有统计学意义。
3.4 主成分分析
用SPSS V20.0软件对23批样品特征图谱所得的11个共有峰进行主成分分析,得出相关矩阵的特征值及方差分析,结果见表6。可见,前3个成分的特征值分别为4.253、2.472、2.272,对于总方差的累积贡献率达81.792%,基本保留了原样本信息,所以确定提取的主成分数为3个。根据主成分载荷矩阵表7可知,峰8和峰13对主成分1的影响最大,峰2对主成分2的影响较大,峰3对主成分3的影响最大。以3个主成分分别作为X、Y、Z轴得23个样品的主成分得分图,可以将23批样品分为3类,即Ⅰ类紫苏子、Ⅱ类炒紫苏子、Ⅲ类白苏子,见图3。主成分3在炮制后降低,可能是由于峰3对于温度比较敏感,可以用峰3来区分紫苏子与炒紫苏子,与多重比较结果一致。在Ⅰ类中有3批炒紫苏子(C4、C5、C6),在Ⅱ类中有1批紫苏子(Z8),这4组样品(C8和Z8,C4和Z4,C5和Z5,C6和Z6)分布位置靠近,推测可能是由于该4组样品与其他样品的组间差异较样品炮制前后的组内差异大导致。
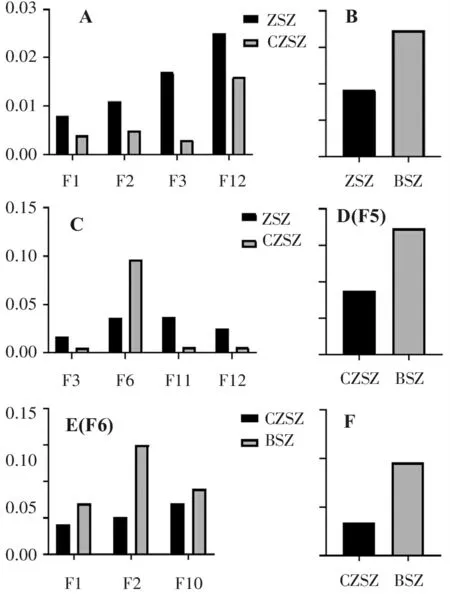
ZSZCZSZZSZCZSZCZSZBSZZSZBSZCZSZBSZCZSZBSZF1F2F10F3F6F12F11F1F2F12F30.030.020.010.000.150.100.050.000.150.100.050.00ABCD(F5)E(F6)F
A:紫苏子与炒紫苏子相对峰面积均值对比图; B~C:紫苏子与白苏子相对峰面积均值对比图; D~F:炒紫苏子与白苏子相对峰面积均值对比图。
图2不同基原紫苏子及其炮制品相对峰面积均值对比图
Figure2Comparison of the mean relative peak area ofPerillaseedsand their processed products
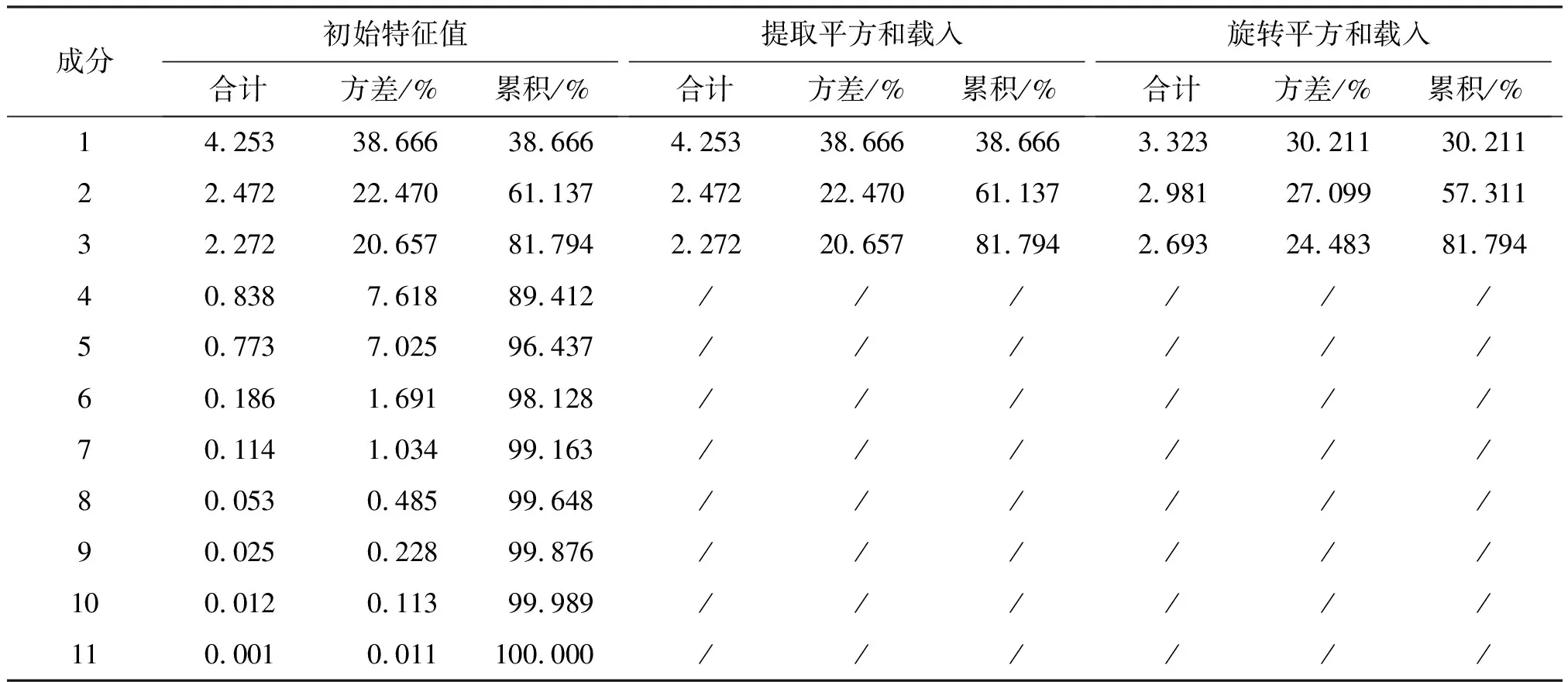
表6 特征值及方差分析Table 6 Characteristic value and analysis of variance
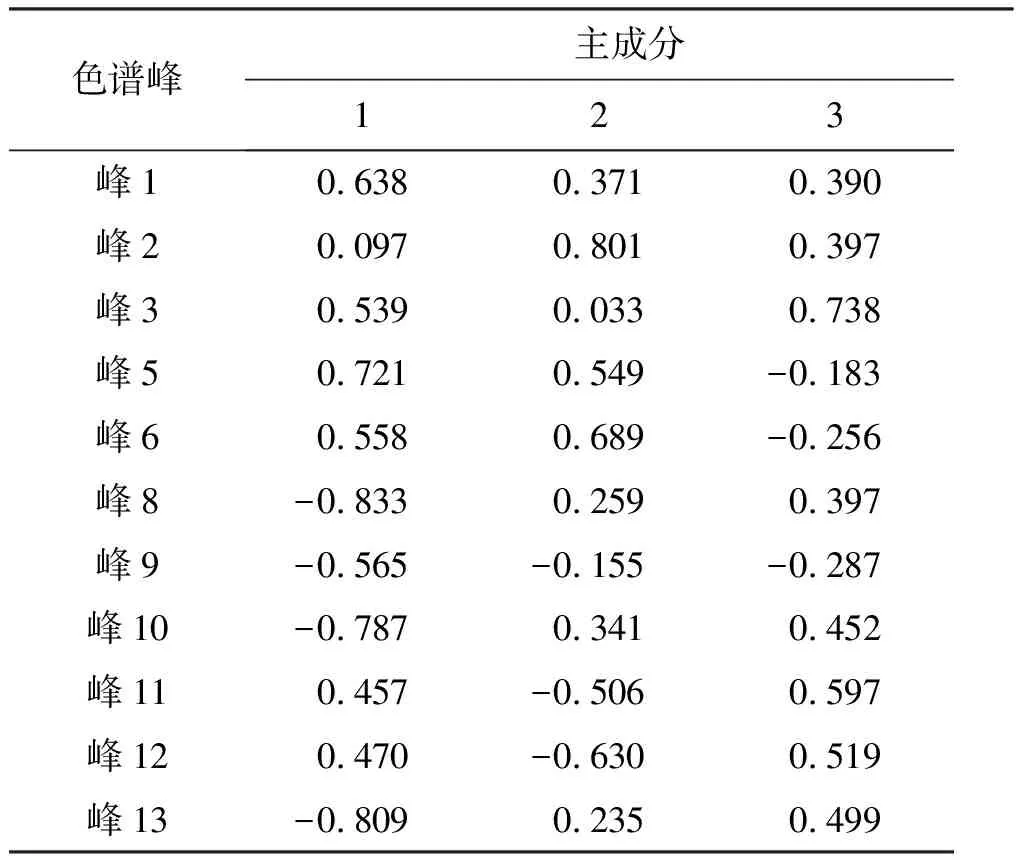
表7 主成分载荷矩阵Table 7 Principal component load matrix
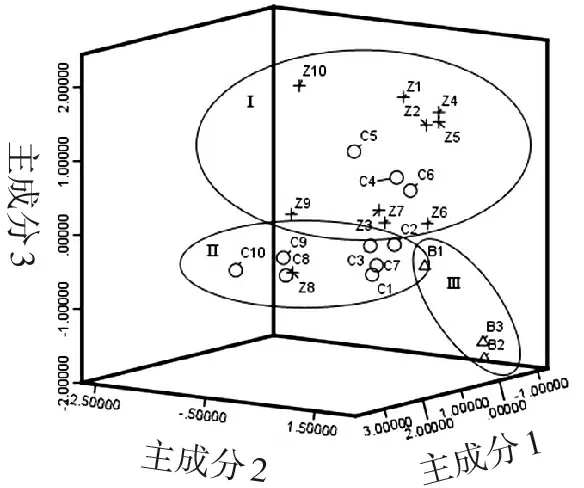
主成分1主成分2主成分3
图3主成分得分图
Figure3Principal component score plot
4 结论
本研究在建立紫苏子UPLC特征图谱方法的基础上,通过单因素方差分析、多重比较及主成分分析,对紫苏子、炒紫苏子及白苏子的化学成分进行了比较,总结出紫苏子炮制前后及不同基原间的成分差异规律,为紫苏子的质量标准制定、品质评价提供了参考;建立的紫苏子的UPLC特征图谱方法重现性良好,样品制备简单,分析时间短,为紫苏子的质量控制提供参考。
