V2O5/MoO3-SnO2催化氧化二甲醚氧化制备甲缩醛的研究
2018-04-01贾雯雯商永臣
陈 欣,贾雯雯,商永臣
哈尔滨师范大学化学化工学院,哈尔滨 150025
随着我国国民生活水平日渐提高,汽车用量也明显增多。日前我国大气质量明显下降,造成我国大面积雾霾的主要原因是汽车尾气。据统计,柴油汽车造成的汽车尾气污染指数远高于汽油汽车产生的尾气。因此开发一系列新型柴油添加剂的任务迫在眉睫,尽量减少尾气中污染物的排放,改善柴油燃烧性能。研究发现,甲缩醛因具有较高的含氧量与十六烷值,被广泛应用到柴油添加剂的开发和生产中[1-2]。甲缩醛具有良好的理化性能,其溶解性好、沸点低等特点被广泛应用到橡胶业、汽车行业用品等领域。同时,甲缩醛具有良好的去油能力与挥发性,作为清洁剂用来替代氟利昂,可减少挥发性有机物的排放,降低大气污染[3]。
甲缩醛的合成工艺主要有3种。其中由甲醇、甲醛在酸性催化剂条件下缩合反应制甲缩醛的方法最为成熟,但是这种制备方法能耗高,设备投资大,污染严重。甲醇直接一步氧化法制甲缩醛是将甲醇氧化反应与缩合反应耦合, 利用甲醇与氧气反应直接得到甲缩醛,该方法工艺简单,设备投资少,生产成本低,但是得到的甲缩醛浓度低,对催化剂的要求也比较高。笔者采用第3种制备方法,即二甲醚选择氧化法制备甲缩醛[4-6],该方法原料易得,制备工艺简单,生产成本低,采用该方法着重在于催化剂的选择和制备,选择具有适宜的氧化还原中心和酸中心的催化剂是实验成功的关键。
1 实验部分
1.1 试剂与仪器
偏钒酸铵,SnCl4·5H2O,(NH4)6Mo7O24·4H2O。
岛津GC-14C气相色谱仪,岛津有限公司;GCD-500G高纯氢气发生器;HYG-30空气气源发生器;连续流动固定床反应装置:不锈钢钢管(直径20 cm,长30 cm)、管式反应炉(龙口源邦电炉制造有限公司);CKW 1100控温仪,北京市朝阳自动化仪表厂。
1.2 催化剂的制备
取一定质量的偏钒酸铵加入适量蒸馏水溶解,将溶解后的溶液移至500 mL三颈瓶中待用。再称取适量的SnCl4·5H2O和(NH4)6Mo7O24·4H2O,分别加入50 mL蒸馏水搅拌溶解,用15%的氨水做沉淀剂,将SnCl4·5H2O水溶液逐滴滴加到偏钒酸铵溶液中,保持pH为8,搅拌,抽滤,洗涤,将所得溶液浸渍到钼酸铵溶液中,静置12 h,于80 ℃干燥10 h,干燥后研磨,于300 ℃马弗炉中焙烧5 h,然后升温至500 ℃继续焙烧8 h,即制得负载型V2O5/MoO3-SnO2催化剂[7]。
1.3 催化剂的评价
在常压条件下开始反应,实验装置采用实验室自制连续流动固定床,催化剂V2O5/MoO3-SnO2的填装量为2 mL。装管前将催化剂破碎至20~40目,并与相同体积、相同目数的细磁环混合后装入反应管,以防止催化剂在高温条件下失去活性。反应开始前,将催化剂在250 ℃的氧气环境中活化90~120 min,原气料中的氧气与二甲醚的气体体积比为1∶1。采用岛津GC-14C气相色谱仪进行产物分析,色谱仪采用HP-innowax色谱柱、FID检测器和TCD检测器。
2 结果与讨论
2.1 催化剂的表征
2.1.1X射线衍射表征
V2O5/MoO3-SnO2和MoO3-SnO22种催化剂的X射线衍射图如图1所示,2θ在23.14°,25.83°,27.41°,33.67°,39.01°处均出现了较强的MoO3的特征衍射峰;在26.60°,33.90°,37.94°,51.81°处均出现SnO2的特征衍射峰;V2O5/MoO3-SnO2催化剂上出现了MoO3、SnO2的衍射峰但没有发现V2O5的衍射峰。这是由于V2O5在催化剂中以离子形态高度均匀地分散在催化剂中,一定程度地增大了催化剂与反应物的接触面积[8],对催化反应更加有利。

图1 催化剂的XRD谱剂
2.1.2NH3-TPD表征
MoO3-SnO2和V2O5/MoO3-SnO2催化剂的NH3-TPD表征见图2。

图2 催化剂的NH3-TPD谱图
从图2中看出,采用同种制备方法制得的2种催化剂,MoO3-SnO2催化剂上出现2个NH3脱附峰,催化剂体现了强酸的酸性位,峰面积较大,酸中心数量偏多;而V2O5/MoO3-SnO2催化剂上出现了弱酸的酸性位,并且强酸酸性位的NH3脱附峰明显减弱,说明V2O5的加入降低了催化剂的酸性,减少了强酸中心的数量,使催化剂达到实验所需的酸性[9]。
2.2 催化氧化反应的单因素实验
2.2.1反应温度对催化剂性能的影响
当在二甲醚与氧气物质的量比为1、催化剂装填量为2 mL、体积空速为600 h-1时,在不同温度条件下考察了二甲醚与氧气反应中催化剂的催化性能,结果见图3。反应中二甲醚的转化率及所得产物的选择性随温度的变化而变化。起始时随着温度的升高,反应物的转化率和产物的选择性都在上升,当温度升高到160 ℃时,选择性和转化率达到峰值,随着温度持续升高,二甲醚转化率和甲缩醛选择性呈下降趋势。说明二甲醚160 ℃条件下更易催化氧化生成甲缩醛。

图3 反应温度对催化剂性能的影响
2.2.2体积空速对催化剂性能的影响
当二甲醚与氧气物质的量比为1、催化剂填装量为2 mL、反应温度为160 ℃时,产物选择性随体积空速的变化如图4所示。
当空速为600 h-1时,甲缩醛的选择性和二甲醚的转化率最高。体积空速为360 h-1时,产物选择性相对较低,这可能是由于在催化剂用量一定的情况下,空速相对较小时,二甲醚与氧气的流速均较小,向外扩散的阻力较大,使得二甲醚转化率较低;随着空速的不断增大,向外扩散的阻力减小,二甲醚的转化率增大;继续增大空速,二甲醚的转化率仍在增大,但是甲缩醛的选择性却在下降,这是由于在空速不断增大过程中,反应过程中副反应也在进行,使得副产物的产量也在增多,从而导致甲缩醛的选择性下降。

图4 空速对催化剂性能的影响
2.2.3反应时间对催化剂稳定性的影响
反应时间对催化剂性能的影响见图5。随着反应时间的增加,反应物二甲醚的转化率稳定升高,主产物甲缩醛的选择性呈下降趋势。分析认为这是由于反应时间大于3 h后,副产物甲酸甲酯和甲醛也会随着反应时间的增加而增加,导致下降趋势明显增大。这说明随着反应进行,催化剂的酸性中心逐渐减少。反应进行的前3 h,能达到比较高的转化率的产物的选择性,3 h以后甲缩醛的选择性明显降低。
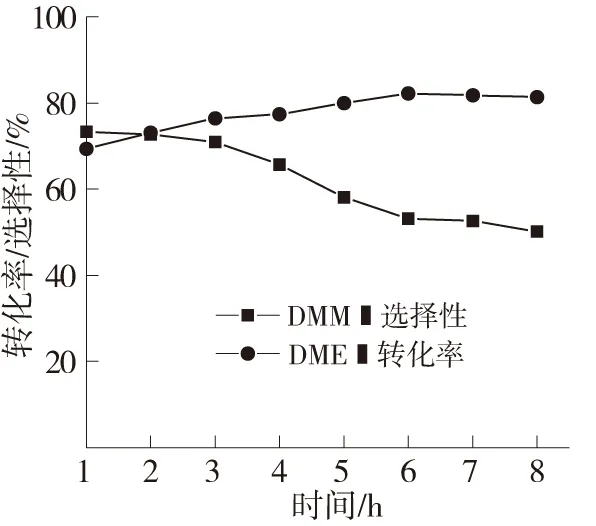
图5 反应时间对催化剂性能的影响
3 结论
采用沉淀浸渍法与共沉淀法合成了V2O5/MoO3-SnO2催化剂,研究结果表明反应进行的前3 h,反应温度为160 ℃、体积空速为600 h-1时催化剂能够达到最好的催化活性,二甲醚的转化率达到80.36%,甲缩醛的选择性也达到最大值82.21%。
