后腹腔镜肾部分切除术治疗肾门肿瘤与非肾门肿瘤(≤7 cm)的对比性分析
2018-03-31杨传策王振龙付德来王斌贤
杨传策,王振龙,薛 力,付德来,王斌贤,种 铁
(西安交通大学第二附属医院泌尿外科,陕西西安 710004)
肾门肿瘤,定义为位于肾门区域,术前影像学显示肿瘤与肾动脉或肾静脉或肾动、静脉直接接触的肿瘤,并在手术过程中证实[1-3]。非肾门肿瘤,不符合肾门肿瘤定义的肾肿瘤均为非肾门肿瘤。腹腔镜肾部分切除术(laparoscopic partial nephrectomy,LPN)自1993年MCDOUGALL[4]第1次报道以来,作为一种微创外科手术方式得到了飞速的发展,逐渐成为治疗局限性肾癌的优先手术方式。后来,多个文献报道了使用腹腔镜肾部分切除术治疗肾门肿瘤的研究,并证实LPN对于肾门肿瘤是一种可行的手术方式[5-8],但相关研究样本量较少,此篇文章通过回顾性分析本中心后腹腔镜下肾部分切除术治疗肾门肿瘤与非肾门肿瘤患者的围手术期数据、肾功能、肿瘤学预后等相关结果,来评估LPN治疗肾门肿瘤的有效性和安全性。
1 资料与方法
1.1临床资料2013年5月至2017年3月,在泌尿外科接受后腹腔镜肾部分切除术治疗的≤7 cm肾肿瘤患者共195例,其中缺乏术前影像学资料及失访病例27例,本次研究共纳入168例,其中肾门肿瘤27例,非肾门肿瘤141例。所有的病例术前均接受了多层螺旋CT或肾脏核磁等影像学的检查,用于获得肿瘤的特征,包括是否符合肾门肿瘤的定义,肿瘤直径,RENAL评分,并在手术中验证,肾门肿瘤影像学特点如图1。
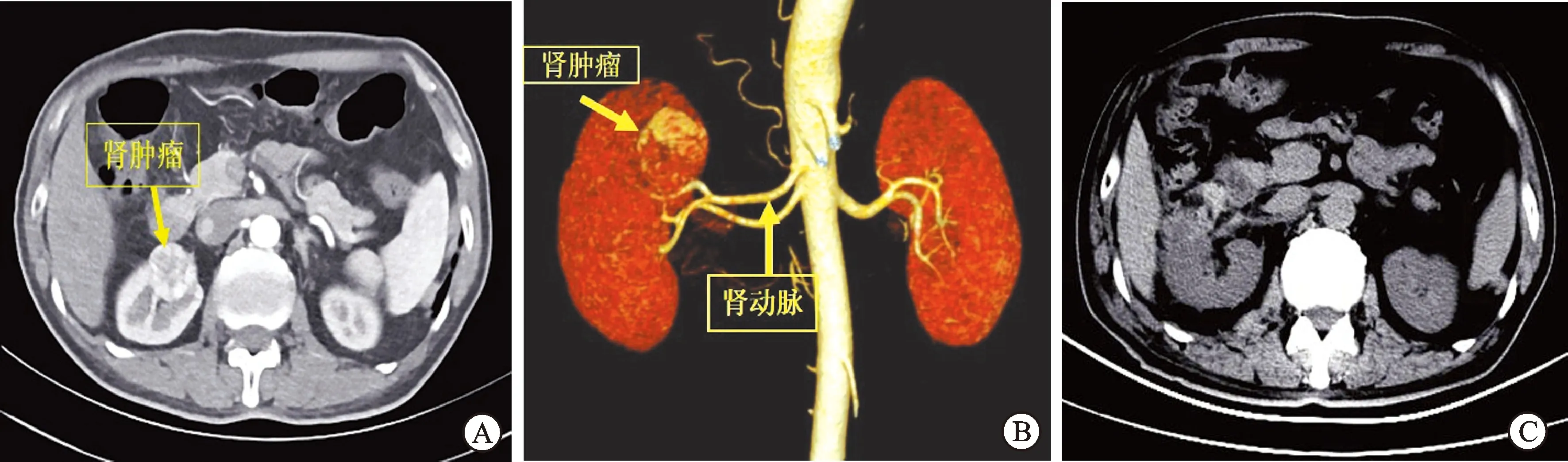
图1肾门肿瘤术前术后影像图
A:CT增强示右肾中部肿块皮质期明显不均匀强化,病灶内可见片状低密度未强化区;B:术前肾动脉成像示右肾肿块位于肾门部,并与右肾动脉接触;C:术后CT平扫示肿块完整切除。
术前收集患者性别、年龄、体重指数、美国麻醉医师协会(American Society of Anesthesiology,ASA)分级、肿瘤的肾脏左右侧、肾小球滤过率(estimated glomerular filtration rate,eGFR)等信息。术中的数据包括手术时间、出血量、热缺血时间、术中有无输血以及手术中转。术后的数据包括术后住院时间、输血、并发症、肿瘤病理类型、阳性切缘、术后1 d和3月的eGFR;并随访患者术后的肿瘤复发及远处转移情况。
1.2手术方法所有病例均采用腹膜后入路,建立腹腔后间隙后,建立3个Trocar通道和气腹腔,并插入腔镜,操作器械。分离出肾动脉,打开肾周筋膜,游离肾脏肿瘤,以动脉夹阻断肾动脉后,完整切除肿瘤组织。非肾门肿瘤只需单层缝合,肾门肿瘤需分层缝合。以3-0的V-Lock缝线缝合切缘基底部,再以2-0的V-Lock缝线连续缝合肾脏切口。去除肾动脉夹后,检查肾脏切口有无活动性出血,置入标本袋,将切除的肾肿瘤装入袋中并完整取出(图2、图3)。
1.3随访所有患者进行3~47个月的随访,术后1年内,3月复查1次,术后1至2年每6月复查1次,术后2年后每1年复查1次。常规检查包括:血常规、尿常规、肝肾功能、胸部、上腹部及双肾计算机断层扫描(computed tomography,CT)平扫,如怀疑有转移及复发,可进一步行局部CT平扫+增强。
1.4统计学方法所有数据采用SPSS20.0进行分析,连续性变量使用均值、标准差以及波动范围的表示方法,类别变量使用频数进行表示,连续性变量根据是否符合正态分布采用T检验或秩和检验,类别变量采用Pearsonχ2检验或Fisher确切概率检验,P<0.05为差异有统计学意义。
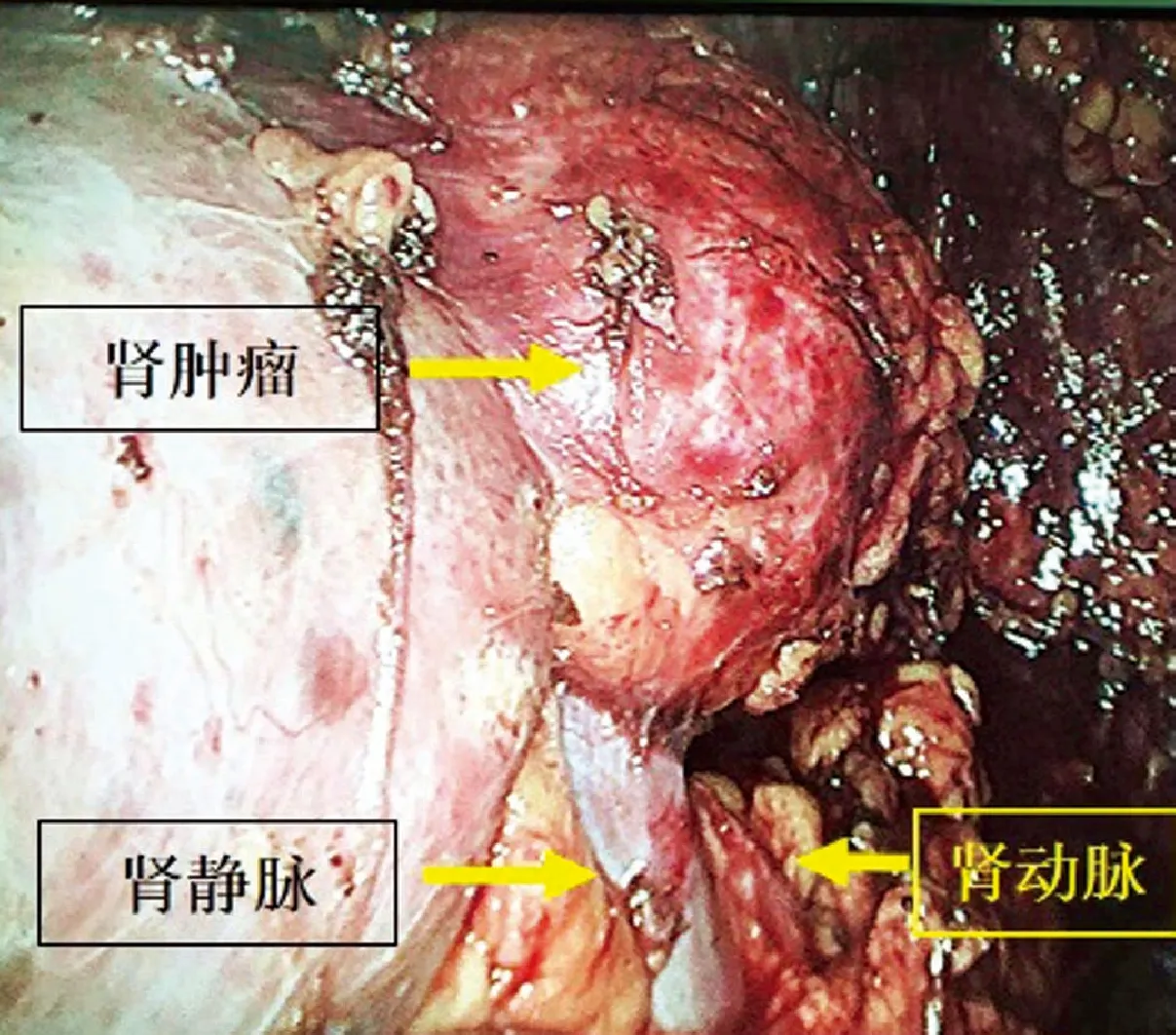
图2 术中腔镜下所见肿瘤与肾动脉及肾静脉位置关系
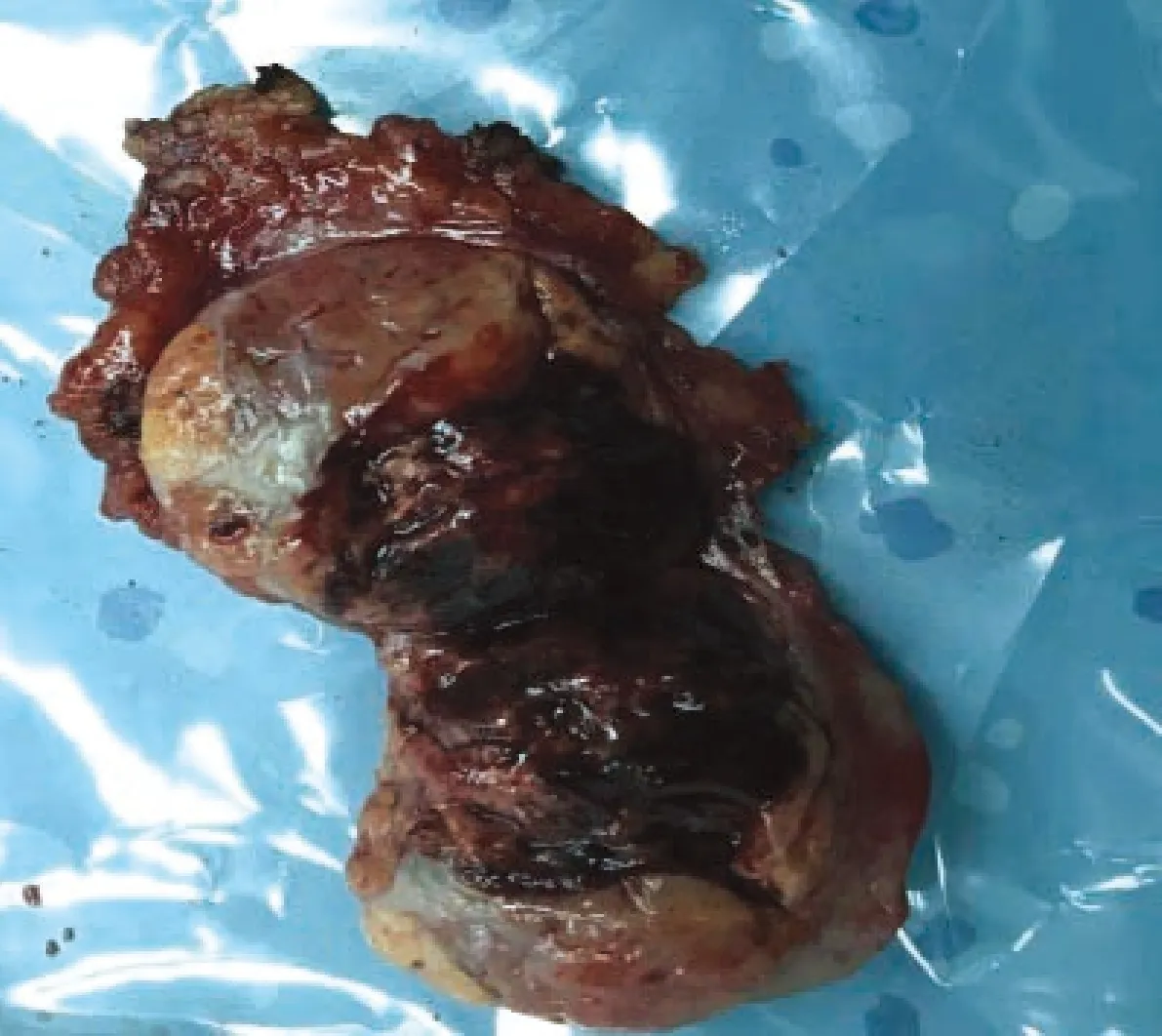
图3 手术切除肿瘤标本
2 结 果
2.1患者信息及肿瘤特征肾门肿瘤组和非肾门肿瘤组在年龄、性别、肿瘤累及侧、ASA分级、体重指数、术前eGFR均无显著性差异(P>0.05)。肾门肿瘤组肿瘤直径大于非肾门肿瘤组肿瘤直径,有显著性差异(P<0.001)。术后两组病理类型比较,无统计学差异(P>0.05)。肾门肿瘤组与非肾门肿瘤组RENAL评分对比,两组有显著性差异(P<0.001,表1)。
2.2围手术期手术数据肾门肿瘤组相较于非肾门肿瘤组,两组在手术时间、失血量、热缺血时间、术后住院时间、术中及术后输血并无显著性差异(P>0.05)。肾门肿瘤组27例患者中有2例在手术当中改行根治性肾切除术,无阳性切缘;非肾门肿瘤组141例患者中有2例在术中转为根治性肾切除术,另有1例术后病理示切缘阳性,再次行肾根治性手术(表2)。
2.3术后并发症肾门肿瘤组出现术后并发症1例(3.7%),为术后漏尿,术后10 d漏尿无法缓解后,再次手术行双J管置入术引流。非肾门肿瘤组出现术后并发症7例,并发症发生率5.0%,分别为术后出现漏尿2例,血尿、腹膜后血肿、肺栓塞、下肢静脉血栓、频发房早各1例,漏尿患者通过积极观察,后自行缓解,血尿患者症状无法控制,行介入治疗止血;其余病例根据症状给予相应处理,症状缓解,两组患者术后并发症无显著性差异(P>0.05,表2)。
2.4肾功能肾门肿瘤组与非肾门肿瘤组术后1 d及术后3月肾小球滤过率较术前均降低,但两组比较并无显著性差异(P>0.05),肾门肿瘤组术后3月eGFR较术前eGFR下降了13.2%,非肾门肿瘤组术后3月eGFR较术前下降了10.6%,但两组术后3月与术前eGFR的差值并无显著性差异(P>0.05,表2)。
2.5肿瘤复发及转移对两组患者进行术后随访,肾门肿瘤组平均随访12.2个月(3~27月),相关影像学检查发现有1例(3.7%)患者出现骨转移;非肾门肿瘤组平均随访19.2个月(3~47月),有1例(0.7%)出现肺转移(表2)。
表1肾门肿瘤组与非肾门肿瘤组患者信息及肿瘤特征
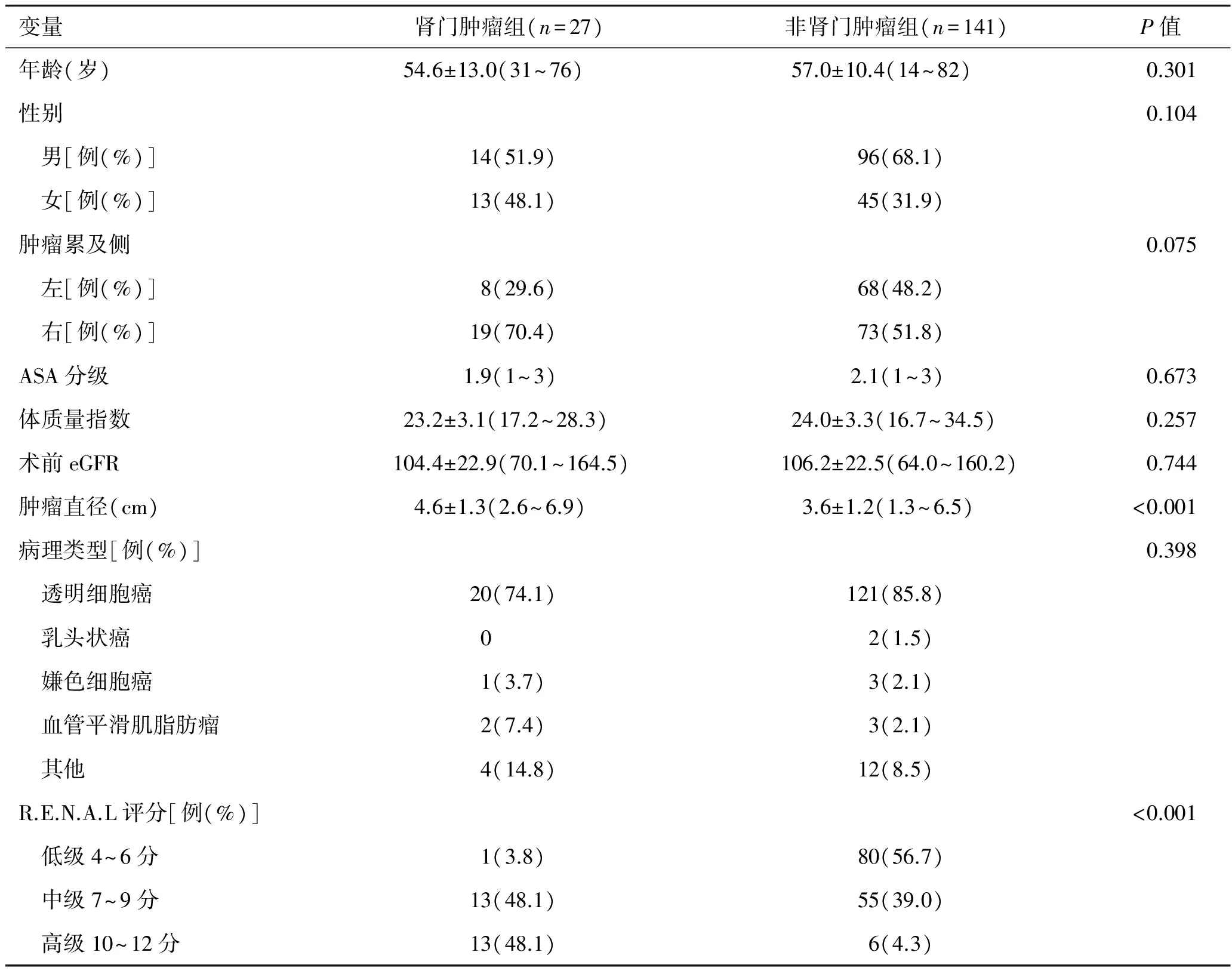
变量肾门肿瘤组(n=27)非肾门肿瘤组(n=141)P值年龄(岁)54.6±13.0(31~76)57.0±10.4(14~82)0.301性别0.104 男[例(%)]14(51.9)96(68.1) 女[例(%)]13(48.1)45(31.9)肿瘤累及侧0.075 左[例(%)]8(29.6)68(48.2) 右[例(%)]19(70.4)73(51.8)ASA分级1.9(1~3)2.1(1~3)0.673体质量指数23.2±3.1(17.2~28.3)24.0±3.3(16.7~34.5)0.257术前eGFR104.4±22.9(70.1~164.5)106.2±22.5(64.0~160.2)0.744肿瘤直径(cm)4.6±1.3(2.6~6.9)3.6±1.2(1.3~6.5)<0.001病理类型[例(%)]0.398 透明细胞癌20(74.1)121(85.8) 乳头状癌02(1.5) 嫌色细胞癌1(3.7)3(2.1) 血管平滑肌脂肪瘤2(7.4)3(2.1) 其他4(14.8)12(8.5)R.E.N.A.L评分[例(%)]<0.001 低级4~6分1(3.8)80(56.7) 中级7~9分13(48.1)55(39.0) 高级10~12分13(48.1)6(4.3)
注:ASA分级:美国麻醉医师协会分级;R.E.N.A.L评分(即肿瘤最大直径/肿瘤侵入深度比例/与集合系统的距离/方位/肾极线之间的关系),低分值4~6分,中分值7~9分,高分值10~12分。
表2肾门肿瘤组与非肾门肿瘤组围手术期数据及并发症比较
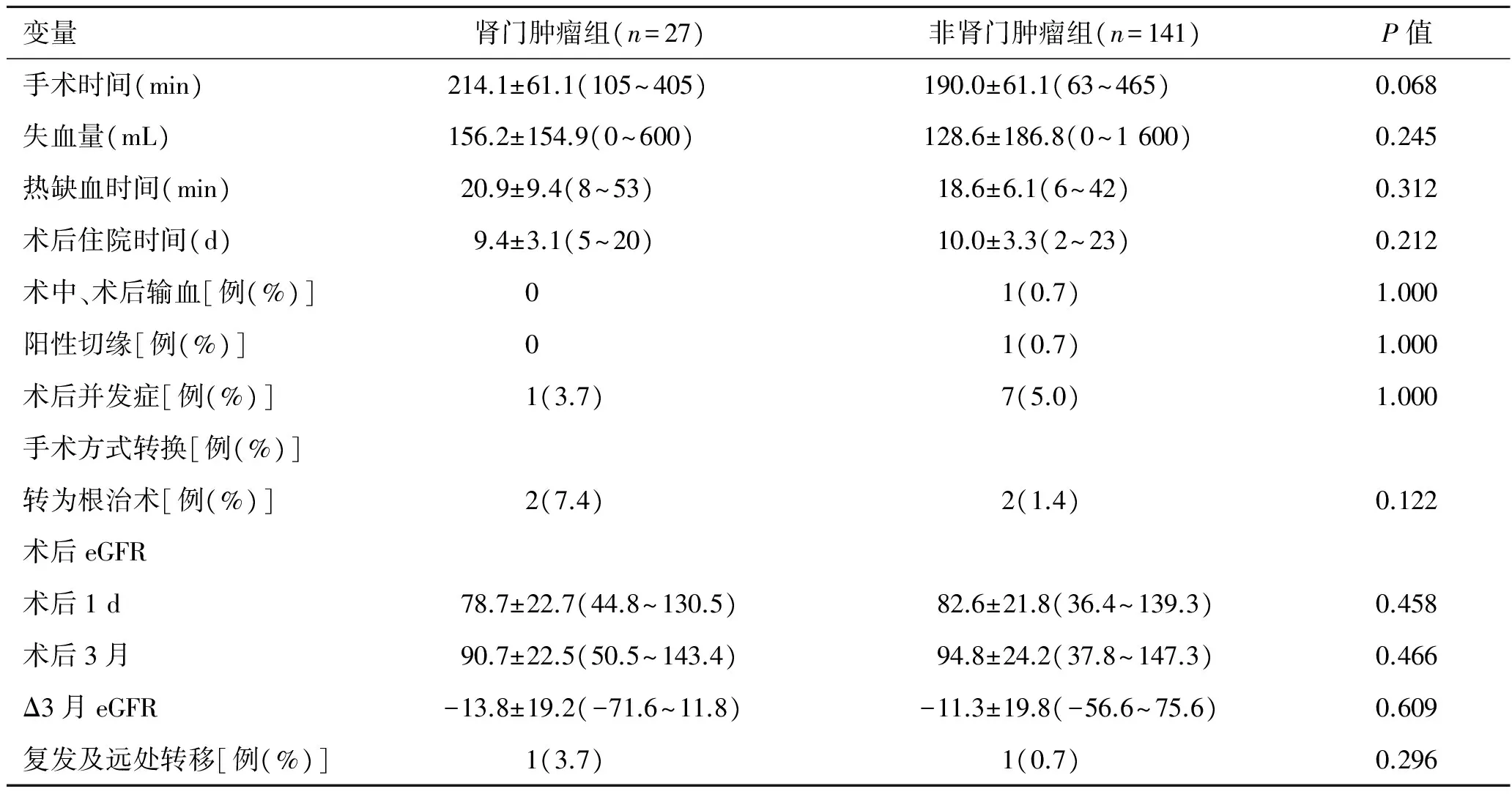
变量肾门肿瘤组(n=27)非肾门肿瘤组(n=141)P值手术时间(min)214.1±61.1(105~405)190.0±61.1(63~465)0.068失血量(mL)156.2±154.9(0~600)128.6±186.8(0~1600)0.245热缺血时间(min)20.9±9.4(8~53)18.6±6.1(6~42)0.312术后住院时间(d)9.4±3.1(5~20)10.0±3.3(2~23)0.212术中、术后输血[例(%)]01(0.7)1.000阳性切缘[例(%)]01(0.7)1.000术后并发症[例(%)]1(3.7)7(5.0)1.000手术方式转换[例(%)]转为根治术[例(%)]2(7.4)2(1.4)0.122术后eGFR术后1d78.7±22.7(44.8~130.5)82.6±21.8(36.4~139.3)0.458术后3月90.7±22.5(50.5~143.4)94.8±24.2(37.8~147.3)0.466Δ3月eGFR-13.8±19.2(-71.6~11.8)-11.3±19.8(-56.6~75.6)0.609复发及远处转移[例(%)]1(3.7)1(0.7)0.296
注:eGFR:肾小球滤过率;Δ3月eGFR指术后3月与术前eGFR的差值。
3 讨 论
术前肿瘤特征的比较可以看出,肾门肿瘤复杂程度显著,给腹腔镜治疗肾门肿瘤增加了难度,这也是既往肾门肿瘤不采取LPN的重要原因。肾门肿瘤与非肾门肿瘤手术技巧差异巨大,对于腹腔镜肾部分切除术治疗肾门肿瘤的手术要点,我们有几点体会:第一是充分暴露肾蒂血管,包括肾动脉、肾静脉以及输尿管,尽量避免手术中切除、缝合中的副损伤,其中肾动脉的远端尽量游离至肾窦,尽可能在血管近端放置血管阻断钳,以便在肾门处保留足够的操作空间,以及手术中转的迅速实施;非肾门肿瘤,常规只需要暴露肾动脉即可。第二,肾门肿瘤的游离需要将所有的肾周脂肪均游离干净,全肾游离的好处是可以提供更大的活动空间和旋转角度,利于后续的肿瘤切除和缝合;非肾门肿瘤只需要局部游离脂肪。第三,肾门肿瘤的切除方法采用钝锐结合的方法,钝性为主,特别是肿瘤基底部,钝性从血管表面剥离。采用顺行和逆行切除相结合的方式,顺行方式即为从肾脏肿瘤表面向肿瘤基底部切除,逆行方式为自肾血管表面、肿瘤基底向肾脏表面、肿瘤顶部切除,这样的优点是减少肾血管及肾盂损伤,保证肾门前后唇肿瘤基底部的完整性。第四,肾脏创面的缝合方法,对于切口不深的非肾门肿瘤而言,一般只需要进行单层缝合,而肾门肿瘤均采用分层缝合的方式,缝合基底层与表面层,基底层缝合目的是为了封闭集合系统以及大血管,缝合方式的技巧包括为:进针要浅,以免形成动静脉瘘或缝住肾动脉或输尿管,形成动脉狭窄或肾积水;对于创面过大的情况,可采用裙边缝合技术,从肾血管表面进针,肾皮质表面出针,可起到压迫性止血的目的。KHALLFEH等[9]介绍了“V”形缝合技术关闭肾门创面的手术方式,但这项技术针对一些广泛的肾门创面就会变得难以实施。另外,也有报道提出,肾门肿瘤切除后,创面基底肾脏血管及集合系统裸露,采用全层连续锁边缝合,缝合时由里向外进针,可以达到缩短手术时间、缝合平整以及缝合层次少的优点[10]。这均是基于各自的操作习惯和实践经验进行的总结,我们手术中的裙边缝合技术适应了肾门肿瘤的解剖要点,并在临床实践中取得了满意的效果。
多个单中心报道了利用LPN治疗肾门肿瘤的围手术期数据,平均热缺血时间范围为24~36.4 min,平均手术时间范围为140~238 min,平均失血量范围为165~394.4 mL[2,5-7,11],相关结果证实LPN能够有效的治疗肾门肿瘤。本次研究中,肾门肿瘤组在手术时间(214.1 minvs.190.0 min)、失血量(156.2 mLvs.128.6 mL)、热缺血时间(20.9 minvs.18.6 min)方面比较,无显著性差异(P>0.05),可以看出LPN在治疗肾门肿瘤与非肾门肿瘤并无明显的效果差异。同时可以注意到,此次研究中的热缺血时间短于既往的报道,本中心LPN并没有采用无动脉夹的手术方式,那么热缺血时间的缩短,我们推测可能和操作者腔镜技术熟练有关,肾门肿瘤保肾手术的关键难题是肿瘤的切除和创面的缝合,这也是影响热缺血时间的关键因素,所以对于拥有丰富腹腔镜技术的术者而言,肾门肿瘤逐渐成为LPN治疗的可选择适应证。
LPN为了要尽可能完整切除肾门肿瘤,可能增加并发血管损伤或相关并发症的风险,另外也有残留阳性切缘导致肿瘤复发的可能。GEORGE[12]对接受LPN的43个肾门肿瘤患者和445个非肾门肿瘤患者进行了比较,结果显示两组并发症的概率分别是26%和13.7%,无显著性差异。本次研究中,肾门肿瘤组27例中有1例(3.7%)出现了漏尿,非肾门肿瘤组141例中有7例(5.0%)出现了术后并发症,两组比较无明显差异(P>0.05),可以看出,两组比较并没有如我们预想的肾门肿瘤组并发症发生率更高。肾门肿瘤组并发症低于非肾门肿瘤组,这可能与肾门肿瘤组的例数较少有关,另外也有可能是因为有2例因为术中操作风险大,果断中转为根治性肾切除术有关。另外,相较于相关文献[2,5,7,11-12]的报道,并发症发生率波动范围为5.5%~26%,而此次腹腔镜肾部分切除术治疗肾门肿瘤的并发症明显降低,笔者认为随着腹腔镜技术的熟练,是相关并发症风险逐渐降低的重要原因。
肾功能保护是评价肾部分切除术手术治疗效果的重要因素,GEORGE[12]对接受LPN的43个肾门肿瘤患者和445个非肾门肿瘤患者术后6月的肾功能情况比较发现,两组术后6月的肾功能分别降低(10.9 mL/minvs. 8.8 mL/min),分别较术前下降10.4%和9.3%。本研究中,肾门肿瘤组与非肾门肿瘤组比较,肾门肿瘤组3月eGFR较术前下降了13.2%。非肾门肿瘤组3月eGFR较术前下降了10.6%,但两组比较降低的幅度并无显著性差异(P>0.05)。这可能与热缺血时间的差异有关,热缺血时间的长短直接影响患者术后的肾功能,目前肾脏所能承受的热缺血时间为多少尚不能达成共识,但普遍认为30 min是一个分界线,肾动脉阻断30 min内是安全有效的。有学者回顾性的分析了184例保留肾单位术后6月的肾功能,热缺血时间小于20 min组的患侧肾脏GFR较术前下降了4.6%,热缺血时间20~30 min组的患侧肾脏GFR较术前下降了8.1%,热缺血时间30~40 min组的患侧肾脏GFR较术前下降了24.8%,大于40 min组的患侧肾脏GFR较术前下降了61.3%[13]。可见30 min确实对肾功能有明显的影响,手术在30 min之内被认为是安全的,但热缺血时间越短对肾脏的保护作用越好。另外也有研究报道通过将热缺血时间转变为冷缺血时间、分支动脉阻断以及早期放松肾动脉技术来尽可能降低热缺血时间,从而达到保护肾功能的目的[14]。本次研究中,肾门肿瘤组与非肾门肿瘤组热缺血时间无显著性差异,这也从一个方面佐证了两组术后的肾功能下降也无显著性差异。就结果而言,LPN在治疗肾门肿瘤和非肾门肿瘤肾功能保护方面能起到相同的效果。
肿瘤的复发和转移是评价手术安全性的最主要的指标,肾门部位是T1期肾癌术后复发的独立预后因素[15],多个文献报道,在平均12.3月至平均34月不等的随访过程中,未发现LPN治疗肾门肿瘤局部复发及转移情况[5,7,11],另有1篇文献报道在平均随访41.6个月后,有1例肾门肿瘤患者发生了局部复发,肾门肿瘤保留肾单位手术肿瘤学结果与非肾门肿瘤类似[12]。本次研究中,两组随访时间为3~47月,肾门肿瘤组平均随访12.2月,非肾门肿瘤组平均随访19.2月,两组各发生1例远处转移,肾门肿瘤组和非肾门肿瘤组无显著性差异,LPN治疗肾门肿瘤是安全的。
有学者指出肾门肿瘤体积较小者(直径小于4 cm),LPN是安全可行的[16]。而我们认为,虽然对于4~7 cm这部分的肾门肿瘤保留肾单位的难度较大,但通过充分准备,由腹腔镜技术熟练的术者操作,直径小于7 cm的肾门肿瘤均可以获得满意的治疗效果。
本研究也存在一些不足,本文采用了回顾性分析的方法,这可能导致选择性偏移,样本量的相对不足以及随访时间的相对较短,也可能对术后肿瘤的随访结果产生一定的影响。总之,腹腔镜肾部分切除术治疗肾门肿瘤(≤7 cm)是安全、有效的手术方式,手术风险、并发症及近期预后与非肾门肿瘤类似,但还需要更多的样本量和更长的随访时间。
[1] DULABON LM, KAOUK JH,HABER GP,et al. Multi-institutional analysis of robotic partial nephrectomy for hilar versus nonhilar lesions in 446 consecutive cases[J]. Eur Urol,2011,59(3):325-330.
[2] GILL IS, COLOMBO JR,FRANK I,et al. Laparoscopic partial nephrectomy for hilar tumors[J]. J Urol,2005,174(3):850-853; discussion 853-854.
[3] ROGERS CG, METWALLI A,BLATT AM,et al. Robotic partial nephrectomy for renal hilar tumors: a multi-institutional analysis[J].J Urol,2008,180(6):2353-2356; discussion 2356.
[4] MCDOUGALL EM,CLAYMAN RV,CHANDHOKE PS,et al. Laparoscopic partial nephrectomy in the pig model[J]. J Urol,1993,149(6):1633-1636.
[5] LATTOUF JB, BERI A,D’AMBROS OF,et al. Laparoscopic partial nephrectomy for hilar tumors: technique and results[J]. Eur Urol,2008,54(2):409-416.
[6] REISIGER K, VENKATESH R,FIGENSHAU RS,et al. Complex laparoscopic partial nephrectomy for renal hilar tumors[J]. Urology,2005,65(5):888-891.
[7] RICHSTONE L, MONTAG S,OST M,et al. Laparoscopic partial nephrectomy for hilar tumors: evaluation of short-term oncologic outcome[J]. Urology,2008,71(1):36-40.
[8] XU B, ZHANG Q,JIN J. Retroperitoneal laparoscopic partial nephrectomy for moderately complex renal hilar tumors[J]. Urol Int,2014,92(4):400-406.
[9] KHALIFEH A,AUTORINO R,HILLYER SP,et al. V-hilar suture renorrhaphy during robotic partial nephrectomy for renal hilar tumors: preliminary outcomes of a novel surgical technique[J]. Urology,2012,80(2):466-471.
[10] 罗光达,王昕凝,刘圣圳,等. 机器人辅助腹腔镜肾门部肿瘤切除术(65例报告)[J]. 微创泌尿外科杂志,2017,(01):24-27.
[11] DI PIERRO GB,TARTAGLIA N,ARESU L,et al. Laparoscopic partial nephrectomy for endophytic hilar tumors: feasibility and outcomes[J]. Eur J Surg Oncol,2014,40(6):769-774.
[12] GEORGE AK,HERATI AS,RAIS-BAHRAMI S,et al. Laparoscopic partial nephrectomy for hilar tumors: oncologic and renal functional outcomes[J]. Urology,2014,83(1):111-115.
[13] CHOI JD,PARK JW,CHOI JY,et al. Renal damage caused by warm ischaemia during laparoscopic and robot-assisted partial nephrectomy: an assessment using Tc 99m-DTPA glomerular filtration rate[J]. Eur Urol,2010,58(6):900-905.
[14] 吴进锋,朱庆国,胡敏雄,等. 腹腔镜超声在完全内生型和肾门旁肾肿瘤行肾部分切除术中的临床应用[J]. 微创泌尿外科杂志,2016,(06):331-335.
[15] SHIM M,SONG C,PARK S,et al. Hilar location is an independent prognostic factor for recurrence in T1 renal cell carcinoma after nephrectomy[J]. Ann Surg Oncol,2015,22(1):344-350.
[16] 刘可,王国良,黄毅,等. 腹腔镜肾部分切除术治疗复杂肾门肿瘤[J]. 北京大学学报:医学版,2012,(04):649-651.
(编辑 王 玮)