不同糖耐量孕妇血清FGF21水平与胰岛素功能关系
2018-03-31李灵玲
李灵玲,李 卉,肖 准
(1.四川省妇幼保健院,四川 成都 610031;2. 四川大学华西第二医院,四川 成都 610041)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指妊娠期间首次发生糖代谢异常,其患病率为2%~4.5%[1]。GDM的病理生理基础与2型糖尿病较为相似,两种疾病类型均与胰岛素抵抗和胰岛β细胞功能损伤密切相关,但目前有关GDM的具体病因尚未形成确切看法。目前,已有相关研究报道成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)在肥胖、糖尿病等群体中的变化情况[2],但有关FGF21在妊娠期正常糖耐量(gestational normal glucose tolerance,GNGT)、妊娠期糖耐量减低(gestational impaired glucose tolerance,GIGT)和GDM孕妇中的研究报道较为少见。为此,本研究将四川省妇幼保健院220例孕24~28周于本院行50g糖负荷试验阳性结果的孕妇作为研究对象,比较不同糖耐量情况下孕妇的FGF21水平的变化,进而探讨其与胰岛素敏感指数(Matsuda指数)、胰岛素抵抗指数(insulin resistance index,HOMA-IR)和胰岛β细胞功能(insulin-β cell function index,HOMA-β指数)的相关性,旨在为探讨FGF21在GDM患者胰岛β细胞功能的影响及其在疾病发生、发展中的作用提供一定的意义。
1资料与方法
1.1一般资料
将四川省妇幼保健院2016年6月至2017年6月220例孕24~28周于本院行50g糖负荷试验阳性结果(服糖后1hPG在7.8mmol/L及以上)的孕妇作为研究对象,年龄为21~34岁,平均为(26.37±3.06)岁。220例孕妇在7d后均接受75g口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),其中空腹血糖为5.8mmol/L,1h为10.6mmol/L,2h为9.2mmol/L,3h为8.1mmol/L[3]。按照其OGTT结果,分为GNGT 45例为N组(均低于上述值)、GIGT 60例为I组(一项高于上述值)和GDM 115例为D组(至少两项高于上述值)。排除:孕前多囊卵巢综合征;孕前患有糖耐量减低(impaired glucose tolerance,IGT)、糖尿病者;伴有急性感染和其他内分泌疾病者;伴有严重焦虑、抑郁的患者。本研究经本院医学伦理委员会批准,且220例孕妇均自愿参与并签署知情同意书。
1.2研究方法
1.2.1临床资料的收集
记录220例孕妇年龄、孕周、孕次、血压,并对其身高和体重进行测量,计算体质量指数(body mass index,BMI)。嘱孕妇空腹8h,在次日清晨取其肘静脉血3mL,进行75g OGTT,对其0h、1h、2h、3h的血糖和胰岛素的水平进行检测。其中,通过葡萄糖氧化酶法进行血糖检测,免疫荧光法进行胰岛素检测。
1.2.2 FGF21水平的检测
抽取220例孕妇空腹静脉血3mL,在常温静置30min;接着,以2 500r/min进行离心8~10min,取其血清,在-78℃下进行保存待测。通过酶联免疫吸附法对三组孕妇血清FGF21的含量进行检测,试剂盒由北京百奥森泰生物技术有限公司提供,并严格根据说明书指示完成检测。记录三组孕妇HOMA-IR、HOMA-β指数和Matsuda指数的水平。
1.3统计学方法
将各组相关数据录入SPSS 23.0版统计学软件进行数据处理,其中计量资料用均数±标准差(χ±S)表示,两两比较采用LSD-t检验,多组组间比较采用单因素方差分析法,而计数资料用百分率(%)表示,则用χ2检验,并通过Pearson相关性分析FGF21水平与HOMA-IR、HOMA-β指数和Matsuda指数的关系,检验水准为α=0.05,以P<0.05表明差异具有统计学意义。
2结果
2.1三组孕妇临床基本情况的比较
三组年龄、孕次和孕周的比较,均无明显差异(F值分别为0.74、0.19、0.24,均P>0.05);D组BMI、DBP、SBP及0 hIns均高于N组、I组,差异均有统计学意义(F值分别为7.97、8.24、8.14,均P<0.05);D组1 hIns、2hIns、3h Ins、0h PG、1h PG、2h PG及3h PG的水平均高于N组、I组,并且I组各指标的水平均高于N组,差异均有统计学意义(F值分别为10.45、11.24、9.57、10.39、8.89、9.73、10.59,均P<0.05),见表1。
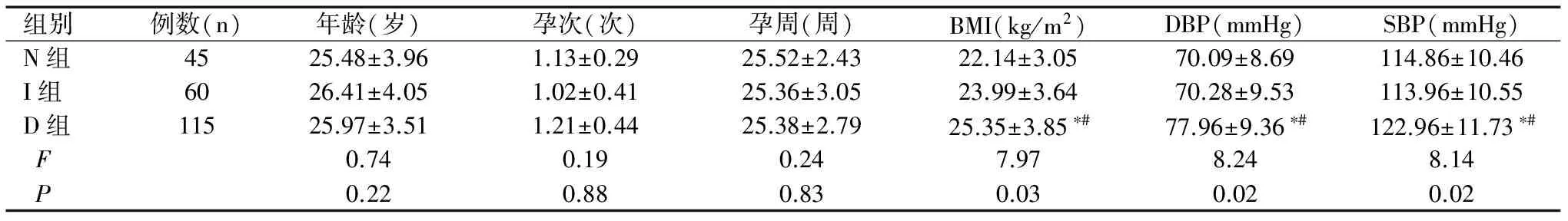
表1 三组孕妇临床基本情况的比较(χ±S)
(续表1)

组别 Ins(mU/L) PG(mmol/L) 01230123N组13.09±1.3673.95±12.4658.25±11.3525.73±5.244.49±0.297.23±1.356.21±0.795.09±0.83I组13.02±2.4381.06±9.35∗73.06±12.46∗39.67±13.54∗5.99±0.35∗9.25±1.47∗8.84±1.25∗7.27±1.07∗D组19.47±3.95∗#95.25±9.24∗#82.94±14.25∗#52.95±15.36∗#6.65±0.29∗#12.04±1.52∗#10.36±1.77∗#8.75±1.32∗#F10.4511.249.5710.398.899.7310.598.38P<0.01<0.01<0.01<0.01<0.01<0.01<0.010.01
注:与N组比较,*P<0.05;与I组比较,#P<0.05。
2.2三组血清FGF21水平、HOMA-IR、HOMA-β指数和Matsuda指数的比较
血清FGF21的水平和HOMA-IR在D组中的水平均为最高,其次是I组,而在N组中的水平均为最低,差异有统计学意义(F值分别为19.59、12.95,均P<0.05);HOMA-β指数和Matsuda指数在D组中均为最低,其次是I组,而在N组中均为最高,差异均有统计学意义(F值分别为9.52、10.55,均P<0.05),见表2。

表2 三组血清FGF21水平、HOMA-IR、HOMA-β指数和Matsuda指数的比较(χ±S)
注:与N组比较,*P<0.05;与I组比较,#P<0.05。
2.3 FGF21与HOMA-IR、HOMA-β指数和Matsuda指数的相关性
FGF21与HOMA-IR呈现正相关关系(r=0.32,P<0.05),其与HOMA-β指数、Matsuda指数均呈现负相关关系(r值分别为-0.28、-0.34,均P<0.05),见表3。
表3FGF21与HOMA-IR、HOMA-β指数和Matsuda指数的相关性
Table 3Correlation of FGF21 with HOMA-IR, HOMA-β index and Matsuda index

指标HOMA⁃IRHOMA⁃β指数Matsuda指数FGF21---r0.32-0.28-0.34P0.010.02<0.01
3讨论
3.1 FGF21的特点及其功能
FGF21作为近几年被发现的脂肪细胞因子之一,其以脂肪组织及肌肉为来源,主要表达于胰腺与肝脏中,同时少量分布于胸腺中。有研究报道,FGF21具有高效性的特点,可对机体糖脂代谢进行持续调节,进而改善胰岛素抵抗,增强胰岛β细胞功能,并且其不会导致其他糖尿病治疗药物发生率较高的并发症如低血糖等[4]。此外,已有研究指出,糖尿病动物模型长时间注射FGF21,可将血糖控制在正常水平,并且可明显减少血液中的胰岛素浓度,进而提高机体对胰岛素的灵敏性[5]。这一研究报道提示FGF21可能起到改善胰岛素抵抗的作用。既往研究指出,FGF21可利用减少2型糖尿病模型小鼠血清TNF-、IL-6及IL-1β的水平,进而起到改善2型糖尿病炎症细胞因子水平的作用,实现改善胰岛素抵抗的目的[6],但目前有关其具体影响机制的看法尚未明确。FGF21能够在不依赖胰岛素减轻血糖的基础上,可利用激活细胞外信号以对激酶1/2及Akt信号途径进行调节,对胰岛素分泌进行调节,进而发挥提高胰岛β细胞功能及其质量的作用。
3.2 FGF21、血糖及胰岛素水平在孕妇不同糖耐量状态下的变化情况
本研究发现,血清FGF21的水平和HOMA-IR在D组中的水平均为最高,其次是I组,而在N组中的水平均为最低;HOMA-β指数和Matsuda指数在D组中均为最低,其次是I组,而在N组中均为最高,差异均有统计学意义。结果提示,随着糖代谢异常的不断进展,使得FGF21被激活转录的活性不断提高。此外,本研究发现,D组BMI及0h Ins均高于N组、I组;D组中的1h Ins、2h Ins、3h Ins、0h PG、1h PG、2h PG及3h PG的水平均高于N组、I组,并且I组各指标的水平均高于N组。结果提示,随着糖代谢受损的进一步加重,孕妇血糖及胰岛素的水平均明显升高,导致胰岛素抵抗出现进行性加重,进而引起胰岛β细胞功能出现进行性减弱。
3.3 FGF21与胰岛β细胞功能的关系分析
已有研究指出,血液循环中影响IS的脂肪因子参与GDM的发病过程,并且部分脂肪因子的改变与孕妇胰岛β细胞功能存在密切联系[7]。本研究发现,FGF21与HOMA-IR呈现正相关关系(r=0.32,P=0.01),其与HOMA-β指数、Matsuda指数均呈现负相关关系(r=-0.28、-0.34,均P<0.05)。结果提示,随着血清FGF21水平的不断提高、胰岛素抵抗的进一步加重,胰岛β细胞功能进一步减弱,导致其糖耐量受损不断加重。分析其原因,可能因胰岛β细胞功能不能进行代偿,造成总体胰岛素分泌量降低,进而导致血糖水平的上升。随着糖代谢异常的进一步加重,孕妇血清FGF21的水平逐渐升高。推测其可能作为机体的一种保护性代偿机制,与高瘦素血症和高胰岛素血症的发生机制较为类似[8]。
综上所述,随着糖代谢异常的进一步加重,孕妇血清FGF21的水平逐渐升高,并且其与HOMA-IR、HOMA-β指数和Matsuda指数均存在相关性,可能与GDM的发生、发展密切相关。
[参考文献]
[1]Shen Y,Ma X,Zhou J,etal.Additive relationship between serum fibroblast growth factor 21 level and coronary artery disease[J]. Cardiovasc Diabetol,2013,12:124.
[2]仇希雯,王子莲,王冬昱.成纤维细胞生长因子21与妊娠期糖尿病关系的研究进展[J].中华妇产科杂志,2016,51(8):634-637.
[3]汪漪,徐勇,杜俏俏,等.妊娠期糖尿病对妊娠结局影响的病例对照研究[J].中国妇幼健康研究,2013,24(6):817-818.
[4]Tan B K,Sivakumar K,Bari M F,etal. Lower cerebrospinal fluid/plasma fibroblast growth factor 21 (FGF21) ratios and placental FGF21 production in gestational diabetes[J]. PLoS One, 2013,8(6):e65254.
[5]Ebert T,Stepan H,Schrey S,etal. Serum levels of irisin in gestational diabetes mellitus during pregnancy and after delivery[J]. Cytokine, 2014,65(2):153-158.
[6]Wang D,Zhu W,Li J,etal.Serum concentrations of fibroblast growth factors 19 and 21 in women with gestational diabetes mellitus: association with insulin resistance, adiponectin, and polycystic ovary syndrome history[J].PLoS One,2013,8(11):e81190.
[7]孟喜燕,侯沃霖,黄亚绢.胰岛素抵抗对血糖正常孕妇妊娠结局的影响[J].中国妇幼健康研究,2017,28(4):396-399.
[8]Li S M,Wang W F,Zhou L H,etal.Fibroblast growth factor 21 expressions in white blood cells and sera of patients with gestational diabetes mellitus during gestation and postpartum[J].Endocrine,2015,48(2):519-527.
