铜锌复合胁迫对包菜种子萌发、幼苗生长及子叶若干生理指标的影响
2018-03-31,,
, ,
(1.近海流域环境测控治理福建省高校重点实验室(福建师范大学 福清分校), 福建 福清 350300;2.福建师范大学 福清分校 海洋与生化工程学院, 福建 福清 350300)
铜和锌既是生物体的必需微量营养元素,又是环境污染元素,全球每年释放到环境中的锌为27.6万t,铜为14.7万t,锌、铜污染已经占较大的比重[1]。工业和矿业废弃物是最主要的重金属污染来源[2],包括铜锌矿床的开采过程,合金电镀、冶金等各种企业排放大量的铜锌酸性废水[3],含铜杀菌剂被广泛使用,含锌等三废作为土壤改良剂及肥料的使用造成土壤及农作物污染,进而危害人类的健康[4]。过量的铜会产生大量的自由基和丙二醛,抑制植物的生长,引起植物新陈代谢的紊乱[5]。锌过量时会对植物的正常生长造成伤害[6]。国内外关于铜锌复合胁迫对植物的生理毒害的研究主要集中在芦竹、西瓜、凤仙花等植物上。朱志国等研究结果表明,在较低铜锌复合浓度100 mg/kg下,芦竹植株开始出现伤害症状;随复合浓度的增大,叶片中叶绿素含量不断下降,CAT和SOD活性先升后降,POD活性持续下降,MDA和脯氨酸含量及细胞质膜透性均随复合浓度的增加而上升[7]。华玉丹等[8]、申晓慧等[9]研究均得出相似的结论:Cu-Zn处理对幼苗的生长表现出低促高抑效应。但是铜锌复合胁迫对包菜的毒害作用鲜见报道。本试验通过研究铜锌复合胁迫对包菜种子萌发、幼苗生长及若干子叶生理指标影响,来探索包菜对铜锌复合胁迫产生的应答,以期确定包菜生长的耐铜锌范围,为十字花科芸苔属其他蔬菜铜锌复合胁迫下的耐性研究提供参考。
1 材料与方法
1.1 试验材料
供试品种为京丰一号包菜。
1.2 试验设计
选择大小一致并且健康饱满的包菜种子,进行表面消毒5 min(0.40%高锰酸钾),消毒后先用自来水冲洗数次再用蒸馏水反复冲洗种子,最后用粗滤纸将水吸干后为种子萌发试验做准备。试验设计了8个处理,分别为对照(ck):0 mg/L CuSO4·5 H2O+0 mg/L ZnSO4·7 H2O(A 0)、100 mg/L CuSO4·5 H2O+100 mg/L ZnSO4·7 H2O(A 1)、200 mg/L CuSO4·5 H2O+200 mg/L ZnSO4·7 H2O(A 2)、300 mg/L CuSO4·5 H2O+300 mg/L ZnSO4·7 H2O(A 3)、400 mg/L CuSO4·5 H2O+400 mg/L ZnSO4·7 H2O(A 4)、500 mg/L CuSO4·5 H2O+500 mg/L ZnSO4·7 H2O(A 5)、600 mg/L CuSO4·5 H2O+600 mg/L ZnSO4·7 H2O(A 6)、800 mg/L CuSO4·5 H2O+800 mg/L ZnSO4·7 H2O(A 7)。消毒后的100粒种子铺放于9 cm培养皿(以2张滤纸作为基质)内,添加10 mL的铜锌复合处理液于各皿中(以湿润皿中所有种子),每处理设置3个重复,将各皿随机置于光照培养箱内(温度28.0 ℃,光照14 h/d,光强6 000 lx,黑暗10 h/d,湿度≥80%[10])培养,培养期内每天通过往皿内增加相应的处理液来维持浓度基本不变并保持湿度[11]。为保证种子的有氧呼吸,一般做法是使种子2/3浸在处理液中,1/3露在外面[12]。1 d后,开始观察发芽情况(当胚根长≥种子长,胚芽长≥1/2种子长时作为发芽标准[13]),发芽期间每隔1 d记录1次。
表1包菜种子萌发对铜锌复合胁迫的响应
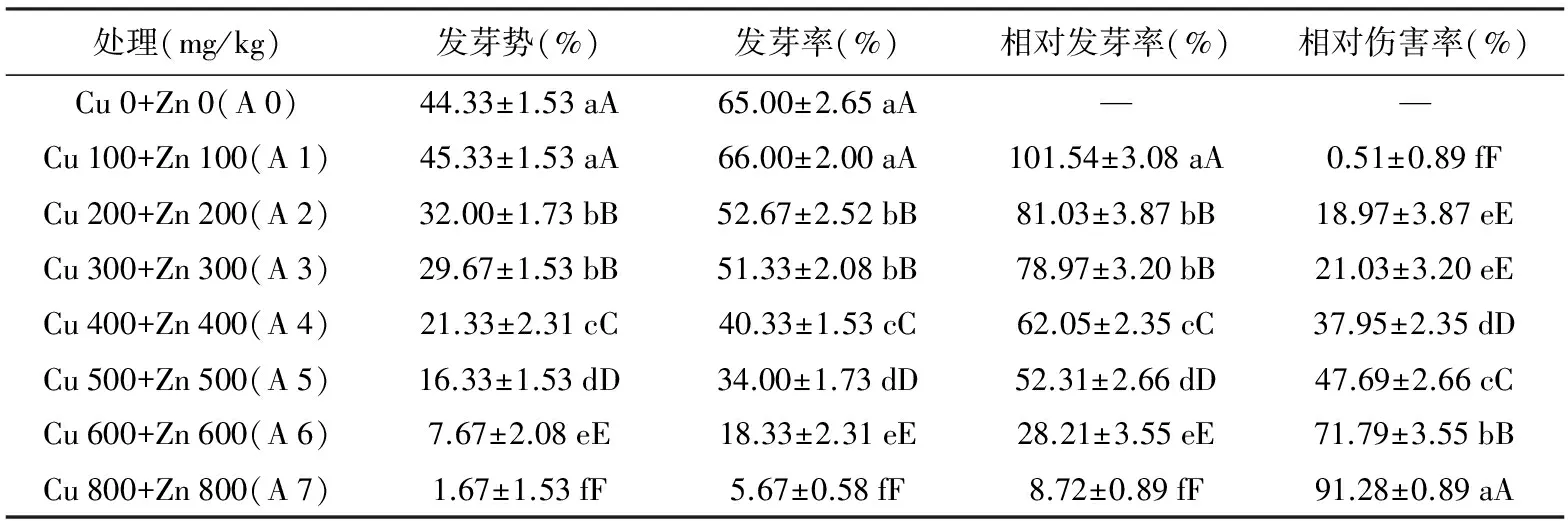
处理(mg/kg)发芽势(%)发芽率(%)相对发芽率(%)相对伤害率(%)Cu0+Zn0(A0)44.33±1.53aA65.00±2.65aA——Cu100+Zn100(A1)45.33±1.53aA66.00±2.00aA101.54±3.08aA0.51±0.89fFCu200+Zn200(A2)32.00±1.73bB52.67±2.52bB81.03±3.87bB18.97±3.87eECu300+Zn300(A3)29.67±1.53bB51.33±2.08bB78.97±3.20bB21.03±3.20eECu400+Zn400(A4)21.33±2.31cC40.33±1.53cC62.05±2.35cC37.95±2.35dDCu500+Zn500(A5)16.33±1.53dD34.00±1.73dD52.31±2.66dD47.69±2.66cCCu600+Zn600(A6)7.67±2.08eE18.33±2.31eE28.21±3.55eE71.79±3.55bBCu800+Zn800(A7)1.67±1.53fF5.67±0.58fF8.72±0.89fF91.28±0.89aA
注:大写字母为方差分析LSD法0.01水平上差异,小写字母为方差分析LSD法0.05水平上差异。下同。
表2包菜种子萌发对铜锌复合胁迫的响应
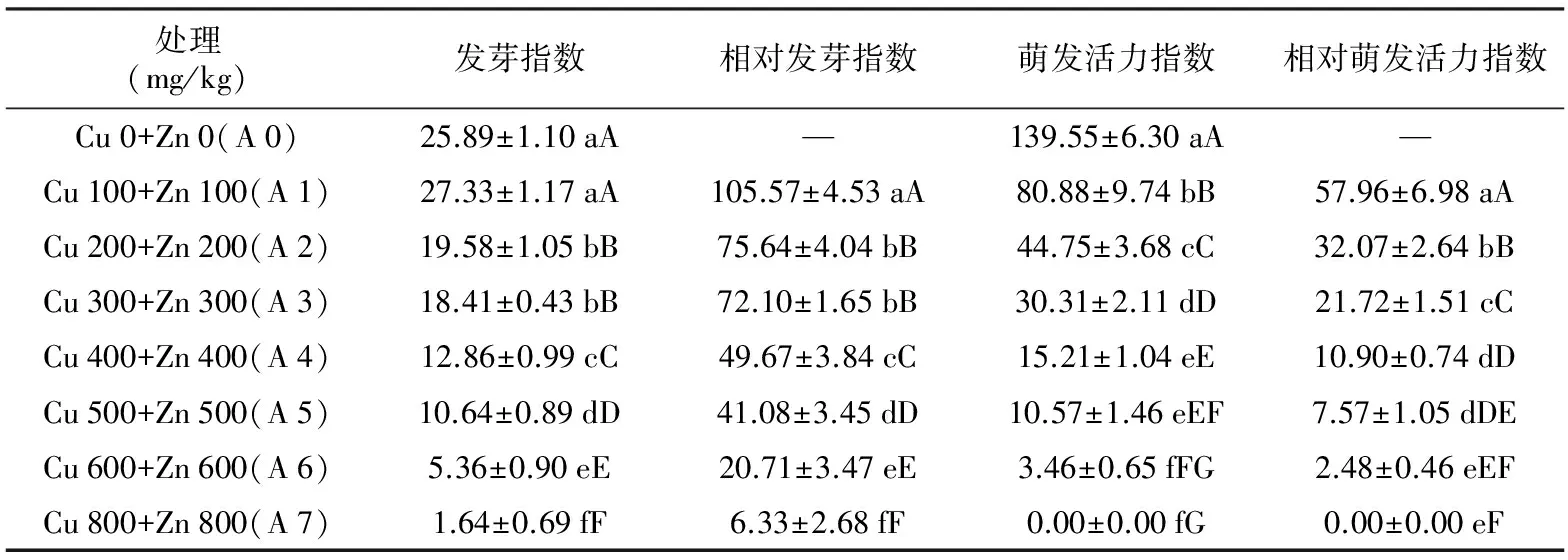
处理(mg/kg)发芽指数相对发芽指数萌发活力指数相对萌发活力指数Cu0+Zn0(A0)25.89±1.10aA—139.55±6.30aA—Cu100+Zn100(A1)27.33±1.17aA105.57±4.53aA80.88±9.74bB57.96±6.98aACu200+Zn200(A2)19.58±1.05bB75.64±4.04bB44.75±3.68cC32.07±2.64bBCu300+Zn300(A3)18.41±0.43bB72.10±1.65bB30.31±2.11dD21.72±1.51cCCu400+Zn400(A4)12.86±0.99cC49.67±3.84cC15.21±1.04eE10.90±0.74dDCu500+Zn500(A5)10.64±0.89dD41.08±3.45dD10.57±1.46eEF7.57±1.05dDECu600+Zn600(A6)5.36±0.90eE20.71±3.47eE3.46±0.65fFG2.48±0.46eEFCu800+Zn800(A7)1.64±0.69fF6.33±2.68fF0.00±0.00fG0.00±0.00eF
1.3 测定指标及方法
铜锌复合处理后3天测定包菜种子的发芽势,其它发芽指标则于7 d后统计;第8天每皿随机挑选20粒发芽种子测定其苗高和主根长[11]、苗干重和根干重的测定参考鲁如坤[14]的方法,子叶光合色素含量的测定参考沈伟其[15]的方法,子叶可溶性蛋白质含量的测定参考李合生[16]的方法,并按下列公式计算种子的发芽势、发芽率、相对发芽率、相对伤害率、发芽指数、相对发芽指数、萌发活力指数和相对萌发活力指数:
发芽势(第3天)=前3 d发芽种子数/供试种子总数×100%[17];
发芽率(第7天)=7 d内发芽种子数/供试种子总数×100%[17];
相对发芽率(%)=重金属处理发芽率/对照发芽率×100%[17];
相对伤害率(%)=(对照发芽粒数-各处理发芽粒数)/对照发芽粒数×100%[17];
发芽指数=∑Gt/Dt,式中:Gt为在t时间内的发芽总数,Dt为发芽天数[18];
相对发芽指数=重金属处理发芽指数/对照发芽指数×100%[18];
萌发活力指数=∑(Gt/Dt)×幼苗平均鲜重(或平均胚芽长+平均胚根长),其中鲜重单位为g,长度单位为cm[18];
相对萌发活力指数=重金属处理萌发活力指数/对照萌发活力指数×100%[18]。
1.4 统计分析
数据分析通过DPS软件处理,显著性检验采用LSD法。
2 结果和分析
2.1 包菜种子萌发对铜锌复合胁迫的响应
由表1和表2可知,包菜不受铜锌复合胁迫时(A 0),其种子的萌发活力指数达到最高值,为139.55 cm。当包菜受铜锌复合胁迫为Cu 100 mg/kg+Zn 100 mg/kg时(A 1),其种子的发芽指标均为最高,而相对伤害率为最低。随铜锌复合程度的加剧,包菜种子的萌发指标呈逐渐下降的态势,而相对伤害率越来越大。而当包菜受铜锌复合胁迫为Cu 800 mg/kg+Zn 800 mg/kg时(A 7),其种子的所有发芽指标均达到最小值,其种子的相对伤害率达到最大值,与对照(Cu 0+Zn 0)相比,其发芽势、发芽率、发芽指数、萌发活力指数分别下降了96.23%、91.28%、93.66%和100%。差异显著性表明,A 0处理与其他处理组间的发芽势、发芽率、发芽指数差异均达到极显著,但与A 1处理间的差异不显著;A 1处理的与其他处理组间的相对发芽率、相对发芽指数、相对萌发活力指数、相对伤害率差异均达极显著;对照组的萌发活力指数与A 1~A 8处理间的差异均达到极显著。由此可见,铜锌复合胁迫整体上不利于包菜种子的发芽。
表3包菜幼苗生长对铜锌复合胁迫的响应
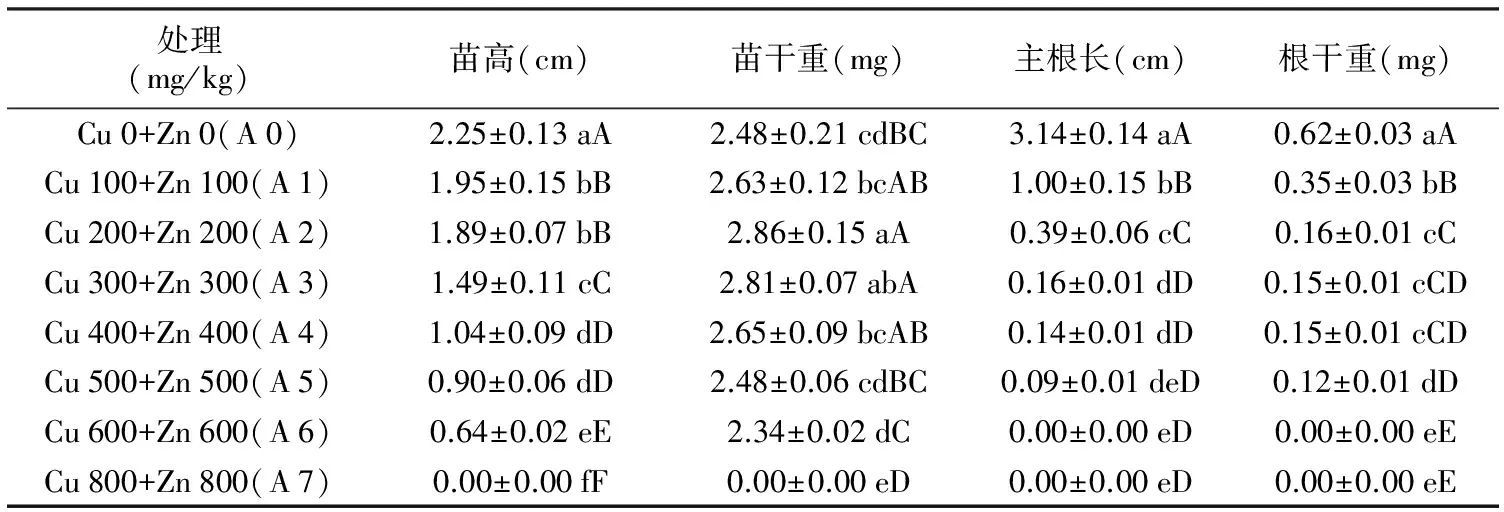
处理(mg/kg)苗高(cm)苗干重(mg)主根长(cm)根干重(mg)Cu0+Zn0(A0)2.25±0.13aA2.48±0.21cdBC3.14±0.14aA0.62±0.03aACu100+Zn100(A1)1.95±0.15bB2.63±0.12bcAB1.00±0.15bB0.35±0.03bBCu200+Zn200(A2)1.89±0.07bB2.86±0.15aA0.39±0.06cC0.16±0.01cCCu300+Zn300(A3)1.49±0.11cC2.81±0.07abA0.16±0.01dD0.15±0.01cCDCu400+Zn400(A4)1.04±0.09dD2.65±0.09bcAB0.14±0.01dD0.15±0.01cCDCu500+Zn500(A5)0.90±0.06dD2.48±0.06cdBC0.09±0.01deD0.12±0.01dDCu600+Zn600(A6)0.64±0.02eE2.34±0.02dC0.00±0.00eD0.00±0.00eECu800+Zn800(A7)0.00±0.00fF0.00±0.00eD0.00±0.00eD0.00±0.00eE
表4包菜子叶光合色素含量对铜锌复合胁迫的响应
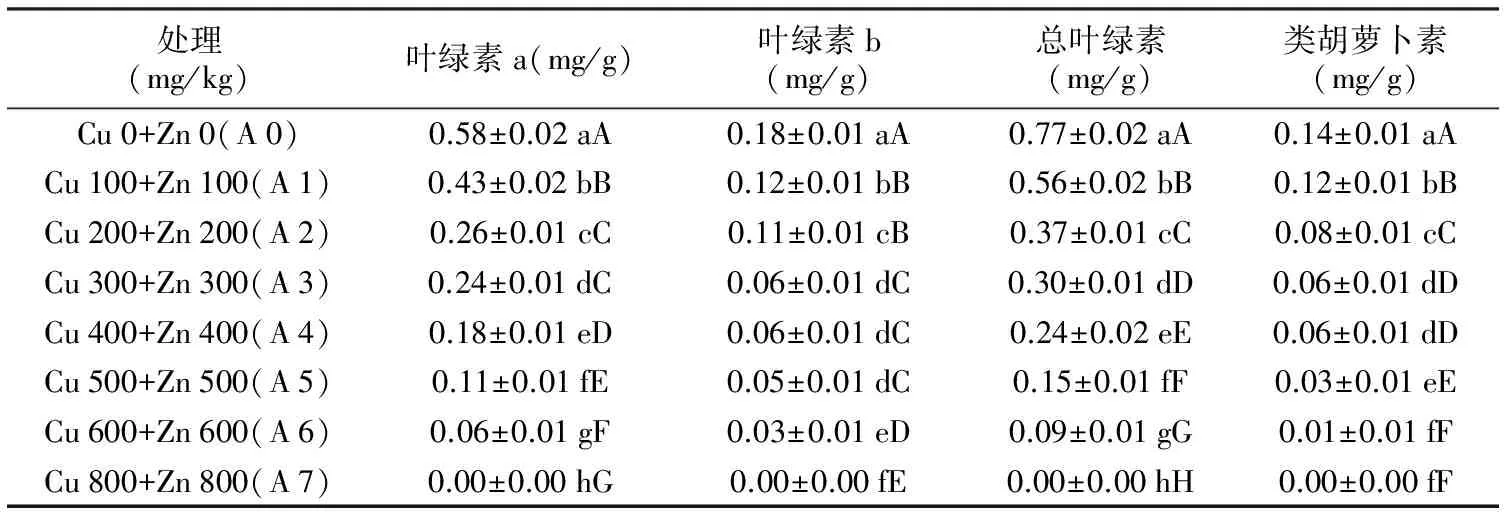
处理(mg/kg)叶绿素a(mg/g)叶绿素b(mg/g)总叶绿素(mg/g)类胡萝卜素(mg/g)Cu0+Zn0(A0)0.58±0.02aA0.18±0.01aA0.77±0.02aA0.14±0.01aACu100+Zn100(A1)0.43±0.02bB0.12±0.01bB0.56±0.02bB0.12±0.01bBCu200+Zn200(A2)0.26±0.01cC0.11±0.01cB0.37±0.01cC0.08±0.01cCCu300+Zn300(A3)0.24±0.01dC0.06±0.01dC0.30±0.01dD0.06±0.01dDCu400+Zn400(A4)0.18±0.01eD0.06±0.01dC0.24±0.02eE0.06±0.01dDCu500+Zn500(A5)0.11±0.01fE0.05±0.01dC0.15±0.01fF0.03±0.01eECu600+Zn600(A6)0.06±0.01gF0.03±0.01eD0.09±0.01gG0.01±0.01fFCu800+Zn800(A7)0.00±0.00hG0.00±0.00fE0.00±0.00hH0.00±0.00fF
2.2 包菜幼苗生长对铜锌复合胁迫的响应
由表3得出,包菜的苗高随铜锌复合浓度的增加呈降低的趋势,其他处理与A 0相比,分别减少了0.30~2.25 cm,降低了13.33%~100%;苗干重呈先升后降的趋势,Cu 200 mg/kg+Zn 200 mg/kg(A 2)处理时达到最大值,与对照(A 0)相比提高了15.32%;主根长和根干重均呈降低的趋势,Cu 800 mg/kg+Zn 800 mg/kg(A 7)处理的均为最低,与对照(A 0)相比分别下降了100%和100%。差异显著性结果表明,A 0处理的苗高、主根长和根干重与A 1~A 8处理的差异均达极显著;A 2处理的苗干重与A 3处理的差异不显著,与A 1、A 4处理间的差异达显著,与A 0、A 5、A 6和A 7处理间的差异均达极显著。
可见,铜锌复合胁迫整体上不利于包菜幼苗的生长,但包菜的苗干重出现低促高抑效应。
2.3 包菜子叶光合色素含量对铜锌复合胁迫的响应
由表4可以看出,包菜子叶中的各光合色素含量均随铜锌复合浓度的加剧呈逐渐减少的趋势。当包菜不受铜锌污染时,其子叶中的各类色素含量均达到最大。当包菜经Cu 800 mg/kg+Zn 800 mg/kg(A 7)处理后,与对照相比(A 0),叶绿素a、叶绿素b、总叶绿素和类胡萝卜素分别降低了100%、100%、100%和100%。差异显著性结果表明,A 0处理的与其他处理间的光合色素含量差异均达到极显著水平。总之,铜锌复合胁迫抑制包菜子叶光合色素的合成。
2.4 铜锌复合胁迫对包菜子叶可溶性蛋白质含量的影响
由图1可知,随铜锌复合浓度的加剧,包菜子叶的可溶性蛋白质含量呈先增再减的态势,A 3处理的达到最大值(为5.52 mg/g),与对照组(A 0)相比,上升了123.48%;而A 7处理达到最低(为0.00 mg/g),与对照组(A 0)相比下降了100%。差异显著性结果表明,A 3处理的与A 2处理间的可溶性蛋白质含量差异不显著,与其他处理组间的差异均达极显著水平。
可见,低浓度的铜锌复合胁迫有利于提高包菜子叶中可溶性蛋白质的含量,高浓度的则抑制其合成可溶性蛋白质。
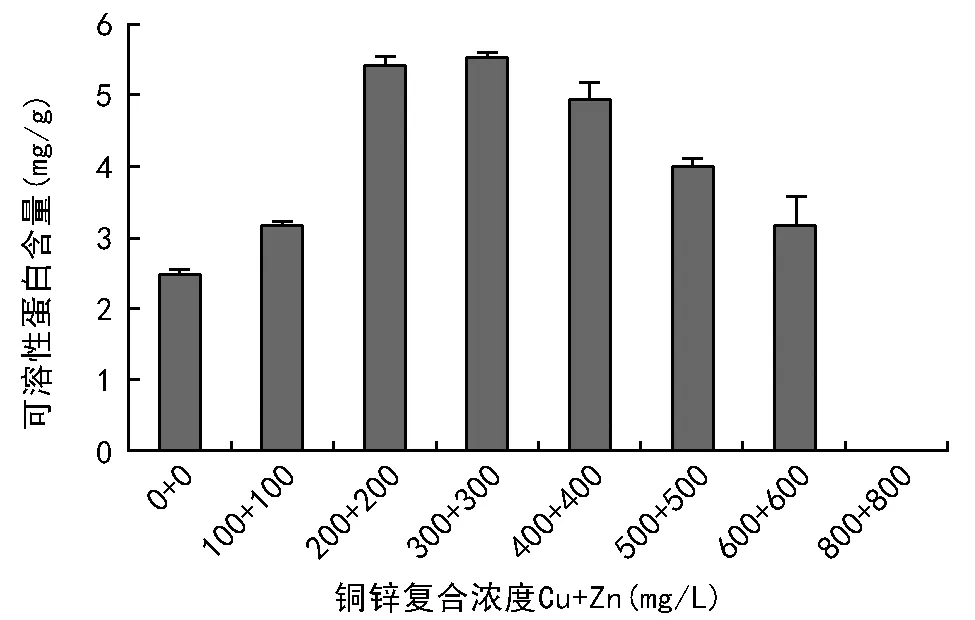
图1 铜锌复合胁迫对包菜子叶可溶性蛋白质含量的影响
3 讨 论
种子萌发是植物感知外界环境的最初生命阶段,同时也是对外界环境变化最敏感的阶段[19],种子萌发时期的生长状况直接影响到作物以后的生长和产量。本试验中,包菜种子受到铜锌复合污染时能显著抑制种子的发芽、幼苗和幼根的生长,同时显著抑制包菜子叶的光合色素合成。有研究表明,低浓度的铜、锌可促进植物的生长发育,而高浓度的铜、锌可对植物造成伤害,甚至会发生中毒[20-21]。本试验中包菜种子的发芽势、发芽率、发芽指数、包菜子叶的干重及可溶性蛋白质含量表现出低浓度促进,高浓度铜锌复合污染对包菜生长发育的影响可能是大量铜锌进入包菜体内,破坏包菜体内正常的生理代谢平衡,对包菜的光合、呼吸代谢等功能产生不良影响,从而使包菜生长不良[21]。
包菜子叶光合色素含量随铜锌复合污染的加剧呈现递减走势,究其原因可能是Cu-Zn进入包菜体内后,子叶中叶绿体的酶活性在Cu-Zn复合作用下比例失调,从而导致叶绿素分解加快;并且外源添加的Cu-Zn与叶绿体中蛋白质上的-SH基结合或取代其中的Fe2+、Mg2+,致使叶绿素中的蛋白质因中心离子组成改变而失去活性[22],从而造成叶片中光合色素含量的降低。这与赵玉红等[23]的研究结果相似。
包菜子叶的可溶性蛋白质含量随铜锌复合胁迫的增加呈现先增后减的趋势,其原因可能是由于可溶性蛋白是重要的渗透调节物质和营养物质,它的含量增加在一定程度上减弱了铜锌对包菜的毒害效应,但随着铜锌复合浓度进一步升高,过量的重金属造成了包菜体内蛋白质的分解以及运输受阻[24],从而最终导致可溶性蛋白质含量大幅度下降。这与杨红飞等[25]的研究结果相似。
4 结 论
铜锌复合胁迫总体上不利于包菜种子的萌发和幼苗生长。但低浓度Cu 100 mg/kg+Zn 100 mg/kg(A 1)可提高包菜种子的发芽势、发芽率和发芽指数,但与对照差异不显著,同时包菜种子的相对伤害率最低,低浓度Cu 200 mg/kg+Zn 200 mg/kg(A 2)可增加包菜苗干重, Cu 300 mg/kg+Zn 300 mg/kg(A 3)处理的可溶性蛋白质含量达到最大值为5.52 mg/g。可以初步推断包菜在低于300 mg/L CuSO4·5 H2O+300 mg/L ZnSO4·7 H2O的复合胁迫时表现出一定的耐性。
参考文献:
[1]沈羽.渐尖毛蕨对铜锌复合胁迫的生理响应[D].南京:南京林业大学,2014.
[2]Guo L,Cutright T J.Remediation of AMD Contaminated Soil by Two Types of Reeds[J].International journal of phytoremediation,2015,17(4):391-403.
[3]Huang Z,Tang Y,Zhang K,et al.Environmental risk assessment of manganese and its associated heavy metals in a stream impacted by manganese mining in South China[J].Human and Ecological Risk Assessment:An International Journal,2016,2(9):1-18.
[4]Liao J,Wen Z,Ru X,et al.Distribution and migration of heavy metals in soil and crops affected by acid mine drainage:Public health implications in Guangdong Province,China[J].Ecotoxicology and environmental safety,2016,12(4):460-469.
[5]Foyer C H,Lelandais M,Kunert K J.Photo oxidative stress in plant[J].Physiologia Plantarum,1994,92(4):708-719.
[6]徐勘松,施国新,周红卫,等.Cd、Zn复合污染对水车前叶绿素含量和活性氧清除系统的影响[J].生态学杂志,2003,22(1):5-8.
[7]朱志国,周守标.铜锌复合胁迫对芦竹生理生化特性、重金属富集和土壤酶活性的影响[J].水土保持学报,2014,28(1):276-280,288.
[8]华玉丹,王晓芬,李娟,等.铜锌及其复合污染对西瓜种子萌发的影响[J].环境科学与技术,2011,34(12):71-73.
[9]申宵慧,郭伟,冯鹏,等.铜-锌复合胁迫对凤仙花萌发及幼苗生长的影响[J].农业灾害研究,2014,4(5):16-17.
[10]邹文桐.铅铜复合胁迫对芥菜子叶抗性的影响[J].西北农林科技大学学报(自然科学版),2013,41(11):191-195,208.
[11]邹文桐.铅对芥菜种子萌发、幼苗生长及叶片光合色素含量的影响[J].云南农业大学学报,2012,27(4):556-561.
[12]邹文桐,项雷文,刘美华.水杨酸对铅镉复合胁迫下芥菜子叶生理代谢的影响[J].甘肃农业大学学报,2012,47(4):48-52.
[13]毕辛华,戴心维.种子学[M].北京:农业出版社,1993:77-90.
[14]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,1999.
[15]沈伟其.测定水稻叶片叶绿素含量的混合液提取法[J].植物生理学通讯,1988(3):62-64.
[16]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[17]张芬琴,金自学.两种豆科作物的种子萌发对Cd2+处理的不同响应[J].农业环境科学学报,2003,22(6):660-663.
[18]郑光华.种子活力的原理及其应用[M].植物生理生化进展(Ⅳ).北京:科学出版社,1986:154.
[19]Chen Y X,He Y F,Luo Y M,et al.Physiological mechanism of plant roots exposed to cadmium[J].Chemosphere,2003,50:789.
[20]王俊,郭颖,吴蕊,等.不同种植年限和施肥量对日光温室土壤锌累积的影响[J].农业环境科学学报,2009,28(1):92.
[21]甄泉,严密,杨红飞,等.铜污染对野艾蒿生长发育的胁迫及伤害[J].应用生态学报,2006,17(8):1 505.
[22]Panla K P,Thompson J E.Evidence for the accumulation of peroxidized lipids in membranes of senescing cotyledons[J].Plant Physiology,1984,75:1 156.
[23]赵玉红,蒙祖庆,牛歆雨,等.铜锌胁迫对珠芽蓼珠芽萌发及生理生化特性的影响[J].草地学报,2014,22(1):118.
[24]孙赛初,王焕校,李启任.水生维管束植物受镉污染后的生理生化变化及受害机制初探[J].植物生理学报,1985,11(2):117.
[25]杨红飞,王友保,李建龙.铜、锌污染对水稻土中油菜(BrassicachinensisL.)生长的影响及累积效应研究[J].生态环境学报,2011,20(10):1 475.
