循PCD引流管路径微小切口联合经皮肾镜治疗重症急性胰腺炎感染性坏死
2018-03-30刘国华戴东谭小宇
刘国华,戴东,谭小宇
(广东医科大学附属医院 肝胆外科,广东 湛江 524000)
近年来,对重症急性胰腺炎(severe acute pancreatitis,SAP)的诊治研究有了较大进展,在多个方面已基本达成共识,现今以内科治疗为主导的多学科团队协作综合治疗SAP的疗效显著,早中期因全身炎症反应综合征(systemic inflammatory response syndrome,SIRS) 及多器官功能衰竭(multiple organ failure,MOF)而死亡的患者数量已得到大幅度下降,但是SAP后期胰腺坏死组织积聚所引起的脓毒血症则使得其治疗效果举步维艰,这时应由外科医师进行手术干预。目前,外科治疗SAP的理念已从以往的早期开腹手术向延迟、微创、损伤控制及通畅引流为主要目标[1]。而如何才能做到既微创又能有效清除SAP胰腺坏死组织,这成为外科医师处置感染期SAP追求的目标。我科2010—2017年协同ICU应用微小切口联合经皮肾镜处理重症急性胰腺炎坏死组织成功救治感染期SAP 23例,临床应用经验汇报如下。
1 资料与方法
1.1 一般资料
回顾性分析2010年1月至—2017年1月经我科小切口联合经皮肾镜微创手术干预处理的23例SAP合并胰腺感染性坏死患者。病例纳入标准:符合急性胰腺炎诊治指南(2014年)[2]的诊断标准并且严重程度分级符合SAP,在我院ICU进行监测及维护机体内环境稳定、器官功能及营养支持、防治感染等规范治疗4周以上,不同程度地出现脓毒血症(如体温升高、WBC、PCT升高)CT证实胰腺和或周围伴有坏死、积液,虽行经皮穿刺置管引流术(percutaneous catheter drainage,PCD)冲洗,但5~7 d后,感染中毒症状仍无明显改善并出现PCD引流不畅等治疗效果不佳等情况的患者(图1)。病例排除标准:出现严重心肺功能不全的患者除外,CT考虑胰腺炎合并恶性肿瘤所致胆道梗阻的患者除外。符合本研究23例患者中男15例,女8例;年龄35~63岁,平均年龄42岁。

图1 感染期SAP典型的CT表现(显示胰腺坏死及渗出病灶)Figure 1 Typical CT manifestation of SAP at infection stage (showing pancreatic necrosis and exudative foci)
1.2 手术方法
所有患者均在气管插管全麻下行胰腺坏死组织清除及引流术。首先,在PCD引流管穿刺管口腹壁处作一约2 cm微小切口,逐层切开皮肤、皮下、肌肉及筋膜,注意整个过程均需循PCD引流管所形成窦道路径进入脓腔(可极大地减少误入腹腔造成胃肠副损伤的可能),找到坏死组织后先用取石钳取出部分胰腺坏死组织,深在的部分坏死组织联合德国狼牌经皮肾镜(型号:8968.405)(图2)可直视下置入网篮取出(图3A)。随后,残腔则分别经脓腔高低位的位置相应较簿腹壁戳孔(B超引导下)置入冲洗管1条及双套管1~2条,冲洗管头端置入脓腔高位,双套管头端置入脓腔低位,原PCD引流管切口予以关闭(图3B)。胰腺多发坏死病灶已行多条PCD引流的患者可行多个微小切口,并通过上述手术方法处理放置多根冲洗管及双套管。本研究依据CT所示胰腺坏死及积液的病灶所在位置决定引流管放置位置、清除胰腺坏死组织后脓腔的大小决定放置引流管数量。分析23例CT病灶常见于2个区域:胰尾至左侧肾周区域(已放置PCD1条),胰头、体至肝、胃间区域(已放置PCD1条)。病灶仅见于胰尾至左侧肾周区域者10例、另外13例病灶则涉及上述2区域,前者清除胰腺坏死组织后于脓腔高位放置1条冲洗管从左上腹腹壁戳孔引出并固定,于脓腔低位放置1~2条(脓腔较大则放置2条)双套管从左中下腹腹壁戳孔引出并固定,后者则还需在胰头、体至肝、胃间区域脓腔高位放置1条冲洗管从中上腹腹壁戳孔引出并固定,于脓腔低位放置1~2条(脓腔较大则放置2条)双套管从右中腹腹壁戳孔引出并固定。
1.3 术后管道的管理
3 000 mL生理盐水每天持续自冲洗管冲洗脓腔,双套管负压状态下持续吸引引流出脓腔内残余坏死组织,记录每天引流管出入量、监测记录患者体温变化、复查血常规、PCT、CRP等情况。当出现引流欠通畅情况下,自双套管内管注入少量生理盐水即可冲开双套管头端堵塞侧孔的坏死组织,上述方法效果欠佳时,术后超过2周后则需换管继续引流,术后1个月左右复查CT决定是否需行二次微创干预。

图2 经皮肾镜设备 A:主机;B:操作镜及配件Figure 2 Percutaneous nephroscope set A: Main machine; B: Operating scopes and accessories
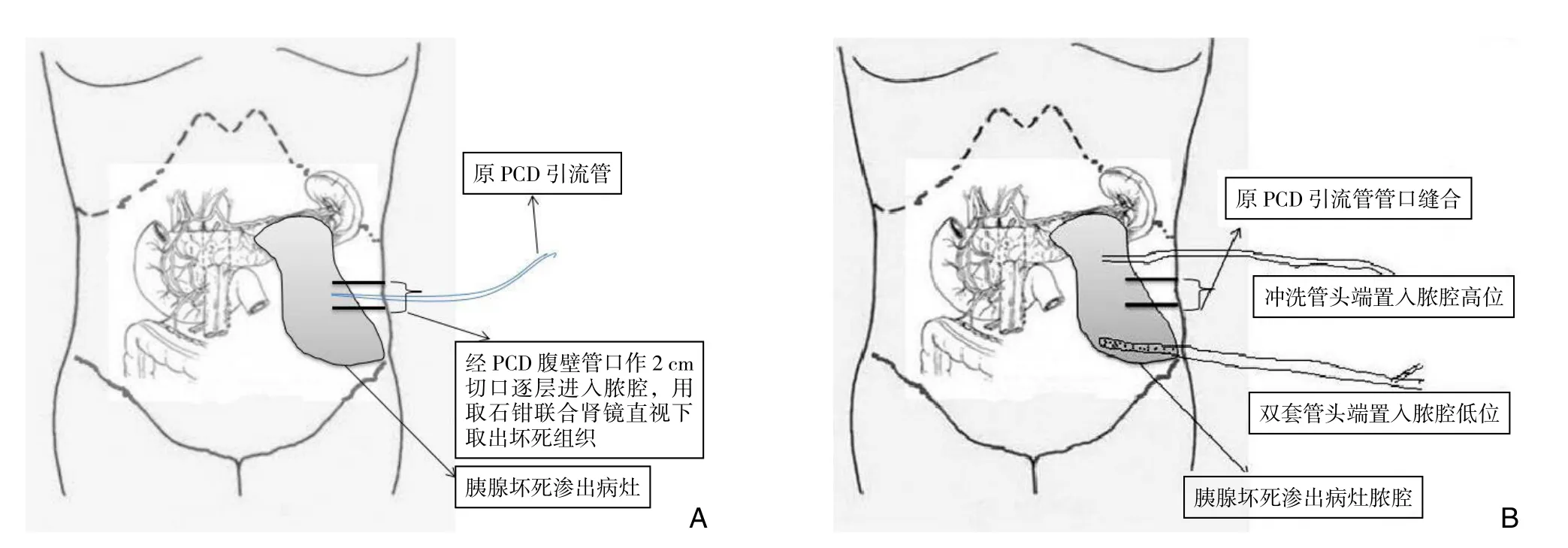
图3 手术示意图 A:循PCD引流管路径取胰腺坏死组织;B:胰腺坏死组织清除后置管Figure 3 schematic diagram of surgical approach A: Necrotic pancreatic tissue removal through the tract of the PCD tube; B: Tube placement after necrotic pancreatic tissue removal
1.4 术后患者引流管拔除指证
患者感染中毒症状消失,复查感染性指标正常,引流管引流量少于20 mL且引流液未见坏死组织,复查CT胰腺坏死组织、渗液基本消失。
1.5 统计学处理
用SPSS 19.0统计分析整理数据,数据以均数±标准差(±s)表示,用多组计量资料方差分析的统计学方法比较术前、术后引流量感染性指标的差异。检验水准α定为0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 患者引流管引流量及感染性指标的变化
所有患者经上述手术干预置管引流后,患者引流管引流情况均明显改善,术后1、3、7 d的引流量(出入量差)明显多于术前PCD引流量(均P<0.05),术后14、20 d引流量(出入量差)逐渐减少但仍多于术前(均P<0.05),术后30 d时引流量(出入量差)与术前基本相似(P>0.0 5)。术后引流管引流液中均可见被冲洗出的少量坏死胰腺组织。所有患者经上述手术干预引流后,术后1 d患者体温从术前(40.09±0.98)℃下降至(39.38±0.79)℃,术后3 d下降至(38.26±0.63)℃,7 d又下降至(37.28±0.59)℃,至术后14 d患者体温便逐渐下降至正常(36.57±0.37)℃,与术前均有统计学差异(均P<0.05)。术后1 d血常规白细胞(WBC)数与CRP与术前相仿(P>0.05),降钙素原(PCT)已明显下降(P<0.05);术后3 d的WBC数与C反应蛋白(CRP)较术前明显下降(均P<0.05),PCT则继续下降;术后第7、14、20 d的WBC数、CRP、PCT与术前、术后1、3 d相比均继续下降(均P<0.05);至术后20 d的CRP已降至正常值,术后30 d的WBC数、PCT已基本正常(表1)。
2.2 术后并发症及预后
患者术后3 d已有肛门排气,腹胀明显减轻。术后14 d腹胀基本消失,已恢复进食,患者全身情况明显改善。所有患者无肠瘘、腹腔出血发生,术后引流管引流液中每天均可见被冲洗出的少量坏死胰腺组织。5例术后2周出现双套管外管堵塞,经双套管内管注入10 mL生理盐水后恢复通畅引流,其中2例3周左右再次出现堵塞经注水无法再通,拔除原双套管置入内径稍小硅胶管继续引流。术后1个月左右复查CT均提示:胰周坏死组织基本清除干净,胰周渗出液明显减少(图4),20例患者符合拔管指证均将引流管拔除,3例患者引流管引流量多于20 mL且引流液中仍有少量浑浊可疑坏死胰腺坏死组织,继续引流1周后均达到拔管指证将引流管拔除,所有患者最终痊愈出院。3个月后随访患者,复查CT除1例患者发生胰腺假性小囊肿(病灶<2 cm)其余患者未见并发症发生。
表1 术后患者引流量及感染指标变化情况(±s)Table 1 Changes in drainage volume and infection indexes in the patients after operation (±s)

表1 术后患者引流量及感染指标变化情况(±s)Table 1 Changes in drainage volume and infection indexes in the patients after operation (±s)
注:1)与术前比较,P<0.05Note: 1) P<0.05 vs. preoperative value
时间 引流量(mL) 体温(℃) WBC(×109) PCT(ng/mL) CRP (mg/L)术前 11±5 40.09±0.98 23.50±4.97 26.78±5.21 157.25±15.44术后 1 d 243±551) 39.38±0.791) 22.57±3.64 14.57±2.091) 152.19±33.35术后 3 d 168±421) 38.26±0.631) 15.19±2.491) 10.58±1.411) 99.71±18.271)术后 7 d 102±281) 37.28±0.591) 10.82±1.621) 5.80±1.861) 19.28±4.291)术后 14 d 70±161) 36.57±0.371) 10.79±1.421) 5.95±1.831) 19.32±5.391)术后 20 d 34±101) 36.54±0.351) 10.08±1.661) 1.95±0.601) 8.90±1.601)术后 30 d 19±7 36.61±0.311) 8.24±1.781) 0.39±0.191) 8.50±2.231)

图4 术后1个月CT复查情况Figure 4 Review CT examination on one month after operation
3 讨 论
急性胰腺炎(acute pancreatitis,AP)是常见的急腹症之一。AP病变程度轻重不等,按照病理类型分类可分为水肿型急性胰腺炎和出血坏死型急性胰腺炎,按照临床过程分可分为轻型与重症急性胰腺炎(SAP)[3],其中SAP是危重急症,病情十分凶险,病死率高达36%~50%[4]。其治疗策略也历经早期积极手术治疗到提倡保守治疗再到选择性手术干预;从简单引流、早期包膜切开引流到全胰切除,再到清创、坏死组织切除等等漫长而又艰苦的探索[5]。目前,随着近年来对SAP病理生理等认识的深入及多学科综合诊治、创伤递升式分阶段治疗[6-7]等新理念的出现,其病死率已降至10%~20%。
最新的亚特兰大关于AP的诊治指南[8]指出:SAP修正分期为早期(急性期)、中期(演进期)和后期(感染期)3期。SAP有2个死亡高峰分别在早期和后期。早期主要依赖于内科(ICU)为主导的多学科协同治疗模式,此期以重症监护、稳定内环境、液体复苏、器官功能保护、防治多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)等治疗使患者顺利度过急性期为主要目标。感染性胰腺坏死(infected pancreatic necrosis,IPN)是导致SAP后期死亡的主要原因,主要包括胰腺及其周围的急性坏死性液体积聚和包裹性坏死。而外科手术干预则仍在感染期SAP占有主导地位。外科手术的具体时机与指征尚有争论,但延期手术原则已成为国际共识,无论是最新意大利重症急性胰腺炎共识指南(2015)[9]、日本急性胰腺炎处理指南(2015)[10]、还是我国急性胰腺炎诊治指南[2](2014年)均一致认为延期手术应推迟至4周后,实施外科手术干预措施的关键在于清除感染期SAP胰腺坏死组织及建立有效的引流。手术的方式可归纳为微创或开腹两种,两种方法到底孰优孰劣。国外有文献[11]指出:剖腹引流操作创伤大、易导致出血、胰瘘等各种并发症。国内研究[12]表明:在治疗重症胰腺炎时,微创手术与开腹手术相比,前者对应激反应及炎性反应的抑制优于后者,且前者术后疼痛更轻、并发症更少、病死率更低。本研究所有经微创干预治疗的患者均无出血、胰瘘发生。微创主要有腔镜手术、小切口(多为5 cm左右的腹膜后小切口、PCD等方法,还有近年来较新技术如经胃内镜下胰腺坏死组织清除术(endoscopic transgastric necrosectomy,ETN)或经胃内镜下胰腺坏死组织引流术(endoscopic transgastric drainage,ETD)、微创腹膜后胰腺坏死组织清除术(minimal access retroperitoneal pancreatic necrosectomy,MARPN)[13]。当然,不同微创方式也有其优缺点。单纯小切口清除坏死组织时多选择腹膜后入路,进入IPN病灶选择局限,易出现深在组织残留过多致手术效果不佳或因切口通道较大(切口多长约5 cm)误入腹腔损伤腹腔器官致消化道瘘等并发症的发生。随着腹腔镜技术的发展成熟,也出现经腹腔镜引流治疗SAP的相关研究[14-15]报道,与传统开腹手术相比有其优势,但由于其技术要求较高,稍有操作不当易发生消化道瘘、出血等并发症。近年来国外研究[16-17]认为:超声介导内镜下穿刺置管引流处理IPN有效且相对开腹而言较为安全。国内朱勇等[18]研究指出:ETN治疗SAP合并IPN时疗效是确切的,其并发症发生率低于外科清创手术。亦有文献[19]报道内镜下穿刺引流术与外科手术相比住院时间、住院费用、并发症的发生率都明显下降。但无论是ETN还是ETD仍有不少的诸如出血、感染、穿孔等并发症,而穿孔是其主要并发症[20]。PCD确实可以减少胰腺坏死腔内压力和细菌毒素入血,从而改善SAP患者的SIRS和败血症,2013年国外Babu等[21]实施的一项前瞻性队列研究显示,PCD可逆转62%的SAP患者的脓毒血症,并使48%的SAP患者免于手术,国内有多项研究[22-23]显示,B超或CT引导下的PCD治疗 SAP 继发胰周脓肿的疗效均取得较好的疗效,且并发症发生率低。但是单纯PCD引流由于引流管相对较小容易出现引流不畅而需多次置管、导致出血、消化道损伤等并发症增加,甚至最终难免实施开腹手术的缺点。阶梯式引流模式已成为当今治疗SAP局部感染性并发症的主流。而阶梯式引流模式讲究联合多种微创引流技术,强调分步、充分引流胰腺坏死组织、持续负压冲洗、损伤控制等原则[24]。因此,本研究结合上述国内外关于微创方式治疗IPN的经验在PCD引流欠佳时(PCD引流5~7 d无效患者)采用多种微创引流结合、优化微创治疗流程,取得了较为满意的治疗效果,所有本研究中,无1例发生出血、消化道瘘等严重并发症。分析其经验,由于循PCD引流管管口先作一约2 cm的微小切口,再沿已基本形成的PCD窦道路径(B超引导下)逐步推进,这样不仅能以最小的创伤进入至胰腺周围坏死病灶区域,同时又能最大限度地减少误入腹腔致大出血、消化道瘘等风险。进入病灶区域后,浅层坏死组织用取石钳便可清除,深层则联合硬镜,在硬镜直视下边冲洗、边结合活检钳或取石网篮就可清除绝大部分的胰腺坏死组织,残余的坏死组织术后通过留置残腔内的多根管道予以持续负压冲洗。为了达到充分引流的目的,将冲洗管置于残腔高位,引流管采用双套管设计并置于残腔低位,原PCD引流管口关闭,从而极大地保证了冲洗引流的效果。从本研究患者引流量、感染性指标术前、术后的变化可以看出,清除病灶后残腔的有效置管能极大改善术后残余积液、坏死组织的引流效果,从而能确切地降低患者感染性指标、并最终能有效治疗IPN。
综上所述,循PCD引流管路径作微小切口联合经皮肾镜治疗SAP的感染性坏死的微创治疗方案,简单、易行,有效且相对安全,有较大临床价值。当然该方案亦有其局限性,由于需待患者SAP治疗3~4周进入后期且行PCD无效5~7 d后实施才更有效,病例的选择有一定局限性(因此病例数较少),且有些病例SAP病情复杂、发展迅速、个体化差异大。因此阶梯式引流模式亦不尽相同,在选择微创还是开腹以及微创方式方面则应该做到因人而已。正如国外学者Kokosis等[25]将治疗感染性坏死性SAP的精髓总结为3D,即外科干预时间延迟(delay)、微创引流为主(drainage)、开腹手术引流(debridement),这应该还是目前较为公认的治疗基本原则。
[1]冀亮, 孙备, 程春东, 等. 创伤递升式分阶段治疗重症急性胰腺炎局部并发症的临床经验总结[J]. 中华外科杂志, 2016,54(11):839–843. doi:10.3760/cma.j.issn.0529–5815.2016.11.010.Ji L, Sun B, Cheng CD, et al. Clinical experience on the employment of the staged step-up approach in the treatment of local complications secondary to severe acute pancreatitis[J]. Chinese Journal of Surgery, 2016, 54(11):839–843. doi:10.3760/cma.j.issn.0529–5815.2016.11.010.
[2]中华医学会外科学分会胰腺外科学组. 急性胰腺炎诊治指南(2014)[J]. 中华外科杂志, 2015, 53(1):50–53. doi:10.3760/cma.j.issn.0529–5815.2015.01.012.Group of Pancreas Surgery, Chinese Society of Surgery, Chinese Medical Association. Guidelines for diagnosis and treatment of acute pancreatitis (2014)[J]. Chinese Journal of Surgery 2015,53(1):50–53. doi:10.3760/cma.j.issn.0529–5815.2015.01.012.
[3]Bradley EL 3rd. A clinically based classification system for acute pancreatitis. Summary of the International Symposium on Acute Pancreatitis, Atlanta, Ga, September11through 13, 1992[J]. Arch Surg, 1993, 128(5):586–590.
[4]Tenner S, Baillie J, DeWitt J, et al. American College of Gastroenterology guideline:management of acute pancreatitis[J].Am J Gastroenterol, 2013, 108(9):1400–1415. doi: 10.1038/ajg.2013.218.
[5]王春友, 赵玉沛. 重视重症急性胰腺炎多学科综合治疗[J].中国实用外科杂志, 2012, 32(7):517–519.Wang CY, Zhao YP. Emphasis on multidisciplinary treatment pancreatitis[J]. Chinese Journal of Practical Surgery, 2012,32(7):517–519.
[6]van Santvoort HC, Besselink MG, Bakker OJ, et a1. A step-up approach or open necrosectomy for necrotizing pancreatitis[J].N Engl J Med, 2010, 362(16):1491–1502. doi: 10.1056/NEJMoa0908821.
[7]孙备, 宋增福, 姜洪池, 等. 创伤递升式分阶段处理重症急性胰腺炎[J]. 中华外科杂志, 2013, 51(6):493–498. doi:10.3760/cma.j.issn.0529–5815.2013.06.002.Sun B, Song ZF, Jiang HC, et al. The clinical analysis of a stepup approach for severe acute pancreatitis: report of 121 cases[J].Chinese Journal of Surgery, 2013, 51(6):493–498. doi:10.3760/cma.j.issn.0529–5815.2013.06.002.
[8]Banks PA, Bollen, Dervenis C, et al. Classification of acute pancretis-2012:revision of Atlanta classification and definitions by internatinal consensus[J]. Gut, 2013, 62(1):102–111. doi: 10.1136/gutjnl-2012–302779.
[9]黄耿文, 申鼎成. 意大利重症急性胰腺炎共识指南(2015)解读[J]. 中国普通外科杂志, 2016, 25(3):313–317. doi:10.3978/j.issn.1005–6947.2016.03.001.Huang GW, Shen DC. Interpretation of consensus guidelines for severe acute pancreatitis (2015) in Italy[J]. Chinese Journal of General Surgery, 2016, 25(3):313–317. doi:10.3978/j.issn.1005–6947.2016.03.001.
[10]Yokoe M, Takada T, Mayumi T, et al. Japanese guidelines management of acute pancreatitis: Japanese Guidelines 2015[J].J Hepatobiliary Pancreat Sci, 2015, 22(6):405–432. doi: 10.1002/jhbp.259.
[11]Kiss L, Sarbu G, Bereanu A, et al. Surgical strategies in severe acute pancreatitis(SAP):indications,complications and surgical approaches[J]. Chirurgia (Bucur), 2014, 109(6):774–782.
[12]王仲, 许卫东, 滕步伟, 等. 微创手术与开腹手术治疗重症胰腺炎的围术期应激反应及术后炎性反应[J]. 实用医学杂志, 2016,32(12):1997–1998. doi:10.3969/j.issn.1006–5725.2016.12.031.Wang Z, Xu WD, Teng BW, et al. Observation on perioperative stress reactions and postoperative inflammatory reactions in patients with ;severe pancreatitis treated by minimally invasive surgery and open surgery[J]. The Journal of Practical Medicine, 2016,32(12):1997–1998. doi:10.3969/j.issn.1006–5725.2016.12.031.
[13]张太平, 杨刚, 赵玉沛. 重症急性胰腺炎诊治进展[J]. 中华肝脏外科手术学电子杂志, 2017, 6(1):1–5. doi:10.3877/cma.j.issn.2095–3232.2017.01.001.Zhang TP, Yang G, Zhao YP. Progress of diagnosis and treatment of severe acute pancreatitis[J]. Chinese Journal of Hepatic Surgery 2017, 6(1):1–5. doi:10.3877/cma.j.issn.2095–3232.2017.01.001.
[14]胡三元, 李波, 张强. 腹腔镜胰腺外科手术进展[J]. 腹腔镜外科杂志, 2001, 6(2):120–121. doi:10.3969/j.issn.1009–6612.2001.02.024.Hu SY, LI B, Zhang Q. Advance in laparoscopic pancreatic surgery[J]. Journal of Laparoscopic Surgery, 2001, 6(2):120–121.doi:10.3969/j.issn.1009–6612.2001.02.024.
[15]利民, 邓伟均, 陈占斌, 等. 腹腔镜置管灌洗引流在重症急性胰腺炎早期治疗中的应用体会[J]. 肝胆外科杂志, 2006, 14(3):175–177. doi:10.3969/j.issn.1006–4761.2006.03.006.Li M, Deng WJ, Chen ZB, et al. The experience laparoscopic peritoneal lavage and drainage in EARLY treatment for severe acute pancreatitis[J]. Journal of Hepatobiliary Surgery, 2006, 14(3):175–177. doi:10.3969/j.issn.1006–4761.2006.03.006.
[16]Tyberg A, Karia K, Gabr M, et al. Management of pancreaticfluid collections: A comprehensive review of the literature[J]. World J Gastroenterol, 2016, 22(7):2256–2270. doi: 10.3748/wjg.v22.i7.2256.
[17]Shah RJ, Shah JN, Waxman I, et al. Safety and efficacy of endoscopic ultrasound-guided drainage of pancreatic fluid collections with lumen-apposing covered self-expanding metal stents[J]. Clin Gastroenterol Hepatol, 2015, 13(4):747–752. doi:10.1016/j.cgh.2014.09.047.
[18]朱勇, 何文华, 夏亮, 等. 内镜下经胃坏死组织清创术治疗重症急性胰腺炎并包裹性坏死的疗效初探[J]. 中华消化内镜杂志,2015, (3):187–190. doi:10.3760/cma.j.issn.1007–5232.2015.03.013.Zhu Y, He WH, Xia L, et al. Laparoscopic necrotic gastric tissue removal for severe acute pancreatitis with walled-off necrosis[J].Chinese Journal of Digestive Endoscopy, 2015, (3):187–190.doi:10.3760/cma.j.issn.1007–5232.2015.03.013.
[19]Ang TL, Kwek AB, Tan SS, et al. Direct endoscopic necrosectomy:a minimally invasive endoscopic technique for the treatment of infected walled-off pancreatic necrosis and infected pseudocysts with solid debris[J]. Singapore Med J, 2013, 54(4):206–211.
[20]Varadarajulu S, Christein JD, Wilcox CM. Frequency of complications during EUS-guided drainage of pancreatic fluid collections in 148 consecutive patients[J]. J Gastroenterol Hepatol,2011, 26(10):1504–1508. doi: 10.1111/j.1440–1746.2011.06771.x.
[21]Babu RY, Gupta R, Kang M, et al. Predictors of surgery in patients with severe acute pancreatitis managed by the stepup approach[J]. Ann Surg, 2013, 257(4):737–750. doi: 10.1097/SLA.0b013e318269d25d.
[22]阿不都热依木•阿不都拉, 买买提吐尔逊•吐尔迪, 伊斯马依力•艾麦提, 等. 超声引导下经皮穿刺置管引流术治疗重症胰腺炎合并胰周脓肿[J]. 中国普通外科杂志, 2017, 26(3):390–395.doi:10.3978/j.issn.1005–6947.2017.03.019.Abudoureyimu•ABDL, Maimaitituerxun•TED, Yisimayili•AMT,et al. Ultrasound-guided percutaneus catheter drainage in treatment of severe acute pancreatitis complicated with peripancreatic abscess[J]. Chinese Journal of General Surgery 2017, 26(3):390–395. doi:10.3978/j.issn.1005–6947.2017.03.019.
[23]汪海平, 项和平. CT 引导经皮穿刺置管引流治疗重症急性胰腺炎25例临床分析[J]. 临床医学, 2016, 36(3):3–4.Wang HP, Xiang HP. Clinical study of percutaneous CT guided catheter drainage in 25 patients with severe acute pancreatitis[J].Clinical Medicine, 2016, 36(3):3–4.
[24]Aranda-Narváez JM, González-Sánchez AJ, Montiel-Casado MC, et al. Acute necrotizing pancreatitis:Surgical indications and technical procedures[J]. World J Clin Cases, 2014, 2(12):840–845. doi:10.12998/wjcc.v2.i12.840.
[25]Kokosis G, Perez A, Pappas TN. Surgical management of necrotizing pancreatitis:an overview[J]. World J Gastroenterol,2014, 20(43):16106–16112. doi: 10.3748/wjg.v20.i43.16106.
