子宫内膜息肉干细胞的提取及内皮抑素对其血管生成的影响
2018-03-30张冬丽宋璟景
田 金,张冬丽,姚 丽,宋璟景
子宫内膜息肉 (endometrial polyps, EP) 是一种可致子宫异常出血、不孕,甚至内膜恶变的常见妇科疾病。EP可发生于青春期后的女性,总体发病率高达25%。近年来,随着妇科宫腔镜检查的推广和辅助生殖技术的发展,EP的检出率正逐年上升。目前,其发病机制尚不明确。研究[1]显示,EP的发生可能与局部新生血管形成异常活跃有关。血管内皮生长因子(vascular endothelial growthfactor, VEGF)是EP发生发展过程中重要的血管生成因子,EP患者的VEGF表达水平在子宫内膜息肉中较正常内膜组织显著增高[1]。因此推测VEGF能够促进局部子宫内膜组织内新生血管的过度增殖,引起局部子宫内膜增生,最终形成子宫内膜息肉。内皮抑素是目前已知效果最好的内源性抗血管生成因子,能够特异性抑制新生血管形成。目前已经应用于临床肿瘤治疗中,能够有效地抑制血管生成和肿瘤生长[2]。其对子宫内膜异位症的治疗作用也有相关的实验研究[3]。但是,应用内皮抑素治疗子宫内膜息肉尚未见报道。因此,该研究通过观察EP组织内VEGF的表达情况,继而从EP中分离提取出干细胞并进行相关鉴定,采用体外培养法,检测不同浓度的内皮抑素对子宫内膜息肉干细胞VEGF分泌水平的影响,探讨血管内皮抑素对EP的治疗作用。
1 材料与方法
1.1资料来源选取郑州人民医院2015年1月~6月因EP行宫腔镜下内膜息肉切除术的患者,收集息肉组织,病理报告均为良性息肉样增生,增殖期子宫内膜。同时选取息肉附近内膜组织用于提取子宫内膜干细胞。所有患者(年龄32~49岁,n=9)术前至少三个月未进行激素替代治疗。对照组选取因输卵管性不孕行诊断性刮宫的患者(年龄28~41岁)(n=9)的正常子宫内膜,排除其他任何子宫病变者。本研究取得了郑州人民医院伦理委员会的批准,所有患者均签署知情同意书。
1.2方法
1.2.1标本处理 无菌获取标本后,部分组织10%中性福尔马林固定,酒精梯度脱水,二甲苯透明,浸蜡,石蜡包埋;部分组织置于DMEM/F-12 1 ∶1培养基中4 ℃保存,6 h内送至实验室处理。
1.2.2免疫组化染色SP法测定VEGF蛋白表达 VEGF兔抗人多克隆抗体及SP试剂盒购自北京中杉金桥生物技术公司,一抗工作浓度为1 ∶200。按说明书操作,光镜下观察并采集图像。结果判定:Image Pro Plus 6.0进行积分光密度测量分析,每张图片随机选择5个高倍镜视野(10×20),以阳性区平均积分光密度值(IOD) 为测定值。
1.2.3子宫内膜息肉干细胞(endometrial polyps stem cells, EPMSCs)和子宫内膜干细胞(endometrial stem cells, EMSCs)的提取 将息肉组织和息肉附近子宫内膜转移至培养皿中,无菌PBS冲洗以去掉血液和黏液,剪碎至糊状,加入III型胶原酶(300 μg/ml)和DNA酶I(40 μg/ml),37 ℃孵育1 h,每15 min震荡1次。使用70 μm孔径的细胞滤器过滤去除腺上皮细胞。收集滤液,800 r/min离心10 min,弃上清液。含有10%胎牛血清(FBS)和1%青/链霉素双抗的DMEM/F-12 1 ∶1培养基(完全培养基)重悬细胞沉淀。将上述细胞悬液转移至25 ml培养瓶中,37 ℃、5% CO2孵育,24 h后更换新鲜培养基去除未贴壁细胞。同法提取正常子宫内膜干细胞。每2~3 d更换培养基。待细胞生长至90%融合时,按1 ∶2比例传代,标记为第一代(P1),选取生长良好的P3~P5细胞用于后续实验。
1.2.4逆转录多聚酶链反应(RT-PCR) 对细胞进行干细胞相关基因OCT-4鉴定(两组n=5)。收集细胞,TRIzol法提取细胞总RNA,应用一步法RT-PCR试剂盒,反应条件如下:42 ℃、1 h,94 ℃、15 min,94 ℃、30 s,57 ℃、30s,72 ℃、30 s,35个循环;72 ℃、10 min。PCR产物通过1%琼脂糖凝胶电泳进行鉴定。紫外线下观察记录,以GAPDH为内参。见表1。

表1 RT-PCR引物序列
1.2.5细胞克隆形成实验 选取3~5代生长情况良好的EPMSCs和EMSCs,以250个细胞/cm2接种于60 mm培养皿中。每组细胞分别接种3个培养皿。37 ℃、5% CO2培养箱培养,每天观察细胞集落形成情况,每3 d换液1次。在培养的第14天,出现肉眼可见的细胞克隆时终止培养,倒置显微镜下计数细胞个数>100的克隆数。克隆形成率=克隆数/接种细胞数×100%。
1.2.6细胞生长曲线和群体倍增时间(population doubling time, PDT) 收集3~5代生长情况良好的EPMSCs和EMSCs,细胞计数板计数,以5 000个细胞/孔的密度接种于24孔板中,37 ℃、5% CO2培养箱培养24 h至细胞贴壁。从第2天起,每天收集并计数3个复孔中的细胞数目,取平均值,连续计数10 d,绘制细胞生长曲线。群体倍增时间根据公式:DT=[lg2/(lgNt-lgN0)]×t (h)计算(Nt=最终细胞数目;N0=初始细胞数目;t=培养时间)。
1.2.7流式细胞术 对细胞进行干细胞表面抗原鉴定。收集细胞,PBS洗涤2次,制成细胞浓度为2×104个/20 μl的单细胞悬液,分别加入抗体:鼠抗人CD34、CD45、CD73、CD90、HLA-ABC、HLA-DR,室温避光孵育20 min,PBS洗2次,800 r/min离心5 min,300 μl PBS重悬,流式细胞仪检测。
1.2.8多向分化鉴定 收集生长良好的细胞,分别转移到成骨和成脂肪诱导培养基中,每3 d换液,完全培养基作对照。分别于3周和2周后进行茜素红和油红O染色,倒置显微镜进行观察鉴定。
1.2.9酶联免疫吸附试验(ELISA) 检测EPMSCs(n=5)与EMSCs(n=5)VEGF的分泌情况。生长状态良好的细胞弃去培养液,PBS洗涤2次,消化离心,完全培养基重悬。 将各组细胞分别以1×105个/孔接种于6孔板中,3个复孔。37 ℃、5% CO2孵育,分别于24、48、72 h后,收集细胞上清液,2 000 r/min离心20 min。采用人VEGF ELISA检测试剂盒,按说明书操作,检测每孔细胞培养上清液中VEGF的表达水平。完全培养基做阴性对照,PBS做空白对照。
1.2.10内皮抑素对EPMSCs和EMSCs血管生成的作用 收集生长良好的EPMSCs和EMSCs(n=5),如上述方法接种于6孔板中,设置4个复孔,分别加入内皮抑素0、0.5、1、2 mg,37 ℃、5% CO2孵育48 h后收集细胞上清液,2 000 r/min离心20 min。采用ELISA法同法检测每孔细胞培养上清液中VEGF的表达水平。完全培养基做阴性对照,PBS做空白对照。
2 结果
2.1EP组织中VEGF的表达VEGF蛋白主要分布于子宫内膜腺上皮细胞、血管内皮细胞、间质细胞及平滑肌细胞的胞质中。EP组织中VEGF阳性表达广泛分布。EP组织VEGF表达(0.029 6±0.002 6)较正常增殖期内膜表达(0.023 4±0.002 0)增强(t=6.903,P<0.001)。见图1。
2.2EPMSCs及EMSCs的分离、培养和鉴定为获取子宫内膜息肉来源的子宫内膜干细胞,分离提取了9名来自子宫内膜息肉患者的EPMSCs,其中7例获得成功。同样,成功培养了8例EMSCs。EPMSCs及EMSCs均表现出贴壁生长的特点,光镜下细胞呈梭型,旋涡状排列,生长迅速,见图2。两种细胞均表达干细胞相关基因OCT-4,见图2。流式细胞术结果表明:超过90%的EPMSCs和EMSCs表达MSC特有的标志物CD73和CD90。相反,不表达已知的造血干细胞标志物CD34和CD45。MHC I类分子HLA-ABC阳性表达,MHC II类分子HLA-DR阴性表达,见图3、4。

图1 子宫内膜息肉和正常子宫内膜中VEGF的表达 SP×200
A:VEGF在子宫内膜息肉中的表达;B:VEGF在正常子宫内膜中的表达
2.3EPMSCs及EMSCs的增殖能力在细胞克隆形成实验中,EPMSCs及EMSCs在培养的第24 h基本全部贴壁。细胞大多呈梭形,外形轮廓尚清晰。单个细胞生长较为缓慢,培养第6天左右较大克隆增长迅速,较小克隆生长缓慢。在14 d中止培养,可见有含数百个细胞组成的克隆存在。EPMSCs的克隆形成率与EMSCs的克隆形成率比较,差异有统计学意义(t=3.199,P=0.033),见图5A。两组细胞生长曲线大致呈现“S”型,接种后2 d内,细胞增长相对缓慢,从3 d起进入对数生长期,7 d起进入平台期,细胞数目不再增加,见图5B。由此计算出EPMSCs和EMSCs的PDT,二者之间差异有统计学意义(t=-6.594,P=0.003),见图5C。
2.4EPMSCs和EMSCs体外分化能力的鉴定为了进一步鉴定EPMSCs和EMSCs在体外是否能够多向分化,本实验研究了其分化成成骨细胞和脂肪样细胞的潜能。在成骨诱导培养基中培养3周后,EPMSCs沿着细胞膜形成了红色茜素基质,同时出现大红色的骨质颗粒嵌入到细胞外基质,标志着成骨细胞化。在成脂肪诱导培养基中培养3周后,油红O染色证明EPMSCs分化时在胞质内有脂滴形成。见图6。

图2 子宫内膜息肉及正常子宫内膜干细胞形态学和OCT-4鉴定

图3 子宫内膜息肉干细胞表面标志物检测A:CD-73;B:CD-90;C:HLA-ABC;D:CD-34;E:CD-45;F:HLA-DR

图4 子宫内膜干细胞表面标志物检测结果A:CD-73;B:CD-90;C:HLA-ABC;D:CD-34;E:CD-45;F:HLA-DR

图5 EPMSCs和EMSCs增殖能力
2.5EPMSCs与EMSCs细胞培养上清液中VEGF的水平为了在细胞水平进一步证实EPMSCs与EMSCs在血管生成能力方面是否具有差异,本实验应用ELISA法检测了细胞培养上清液中VEGF的表达水平。48 h和72 h两组细胞VEGF的表达量差异均有统计学意义(t=14.989,P<0.001;t=14.795,P<0.001)。24 hVEGF表达量差异无统计学意义(t=1.767,P=0.152)。见图7。
2.6内皮抑素对EPMSCs和EMSCs血管生成的抑制作用为了探究内皮抑素对EP是否具有潜在治疗作用,及其是否会对正常细胞产生不良影响,分别检测了其对EPMSCs和EMSCs细胞培养上清液中VEGF的表达水平的影响。在依次加入0、0.5、1、2 mg的内皮抑素培养48 h后,EPMSCs细胞上清液中VEGF的含量。与非处理组相比,1、2 mg组均表现出对VEGF表达的抑制作用(F=68.423,P<0.001)。而0.5 mg组与非处理组之间的差异无统计学意义(F=68.423,P=0.095),见图8A。而在依次加入0、0.5、1、2 mg内皮抑素培养48 h后,与非处理组相比,加入2 mg内皮抑素后,EMSCs培养上清液中的VEGF分泌量明显降低(F=8.384,P=0.011)。而0.5、1.0 mg组与非处理组之间的差异无统计学意义(F=8.384,P>0.05),见图8B。
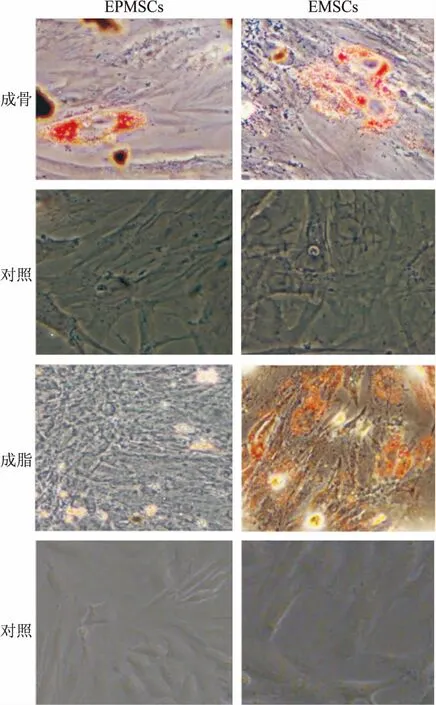
图6 子宫内膜息肉和子宫内膜干细胞体外分化茜素红/油红O×200
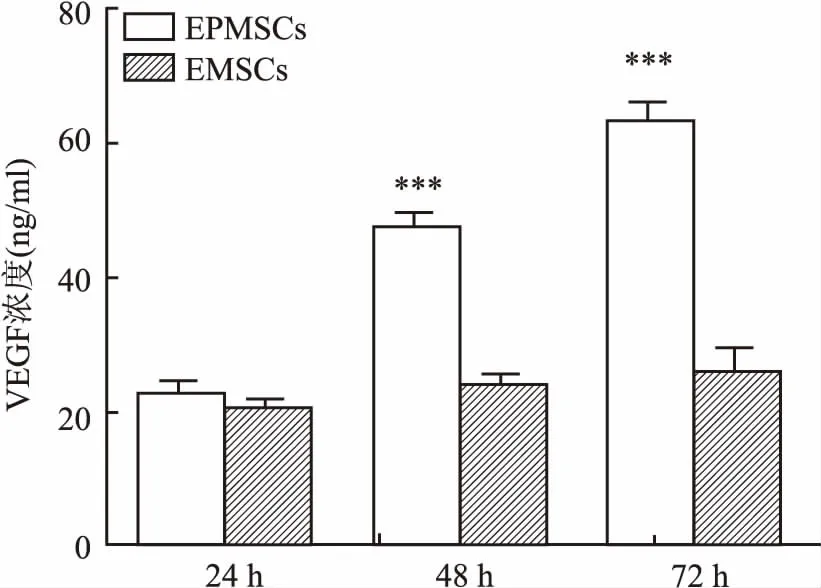
图7 子宫内膜息肉和子宫内膜干细胞细胞培养上清液中VEGF的表达与EMSCs比较:***P<0.001
3 讨论
3.1子宫内膜息肉组织中VEGF表达增高EP可以发生于任何年龄且发病率有增高趋势,其发病机制不清,缺乏针对性治疗方案,复发率较高。研究[4]显示,EP与局部内膜增生和凋亡的失衡、激素失衡和药物应用有关。临床病理诊断EP的唯一标准是出现伴有厚壁血管的纤维组织,因此新生血管的形成可能与EP发生的关系密切。

图8 内皮抑素对EPMSCs和EMSCs VEGF分泌的作用
A:内皮抑素对EPMSCs VEGF分泌的作用;B:内皮抑素对EMSCs VEGF分泌的作用;与0 ng/ml比较:*P<0.05,**P<0.01,***P<0.001
VEGF是一种最有效的促血管生长因子,具有促进内皮细胞增殖和迁移的作用,能增加血管的通透性,使血液中大分子物质进入到细胞外基质中,有利于新生血管的形成。它不但与正常月经周期中子宫内膜的血管生成有关,而且也能够参与以过度血管生成为特点的疾病的发生发展[5-6]。本实验中EP组织VEGF表达较正常内膜明显增强,提示VEGF可能在EP形成过程中发挥作用。在EP发生发展过程中,高表达的VEGF能够诱发内皮细胞增殖和迁移,促进大量新生血管的形成。因此,可以推测子宫内膜中VEGF的过表达引起组织内新生血管的过度增生,最终造成了局部内膜增生形成息肉。
3.2子宫内膜息肉干细胞中VEGF表达增高据报道,子宫内膜息肉中VEGF表达显著高于正常内膜,且仅发生于增殖期,表明其发生不只是条件致病,其自身子宫内膜的生物学行为与正常子宫内膜有着本质的不同[7]。因此猜测这种差异可能存在于细胞水平。最新研究[8-10]显示,人体多种组织中能够提取出原代成纤维样细胞群,如:间充质干细胞(mesenchymal stem cells, MSCs)。为了证实这一结论,本研究团队分离提取了EPMSCs和EMSCs,并对其进行了生物学特性的鉴定。实验所分离提取的细胞能够表达干细胞相关性基因OCT-4,这种特点与其他研究中报道的骨髓间充质干细胞和羊水间充质干细胞等MSCs相似[11]。本课题组进一步鉴定了EPMSCs和EMSCs的表面标志物,结果表明其高表达MSCs表面标志物,不表达造血干细胞表面标志物,MHC I类分子HLA-ABC低表达,不表达MHI II类分子HLA-DR,这说明本研究所提取的EPMSCs和EMSCs具备MSCs的表面抗原特性,且具有低免疫源性,可能成为一种新的MSCs组织来源,使其在细胞治疗领域具备发展潜力。同时,体外多向诱导分化实验也证实了EPMSCs和EMSCs具有了MSCs最重要的特征。EPMSCs和EMSCs在形态学、干细胞相关基因OCT-4表达、细胞表面抗原和体外诱导分化能力方面未见明显差异。但EPMSCs与EMSCs相比,具有更强的增殖能力。EP组织中能够分离提取出具备MSCs特性的EPMSCs,其多方面特点与已知的MSCs相似[10]。
EP与正常内膜中VEGF的表达在组织水平具有显著差异,那么其在细胞水平是否具有差异呢?鉴于EP的发病的血管新生机制,局部内膜微环境中VEGF的分泌可能与这一机制密切相关。本研究检测了EPMSCs与EMSCs细胞培养上清液中VEGF的水平,结果显示,细胞接种后24 h内,两组细胞VEGF的表达无明显差异。但从24 h后开始至72 h,EPMSCs所分泌的VEGF显著且持续增多,表达量高于EMSCs。这说明EP细胞具有更强的血管生成能力,这不仅证实了笔者之前关于子宫内膜息肉和正常子宫内膜之间差异的猜测,而且为子宫内膜息肉的治疗提供了新的想法。
3.3内皮抑素能够抑制子宫内膜干细胞血管生成作用为了证实这一想法,笔者应用内皮抑素作用于EPMSCs,以验证其对EP可能产生的治疗作用。内皮抑素是已知的实验效果最好的血管生成抑制剂,值得一提的是,其能够特异性抑制新生血管的形成,而对成熟血管几乎没有作用。本实验表明结果,在经过不同浓度的内皮抑素处理后,EPMSCs的VEGF表达水平确实有不同程度的降低,这说明内皮抑素能够抑制EPMSCs VEGF的表达,进而抑制EP的血管生成和病灶生长。但是,作为一种不断再生的组织,正常子宫内膜也可能会受到内皮抑素的影响。因此,本研究应用同样时间剂量的内皮抑素作用于EMSCs,结果表明其分泌的VEGF同样能够被内皮抑素所抑制。由于EMSCs 48 h所分泌的VEGF显著少于EPMSCs,其受内皮抑素的抑制效果不如EPMSCs明显,但这并不能表明正常子宫内膜的再生不会受到内皮抑素的不良影响。因此,应用内皮抑素治疗EP的有效和安全时间剂量或给药方式仍需要进一步探索。
综上所述,EP中VEGF的表达在组织水平和细胞水平均高于正常内膜。此外,内皮抑素能够在细胞水平对EP产生抑制作用,这填补了关于内皮抑素用于治疗EP的基础研究的空白。另外,EP组织中能够提取出MSCs,有可能成为一种可选的成体干细胞组织来源。
[1] Xuebing P, TinChiu L, Enlan X, et al. Is endometrial polyp formation associated with increased expression of vascular endothelial growth factor and transforming growth factor-beta1?[J]. Eur J Obstet Gynecol Reprod Biol, 2011, 159(1): 198-203.
[2] Mohajeri A, Sanaei S, Kiafar F, et al. The challenges of recombinant endostatin in clinical application: focus on the different expression systems and molecular bioengineering[J]. Adv Pharm Bull, 2017, 7(1): 21-34.
[3] Ma Y, He Y L. Study of an antiangiogenesis gene therapy with endostatin on endometriosis in the nude mouse model[J]. Clin Exp Obstet Gynecol, 2014, 41(3): 328-34.
[4] Indraccolo U, Di Iorio R, Matteo M, et al. The pathogenesis of endometrial polyps: a systematic semi-quantitative review[J]. Eur J Gynaecol Oncol, 2013, 34(1): 5-22.
[5] Song S H, Jeong I G, You D, et al. VEGF/VEGFR2 and PDGF-B/PDGFR-beta expression in non-metastatic renal cell carcinoma: a retrospective study in 1,091 consecutive patients[J]. Int J Clin Exp Pathol, 2014, 7(11): 7681-9.
[6] Makabe T, Koga K, Miyashita M, et al. Drospirenone reduces inflammatory cytokines, vascular endothelial growth factor (VEGF) and nerve growth factor (NGF) expression in human endometriotic stromal cells[J]. J Reprod Immunol, 2017, 119: 44-8.
[7] 邱华娟, 梁朵献, 孙 颖, 等. 子宫内膜息肉中雌激素受体、血管内皮生长因子和转化生长因子-β1的表达及相关性研究[J]. 中国妇幼保健, 2017, 32(5): 928-30.
[8] Gargett C E, Schwab K E, Deane J A. Endometrial stem/progenitor cells: the first 10 years[J]. Hum Reprod Update, 2016, 22(2): 137-63.
[9] Wang P, Liu X, Zhao L, et al. Bone tissue engineering via human induced pluripotent, umbilical cord and bone marrow mesenchymal stem cells in rat cranium[J]. Acta Biomater, 2015, 18: 236-48.
[10] Najar M, Raicevic G, André T, et al. Mesenchymal stromal cells from the foreskin: Tissue isolation, cell characterization and immunobiological properties[J]. Cytotherapy, 2016, 18(3):320-35.
[11] Piccinato C A, Sertie A L, Torres N, et al. High OCT4 and low p16(INK4A) expressions determineinvitrolifespan of mesenchymal stem cells[J]. Stem Cells Int, 2015, 2015: 369828.
