培养时间长短对卵裂期胚胎解冻后妊娠结局的影响
2018-03-29余秋锋
余秋锋
随着人类辅助生殖技术的发展,玻璃化冻融胚胎移植在提高患者累积妊娠率的同时还能预防重度卵巢过度刺激综合征(OHSS)的发生,有效提升生殖助孕质量[1,2],然而冻融胚胎的移植结局与女方年龄、子宫内膜容受性、解冻复苏后胚胎质量等息息相关[3,4]。根据冻融胚胎体外培养时间的长短不同,可观察提前半天解冻后移植与当天解冻当天移植的优劣,同时观察提前半天解冻胚胎生长发育情况是否能有效预测妊娠结局。本研究回顾性分析我中心2015年1月~2017年7月562个卵裂期胚胎冻融移植周期,探讨培养时间长短对胚胎复苏后妊娠结局的影响。
1 材料与方法
1.1 一般资料 回顾性分析我中心2015年1月~2017年7月562个卵裂期FET周期,女方平均年龄(33.86±5.19)岁,平均子宫内膜厚度(9.68±1.95) mm,平均移植胚胎(2.13±0.33)枚。均符合以下标准:均为第一个冻融移植周期且移植胚胎数≥2;不孕因素包括女方盆腔输卵管排卵障碍等,男方少、弱、畸精、无精症等;排除新鲜胚胎和冻融胚胎一起移植或卵裂胚和囊胚分步移植的患者及女方子宫内膜异位症、宫腔积液、粘连等影响着床的因素。
1.2 研究方法
1.2.1 胚胎冷冻解冻 ①冷冻标准:参照以前本中心裂期评分标准[5]并结合目前实际作修改:其中7~9细胞,Ⅰ、Ⅱ级胚胎为优质胚胎,4细胞以上,Ⅰ、Ⅱ、Ⅲ级胚胎为可用胚胎,结合患者意愿选择性将D3天4~6细胞Ⅰ、Ⅱ级胚胎及6细胞以上Ⅰ、Ⅱ、Ⅲ级胚胎用于冷冻或部分冷冻后养囊胚。②冷冻过程:使用冷冻液(Vitrolife,瑞典),按使用说明书结合本中心实际冷冻卵裂胚,卵裂胚冷冻在37℃于1号液中放置5~10min,转移至2号液放置2min后转移至3号液并于30s内装入载杆并投入液氮中。③解冻过程:使用解冻液(Vitrolife,瑞典),按使用说明书结合本中心实际解冻卵裂胚或囊胚。卵裂胚解冻在37℃条件下迅速放入1号液,30s内迅速转移至2号液1min,然后转移至3号液2min,再转入4号液5min,最后转移至预先平衡好的囊胚培养皿于倒置显微镜下观察复苏后胚胎的存活情况,有一半以上卵裂球存活者视为复苏存活并可用于移植。
1.2.2 分组 按体外培养时间不同分为提前解冻组(A组,n=478)和当日解冻组(B组,n=84)。提前解冻组为移植前一天下午解冻,培养18~20h后移植;当日解冻组为当日解冻后培养2~4h后移植。根据解冻后卵裂球增殖与否将A组分为3组:A1组(n=321)均增殖,A2组(n=131)部分增殖,A3组(n=26)不增殖;再根据卵裂球增殖数目将有增殖胚胎周期分为Aa组(n=184)至少有一个融合胚胎,Ab组(n=268)无融合胚胎。
1.2.3 内膜准备方案及移植 包括自然周期、人工周期和促排周期。自然周期适用于月经规律、有排卵的患者,于月经周期的第8~10天来生殖中心行B超监测,主导卵泡直径14mm时开始每日或隔日行B超检查并监测LH峰,排卵后2~4d或LH峰出现后4~5d进行卵裂期胚胎移植;月经不规律或自然周期内膜生长不理想者采用人工周期准备内膜,即于月经第2~5 天补佳乐 2~6mg/d,第 6~9 天 4~8mg/d,第10~13天6~10mg/d,B超监测子宫内膜生长情况并据此适当调整补佳乐剂量。也可在前一周期黄体中期给予GnRH-a,补佳乐也可采用恒量方案。当内膜≥7mm时,肌注黄体酮40~60mg/d或阴道用黄体酮转化内膜,于使用黄体酮第4~5天进行卵裂期胚胎移植;促排周期适用于月经不规律或者前两种方案无效者,应用FSH/HMG,主导卵泡直径达14~15mm时开始每日或隔日行B超检查并监测LH峰,排卵后2~4d或LH峰(卵泡发育到18mm时,未测出LH峰,注射HCG 5 000~10 000IU)出现后4~5d进行卵裂期胚胎移植。
1.3 妊娠结局 移植后第14天回生殖中心抽血检查HCG,验血阳性者14d后再回中心行B超检查确定是否临床妊娠,并计算临床妊娠率、胚胎种植率及多胎率。
1.4 统计学方法 采用SPSS 19.0统计学软件进行分析,计量资料比较采用t检验,率的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料 共有562个移植周期,共解冻胚胎1 249枚,胚胎存活率95.32﹪。各组间患者内膜准备方案无统计学差异(P>0.05),见表1;患者平均年龄、平均子宫内膜厚度、平均移植胚胎数均无统计学差异(P>0.05),见表2~4。
2.2 解冻后不同培养时间对妊娠结局的影响 过夜培养后,A组478个周期,临床妊娠率47.28﹪,种植率28.29﹪,多胎率26.99﹪;B组84个周期,临床妊娠率51.19﹪,种植率30.68﹪,多胎率25.58﹪。两组临床妊娠率、种植率和多胎率无统计学差异(P>0.05),见表2。
2.3 胚胎过夜培养后增殖与否对妊娠结局的影响过夜培养后,A1组321个周期全部有增殖,临床妊娠率 50.47﹪,种植率 30.92﹪,多胎率 28.40﹪;A2组131个周期部分增殖,临床妊娠率38.93﹪,种植率 20.90﹪,多胎率 17.65﹪;A3组 26个周期均不增殖,临床妊娠率50.0﹪,种植率34.55﹪,多胎率46.15﹪。A1组临床妊娠率、种植率均高于A2组,有统计学差异(P<0.05),A1、A2组多胎率无明显差异(P>0.05);A3组种植率、多胎率高于A2组,有统计学差异(P<0.05);A1组与A3组各指标无统计学差异(P>0.05),见表3。
2.4 过夜培养后是否存在融合胚胎对妊娠结局的影响 Aa组184个周期均有1个以上融合胚胎形成,Ab组则无融合胚胎形成。Aa组临床妊娠率(59.78﹪)、种植率(37.95﹪)极显著高于Ab组临床妊娠率(38.43﹪)、种植率(21.12﹪),P=0.00,同时Aa组多胎率亦高于 Ab组(P<0.05),见表4。
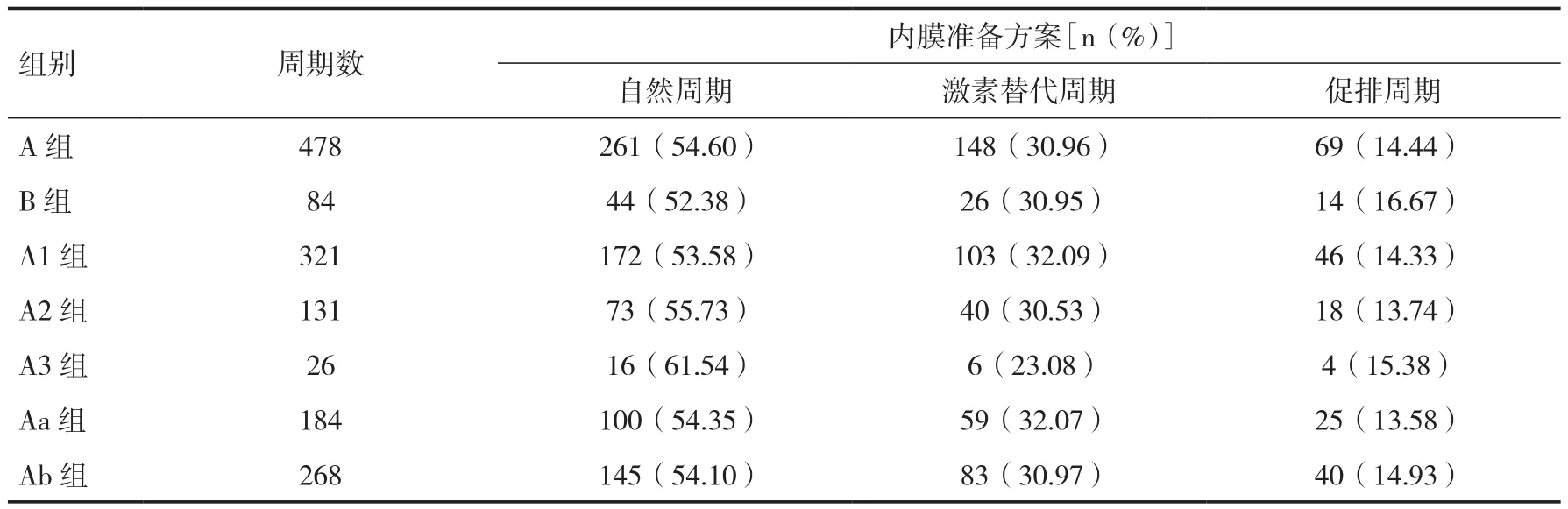
表1 患者内膜准备方案

表2 不同解冻时间妊娠结局比较
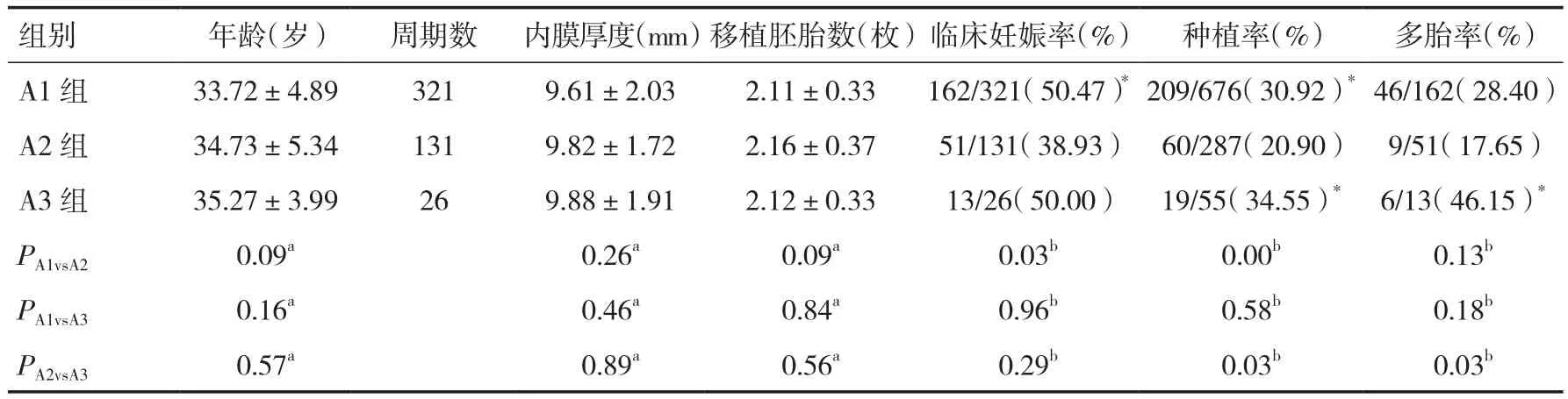
表3 过夜培养胚胎增殖与否对妊娠结局的影响比较
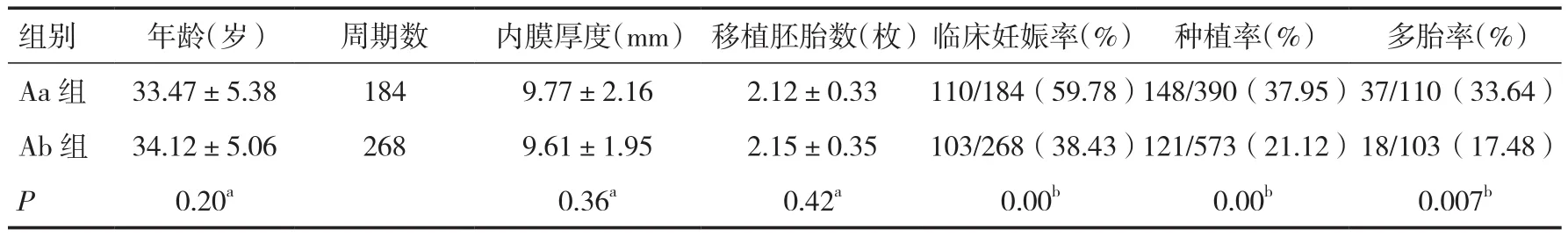
表4 有无融合胚胎对妊娠结局的影响
3 讨论
随着胚胎冷冻保存技术尤其是玻璃化冷冻技术的日益完善,解冻胚胎移植周期的临床妊娠率逐渐提高,甚至超过新鲜周期移植的临床妊娠率[6,7],加上部分促排卵方案的应用,如黄体期促排等及高龄患者累积胚胎的需要使得冷冻胚胎复苏后移植在各中心所占比例有增高趋势。
本研究比较了移植前一天下午解冻及移植当天解冻胚胎的妊娠结局,结果两者临床妊娠率(47.28﹪ vs 51.19﹪),胚胎种植率(28.29﹪ vs 30.68﹪),多胎率(26.99﹪ vs 25.58﹪)均无明显差异(P>0.05)。这与相关研究[8~10]结果基本一致;而柴三明等[11]通过研究发现当天培养组临床妊娠率和种植率均低于过夜培养组;Rato等[12]则得出相反结论;本研究中虽然当天解冻组临床妊娠率和种植率略有增高,但并无统计学差异。分析主要原因可能为当天解冻胚胎大部分为7~9细胞,Ⅰ~Ⅱ级优质胚胎,而提前解冻胚胎则优胚和可用胚胎参差不齐,或者入选标准、冷冻方法及对移植时期选择不同所致。
对于解冻后过夜培养妊娠结局,本研究显示解冻后全部胚胎有增殖组其临床妊娠率及种植率均明显高于部分增殖组,而不增殖组临床妊娠率、种植率及多胎率亦明显高于部分增殖组且与全部增殖组各指标无明显差异,这与相关研究[9,13]不尽一致。全部胚胎增殖组能进一步预测胚胎发育潜能及妊娠结局方面一致,主要不同体现在无增殖组,Laverge等[14]通过对复苏后无生长的胚胎进行荧光原位杂交发现这类胚胎仅有20﹪左右表现为正常的二倍体,其余表现为染色体异常,据此认为复苏后未进一步生长的胚胎基本无利用价值,而本研究中复苏后未增殖的胚胎在临床妊娠率及种植率方面与此理论完全不符,其甚至高于部分增殖组,分析可能原因为入组数据太少造成误差,或者胚胎生长情况被观察员忽略而误判为未生长,当然本研究若进一步追踪这部分患者的持续妊娠情况及活产分娩情况或许更能说明具体情况。但也从一个侧面提示对过夜不增殖胚胎是否移植应该持慎重态度,至少可以考虑进一步培养囊胚以避免不必要的损失。
对于过夜后增殖中含有融合胚胎与否的妊娠结局研究提示含有融合胚胎组妊娠率、种植率及多胎率均显著高于无融合胚胎组,与惠董娜等[15]的研究结果基本一致。可能这类胚胎已经打破了发育阻滞障碍,促进了基因调控由母型调节向胚胎型调节的转化,对囊胚腔的形成、内细胞团及胚层分化发挥着积极作用,预示着更好的临床结局[16,17]。但多胎率的增高是临床工作者需高度重视的问题,对这部分患者或者应该建议其行单胚胎移植。
综上所述,胚胎解冻时间对妊娠结局影响不明显,各中心可根据实际情况安排工作。解冻后过夜培养观察胚胎进一步发育情况,有全部增殖尤其含融合胚胎的周期预示着更好的妊娠结局,但同时应警惕过高的多胎率,必要时可根据实际情况行单胚胎移植。同时对于均无增殖的周期也应持谨慎态度,可行直接移植或者继续培养以避免不必要的损失。当然,这一结论需要更多数据及更进一步的实验设计支持。
1 Balaban B,Urman B,Ata B,et al.A randomized conteolled study of human Day 3 embryo cryopreservation by slow freezing or vitrificationvitrification is associated with higher survival,metabolism and blastocyst formation[J].Hum Reprod,2008,23:1976-1982
2 Anderson AR,Wilkinson SS,Price S,et al.Reduction of high order multiples in frozen embryo transfers[J/OL].Reprod Biomed Online,2005,10(3):402-405
3 Zdravka V,Mauri O,Sinikka NH,et al.Factors affecting the outcome of frozen-thawed embryo transfer[J].Hum Reprod,2013,28(9):2425-2431
4 李荣,丘映,谭秀群,等.玻璃化冻融胚胎移植结局的相关因素分析 [J].中国计划生育和妇产科,2015,7(10):31-34
5 龚绍琼.移植复苏后进一步卵裂胚胎可提高冻融胚胎移植临床妊娠率 [J].现代医院,2012,12(7):11-12
6 Aflatoonian A,Oskouian H,Ahmadi S,et al.Can fresh embryo transfers be replaced by cryoproserved-thawed embryo transfers in assisted reproductive cycles.A randomized controlled trial[J].J Assist Reprod Genet,2010,279(7):357-363
7 Shapiro BS,Daneshmand ST,Garner FC,et al.Evidence of impaired endometrial receptivity after ovarian stimulation for in vitro fertilization:a prospective randomized trial comparing fresh and frozen-thawe embryo transfer in normal respondem[J]. Fertil Steril,2011,96(2):344-348
8 刘晓音,薛松国,金炜,等.人卵裂期胚胎玻璃化冻融体外培养时间对妊娠结局的影响[J].生殖医学杂志,2010,19(2):104-107
9 罗金,杨菁,徐望明.胚胎冻融后体外培养时间对妊娠结局的影响[J].生殖与避孕,2011,31(2):97-101
10 骆荣,胡慧,洪焱,等.玻璃化冻融胚胎提前解冻与当日解冻移植结局比较 [J].生殖医学杂志,2015,24(1):17-20
11 柴三明,王焱,倪亚莉.过夜培养对冻融胚胎移植周期妊娠结局的影响 [J].生殖与避孕,2010,30(7):490-493
12 Rato ML.GOUVEIA-Ohuman frozen embryos[J].Journal of Assisted Reproduction and Genctics,2012,29(8):789-795
13 赵杰,陈秀娟,刘芳,等.冷冻胚胎解冻后质量对临床妊娠结局的影响 [J].生殖医学杂志,2014,23(12):981-985
14 Laverge H,VanderElst J,DeSutter P,et al.Fluorescent insitu hybridization on human embryo showing cleavage arrest after freezing and thawing[J].Hum Reprod,1998,13:425-429
15 惠董娜,任文娟,雷鑫,等.卵裂期冻融复苏胚胎进一步发育情况对临床结局的影响 [J].生殖医学杂志,2017,26(1):19-23
16 Blake DA,Farquhar CM.Cleavage stage versus blastocyst stage embro transfer in assisted conception[J/DB].Cochrane Database Syst Rev,2007,17:CD002118
17 Iwata K,Yumoto K,Sugishima M,et al.Analysis of compaction initiation in human embryos by using time-lapse cinematography[J].J Assist Reprod Genet,2014,31:421-426
