小麦花后干旱胁迫下乙烯合成抑制剂对胚乳PCD的调控
2018-03-28王冰冰张润琪李春艳
李 超,李 诚,王冰冰,张润琪,李春艳
(石河子大学农学院/新疆兵团绿洲生态农业国家重点实验室培育基地,新疆石河子 832000)
小麦籽粒胚乳细胞的充实及发育状况与胚乳细胞的程序性死亡(PCD)进程密切相关,并受细胞内源激素乙烯的影响[1]。小麦花后干旱打破了乙烯与其他内源激素的平衡,加快了胚乳细胞程序性死亡进程,导致籽粒灌浆时间缩短,灌浆不充分,籽粒干瘪,产量下降[2-3]。探明干旱胁迫下小麦胚乳PCD变化特征,可为通过栽培措施延缓干旱胁迫下胚乳PCD进程提供理论基础。
小麦胚乳细胞是蛋白质和淀粉合成与积累的主要场所[4]。胚乳细胞的分裂、分化与充实状况,对粒重乃至品质起到至关重要的作用[5-6]。在小麦籽粒灌浆过程中,随着代谢物的积累贮藏,淀粉胚乳细胞启动程序性死亡,最终导致在成熟的籽粒中只有胚和糊粉层细胞保持活力[7-9]。植物激素之间的相互作用与外界环境信号及细胞自身发育程序共同构成了一个精确而复杂的调控网络[10-11]。对激素调控途径及其分子机制的全面认识,有助于更好地了解激素在植物生长发育中的作用[12]。植物内源激素乙烯(ETH)对禾谷类作物胚乳PCD及灌浆过程具有明显的调控作用[2]。Young等[1,13]研究发现,ETH参与调控小麦和玉米胚乳PCD的进程,外源ETH可诱导小麦和玉米胚乳PCD提前出现,抑制ETH合成物质——氨基氧乙烯会使胚乳细胞DNA片段化明显推迟。Rantong等[14]研究发现,水蕹叶中高含量的乙烯和低表达量的乙烯受体是导致叶子发生程序性死亡和叶穿孔的关键因素。Gallie等[15]推测,高表达量的乙烯受体可限制胚乳细胞的死亡速率,使胚乳细胞有足够的时间来保证贮藏物质的合成。近年来,关于乙烯调控PCD进程的研究取得了一定进展,但是花后干旱胁迫下乙烯对小麦胚乳PCD的调控机理尚不明确。本研究抑通过人工干预措施调节小麦籽粒灌浆中乙烯的合成,以明确乙烯对小麦胚乳PCD的调控作用。
1 材料与方法
1.1 试验材料及设计
选用新疆主栽冬小麦品种新冬18号为试验材料,种子由石河子大学冬小麦课题组提供。新冬18号为冬性中熟品种,生育期273 d左右。试验于2015-2016在石河子大学农学院试验站(44°17′N,86°03′E,海拔461 m)进行。采用随机区组设计,小区面积为7 m2。所有试验小区从播种至开花前采用相同于大田滴灌种植的管理方式,开花后干旱处理采用遇阴雨天搭遮雨棚,开花至成熟期停止田间灌水。抑制乙烯合成处理在花后干旱胁迫开始的第9天进行,在小麦穗部喷施含5×10-5mol·L-1硝酸钴(乙烯合成抑制剂)、0.1%(v/v)乙醇和0.1%(v/v)Tween20的蒸馏水溶液,用量800 mL·m-2;对照喷施等量含0.1%(v/v)乙醇和0.1%(v/v)Tween20的蒸馏水溶液。每天下午六点喷施,连续喷施7 d,3个重复。开花当天选取同天开花、长势一致的麦穗挂牌标记。分别于小麦开花后5、10、15、20、25、30和35 d取穗中上部籽粒,一部分籽粒用固定液固定备用;一部分立即置于液氮中速冻5 min,再置于-80 ℃冰箱中保存备用;另一部分于105 ℃杀青30 min,80 ℃烘干至恒重备用。
1.2 胚乳细胞活力检测
参考Young等[1]方法将不同发育时期的新鲜小麦籽粒用刀片横切,置于 0.1%的 Evan’s Blue 水溶液中浸染 2 min,双蒸水浸洗 1 h,转至粘附载玻片上,体视显微镜(Zeiss Discovery V20,Germany)观察并拍照。
1.3 胚乳细胞细胞核形态观察
参考安丽华和尤瑞麟[16]的方法对所取样品进行包埋和切片。取不同时期的小麦籽粒用2.0%戊二醛固定液固定,乙醇逐级脱水,将纯Steedman’s wax和 1-hexadecanol (十六醇)按重量比9∶1 混合作为包埋剂,包埋块在石蜡切片机(Kedee,1508A,China)上切成10 μm厚的切片。切片经乙醇脱蜡后放在滴有一滴双蒸水的粘附载玻片上,滴DAPI(1 μg·mL-1)染液,盖玻片封片,吸水纸吸掉盖玻片四周多余染液,用体视显微镜观察并拍照。
1.4 胚乳基因组DNA完整性检测
用植物基因组DNA提取试剂盒EasyPure Plant Genomic DNA(Transgen, China) 提取不同时期籽粒胚乳基因组DNA。核酸蛋白分析仪(NanoDrop,USA)检测基因组DNA的纯度和浓度。3.5% SDS聚丙烯酰胺凝胶电泳进行片段化检测,各时期各处理保持上样量一致,银染法染色观察。
1.5 胚乳细胞细胞核的计数
参考Singh等[17]的方法并稍作修改。取4个小麦籽粒,剥除种皮和种胚,在卡诺氏固定液中固定24 h,储存在70%酒精中备用。将固定好的材料经系列浓度的酒精复水、60 ℃水浴、HCl处理、锡夫试剂黑暗染色。水洗后0.5%纤维素酶酶解过夜;用水将酶解液定容至10 mL,混匀后吸取0.5 mL于10 mL水中,通过微孔滤膜(孔径0.22 μm,直径13 mm)抽滤,将滤膜放置在滴有甘油的载玻片上,在光学显微镜下观察被染红的细胞核数目,每个样本计10个视野。
1.6 胚乳核酸酶活性、核酸含量测定
核酸酶活性测定参考杨 莉等[18]的方法;核酸含量参照朱广廉等[19]的方法测定。
1.7 胚乳细胞超微结构观察
超薄切片的制备参照李和平[20]的方法,切片用醋酸铀、柠檬酸铅双染色,透射电子显微镜(JEMTEM 100CX II,Japan)观察与拍照。
1.8 籽粒粒重测定
籽粒粒重测定参考兰盛银等[21]的方法,取不同发育时期的颖果,105 ℃下杀青 30 min 后 80 ℃下烘至恒重,计算籽粒的千粒重。
1.9 乙烯受体基因相对表达量的测定
1.9.1 引物设计
用Primer Premier 5.0,根据NCBI公布的乙烯受体基因序列设计引物,由生工生物工程(上海)股份有限公司进行引物的合成。用小麦actin基因(NCBI编号DN551593)作为内参。引物序列见表1。
1.9.2 RNA的提取和cDNA的合成
将保存于-80 ℃冰箱的新鲜样品于液氮中研磨,用Fruit-mate(Takara, Japan)和RNAiso plus (Takara,Japan)试剂盒按说明书提取RNA,通过琼脂糖凝胶电泳检验提取的总RNA完整性。用TIANScript cDNA第一链合成试剂盒(Tiangen, China)合成cDNA,用合成的cDNA作为模板扩增actin基因以检验其完整性。
1.9.3 基因的相对表达量测定
使用SYBR Green I Master 试剂盒 (Roche,USA),用实时荧光定量PCR仪(Roche Light Cycler 480 Ⅱ)扩增各个基因,具体操作按说明书进行。
1.10 数据分析
使用Excel 2003和 SPSS 13.0进行数据处理。基因相对表达量按下面的公式计算:
△Ct=Ct1-Ct2
相对表达量=2-△Ct
式中:△Ct为目标基因与内参基因的差值;Ct1为目标基因;Ct2为内参基因。

表1 引物序列表Table 1 Information of the primers used in this study
2 结果与分析
2.1 硝酸钴对小麦胚乳细胞活力的影响
从图1中可以看出,两个处理在灌浆初期(花后10 d)胚乳细胞不着色,其着色部位主要集中在果皮(图A1)。花后15 d胚乳开始着色(图A2),随着灌浆进程的推移着色逐渐加深(图A3、A4)。硝酸钴处理下小麦花后15、20、25 d胚乳细胞着色程度(B2-B4)明显低于同时期的对照。说明喷施硝酸钴可使胚乳细胞的活力有所提高。
2.2 硝酸钴对小麦胚乳细胞核形态的影响
从图2中可以看出,花后20 d对照胚乳细胞的细胞核发生了变形,喷施硝酸钴时小麦花后20 d细胞核形态基本保持正常,体积小且呈规则圆球形(图2A1, B1);花后25 d对照细胞核变形明显,而喷施硝酸钴时小麦胚乳细胞的正常细胞核比例明显高于对照处理(图2A2,B2)。花后30 d,对照中已基本观察不到形态正常的细胞核,但硝酸钴处理仍可以观察到形态正常的细胞核(图2A3, B3)。花后35 d,可以观察到分布在淀粉粒之间的细胞核残体,硝酸钴处理的细胞核残体数量明显多于对照(图2A4, B4)。说明喷施硝酸钴可使小麦胚乳细胞的细胞核变形解体速度减缓。
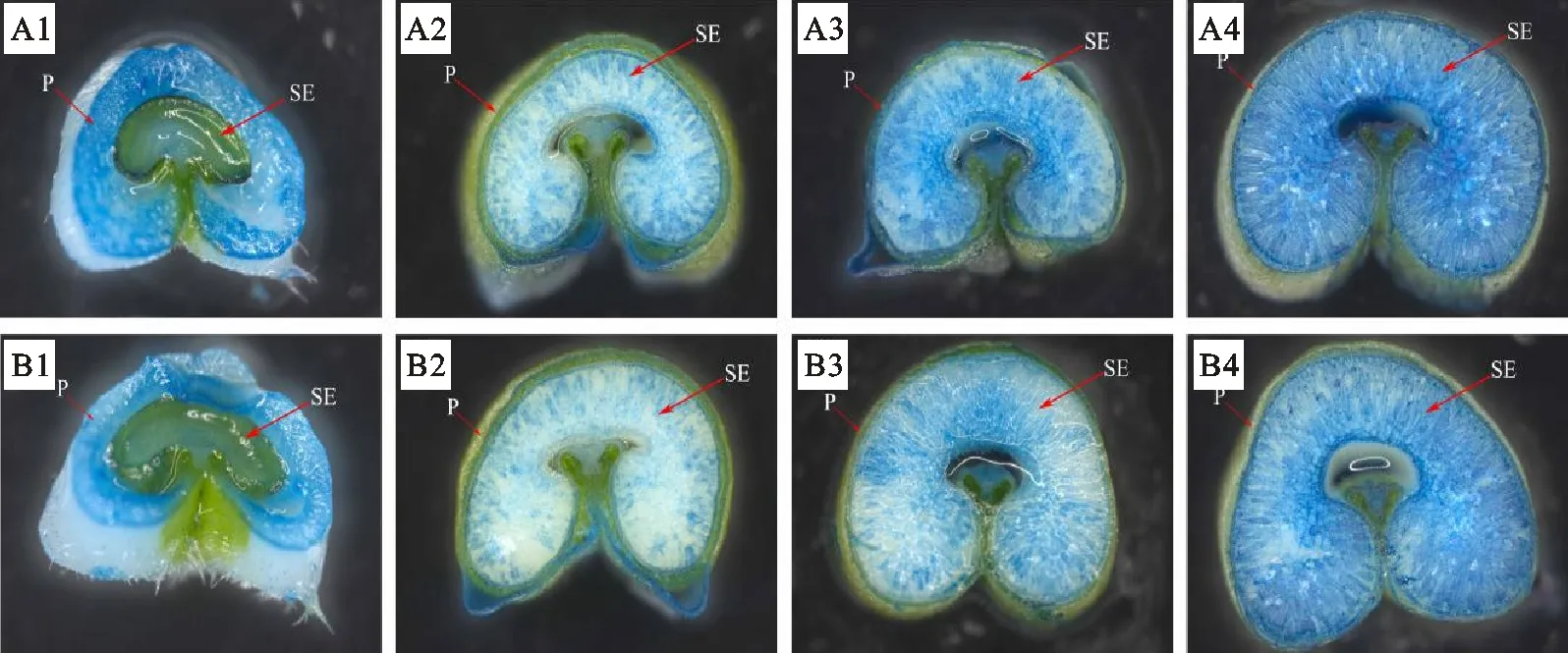
A1~A4分别为对照花后10、15、20和25 d籽粒胚乳横切面;B1~B4分别为喷施硝酸钴处理下花后10、15、20和25 d籽粒胚乳横切面。SE:胚乳;P:种皮。
A1-A4 were the grain endosperm cross-section at 10, 15, 20 and 25 days after anthesis under control; B1-B4 were grain endosperm cross-section treated with cobalt nitrate at 10, 15, 20 and 25 days after anthesis; SE:Endosperm; P:Pericarp.
图1小麦籽粒花后不同时期的Evan’sBlue染色图
Fig.1PictureofEvan’sBluestainingofwheatatdifferentstagesafteranthesis
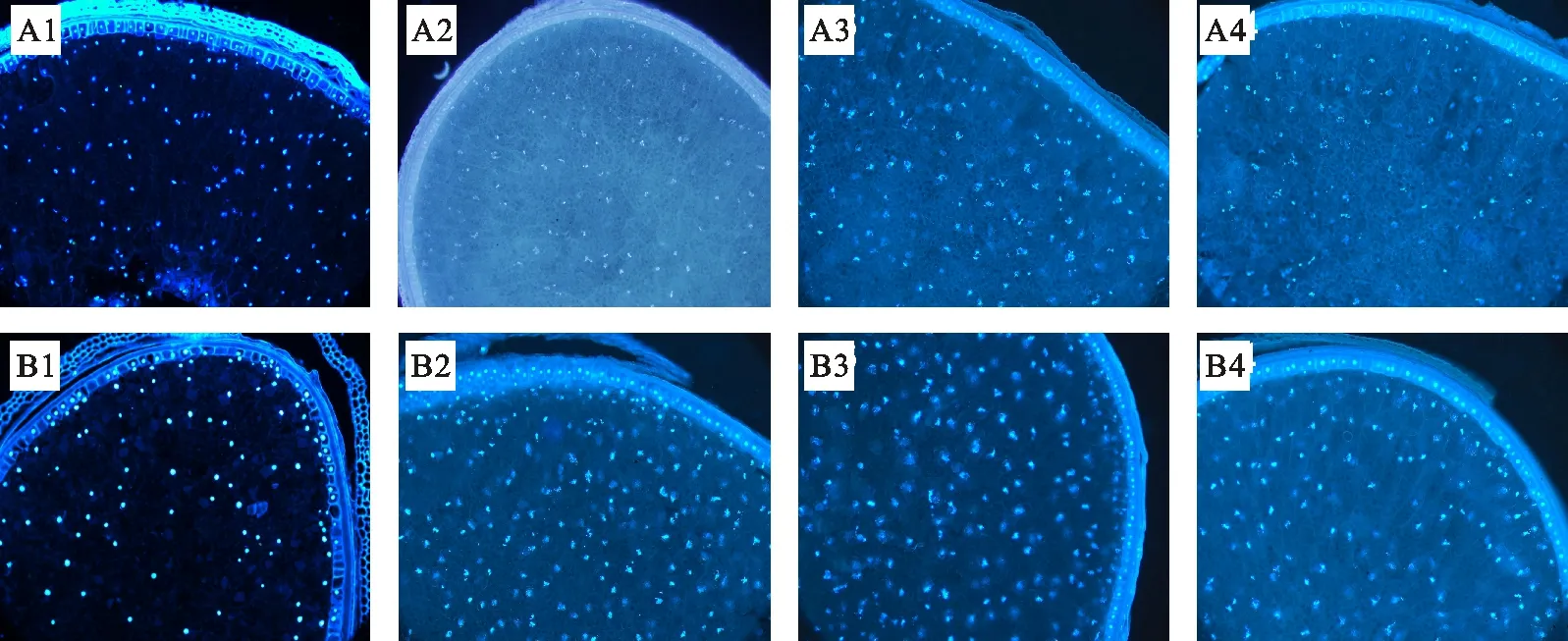
A1~A4分别为对照花后20、25、30和35 d;B1~B4分别为喷施硝酸钴处理组花后20、25、30和35 d。放大倍数为150倍。
A1-A4 were control at 20, 25, 30 and 35 days after anthesis, respectively; B1-B4 were sprayed with cobalt nitrate at 20, 25, 30 and 35 days after anthesis, respectively, with the magnification of 150 times.
图2小麦胚乳细胞的DAPI染色图
Fig.2PictureofDAPIstainingofwheatendospermcells
2.3 小麦胚乳细胞超微结构的变化
对不同发育时期的小麦胚乳细胞进行透射电镜观察发现,干旱条件下,花后15 d,对照的细胞核变形比较严重,但核仁较为明显;硝酸钴处理的细胞核变形不明显,只观察到了轻微的核膜内陷(图3A1, B1)。花后20 d,对照的细胞核被淀粉粒包裹,核仁消失,异染色质增多,核质浓缩;硝酸钴处理的染色质也发生了浓缩,但核仁仍在,细胞核形态仍表现正常形态(图3A2, B2)。花后25 d,对照的细胞核解体消失,只剩下核残体分布在淀粉颗粒之间;硝酸钴处理的细胞核核质浓缩,但仍可以观察到细胞核的存在(图3A3, B3)。说明喷施硝酸钴可使胚乳细胞核变形和降解速度明显变缓,这与DAPI染色观察到的结果一致。

A1~A3分别是对照花后15、20和25 d的胚乳细胞核;B1~B3 分别是喷施硝酸钴花后15、20和25 d的胚乳细胞核。图A1和A3中箭头指向核膜内陷;图A3中箭头指向细胞核残体。n:细胞核;s:淀粉粒;v:液泡;p:蛋白质。
A1-A3 were the endosperm nuclei of the control treatment at 15, 20 and 25 days after anthesis, respectively;B1-B3 were the endosperm nuclei of cobalt nitrate treatment at 15, 20 and 25 days after anthesis, respectively. The arrows in A1 and A3 point to nuclear membrane retraction; The arrow in A3 point to the nucleus remnant. N:Nucleus; S:Starch; V:Vacuole; P:Protein.
图3小麦胚乳细胞核的超微结构变化
Fig.3Ultra-structuralmorphologicalchangesofnucleusinwheatstarchyendosperm
2.4 硝酸钴对小麦胚乳细胞DNA完整性的影响
基因组DNA特异片段化是PCD的典型标志。采用聚丙烯酰胺凝胶电泳进行DNA片段化的检测(图4)发现,在花后20 d可以检测到胚乳细胞DNA特意片段,但不十分明显,随着灌浆时期的推移,片段化程度加深,对照在花后30 d胚乳细胞DNA片段化达到最大程度,35 d DNA片段化程度减弱。硝酸钴处理的胚乳细胞达到片段化最大程度的时期推迟到花后35 d,且片段化最大程度明显弱于对照组。说明花后喷施硝酸钴可有效延缓胚乳细胞DNA片段化峰值出现的时间。
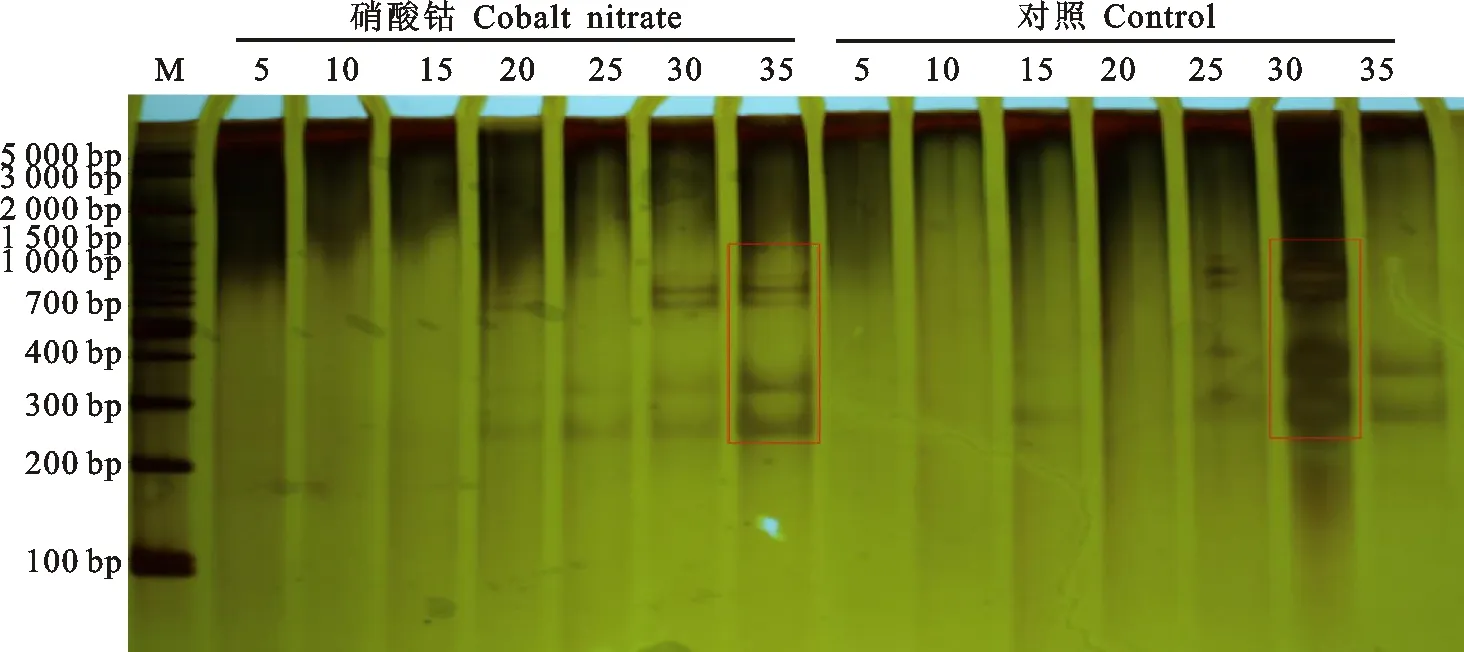
5~35:开花后天数;M:DNA 标准分子量;DPA:花后天数。
5-35:Days after anthesis;M:DNA Marker;DPA:Days after anthesis.
图4小麦籽粒基因组DNA的聚丙烯酰氨凝胶电泳图谱
Fig.4PolyacrylamidegelelectrophoresismapofgenomicDNAinwheatgrain
2.5 小麦胚乳细胞细胞核的数目变化
为了观察小麦胚乳PCD过程中胚乳细胞数量变化, 对花后各时期胚乳细胞核数目进行了统计。如图5所示,两个处理的胚乳细胞核数量变化趋势相同,开花后5~10 d是胚乳细胞核快速增殖期,花后20 d达到峰值后开始迅速减少。硝酸钴处理的花后15、20和30 d胚乳细胞核数目显著高于对照。说明在干旱胁迫下喷施硝酸钴可以显著增加胚乳细胞数目,减缓灌浆后期胚乳PCD发生速率。
2.6 小麦胚乳细胞DNA水解酶活性变化
为了进一步研究喷施硝酸钴对胚乳PCD的影响,测定了花后不同时期小麦籽粒DNA水解酶活性。结果如图6所示,在干旱条件下喷施硝酸钴可明显降低各时期小麦籽粒中DNA水解酶的活性。两个处理的DNA水解酶活性变化趋势相同,均呈先增后降的单峰曲线,在花后30 d DNA水解酶活性达到峰值。在硝酸钴处理下,在花后15、20、25和30 d,DNA水解酶活性显著低于对照,但在花后35 d显著高于对照,这可能是由于喷施硝酸钴在花后35 d仍有较多胚乳细胞未完全死亡,仍需较多核酸水解酶。在相同时期,喷施硝酸钴处理的DNA水解酶活性显著低于对照,且DNA水解酶活性升高时伴随DNA片段化高发,说明喷施硝酸钴可以显著降DNA水解酶活性,进而降低DNA片段化程度。
2.7 乙烯受体蛋白基因表达的变化
不同处理下乙烯受体蛋白基因的相对表达量

*和**分别代表处理间在0.05和0.01水平差异显著。下同。
* and ** represent significant difference at 0.05 and 0.01 level between treatments,respectively. The same in figure 5, 6 and table 1.
图5小麦胚乳细胞的细胞核数目
Fig.5Numberofnucleiofwheatendospermcell
如图7所示。硝酸钴处理下 ers1基因在花后15、20、30和35 d表达量显著高于对照, ers2基因在花后25、30和35 d表达量显著高于对照, etr1基因表达量在花后20、30和35 d显著高于对照, etr2基因表达量在花后25~35 d显著高于对照。 ers1和 etr2基因表达量低峰值均出现在灌浆中期(15~25 d), etr1基因表达量低峰值出现在花后20和25 d。在小麦灌浆过程中,四个乙烯受体基因表达模式不尽相同,但硝酸钴处理较对照的表达量呈显著上调趋势,且乙烯受体蛋白表达峰值主要出现在灌浆后期。

图6 小麦籽粒核酸水解酶活性
2.8 小麦千粒重的变化
由表 1可知,在花后10、15和25 d,硝酸钴处理的小麦千粒重极显著高于对照;花后35 d,硝酸钴处理的小麦千粒重显著高于对照组;花后20和30 d两处理组间千粒重无显著差异。花后15~25d是胚乳细胞PCD快速发生的阶段,在这一阶段两个处理的千粒重增加幅度都比较大。花后30~35 d,胚乳细胞基本死亡,粒重几乎无增加。
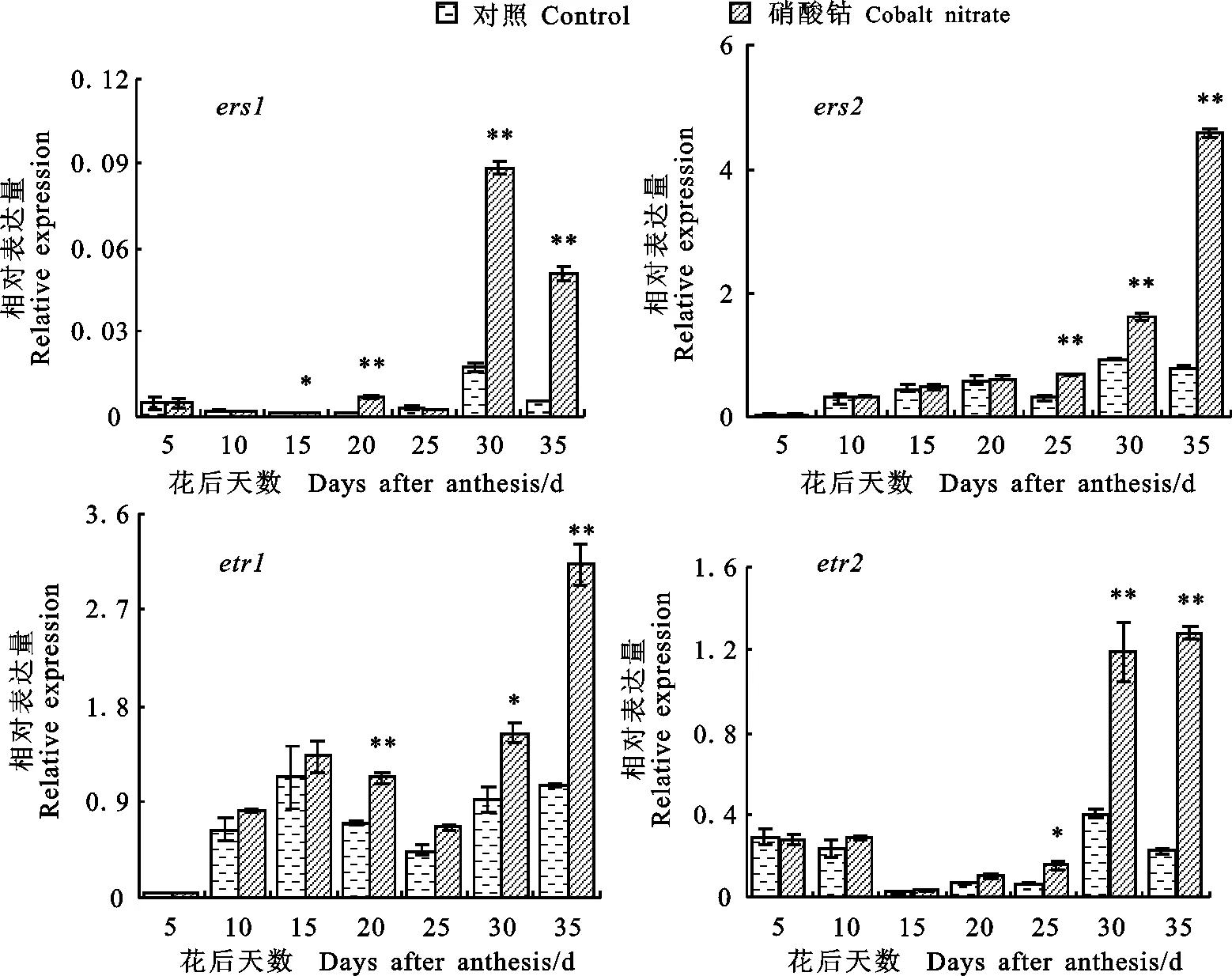
图7 不同处理下小麦不同发育时期籽粒中乙烯受体基因的相对表达量

花后天数Daysafteranthesis/d对照Control/g喷施硝酸钴Sprayingcobaltnitrate/g105.36±0.347.95±0.13∗∗1510.48±0.4612.19±0.27∗∗2024.66±0.1124.80±0.622537.30±0.6238.59±0.84∗∗3039.56±0.1942.15±1.013539.92±0.4942.27±0.83∗
3 讨 论
胚乳是小麦籽粒贮藏物质(淀粉和蛋白)的主要积累部位,占籽粒重量85%以上,胚乳的发育状况对粒重乃至品质起到至关重要的作用[22]。胚乳细胞的发育伴随着贮藏物质的积累和胚乳PCD的过程,Young[1]和Fan等[23]研究发现,小麦胚乳PCD在籽粒灌浆的早期即开始出现,且PCD发生部位是随机的。本研究通过Evan’s Blue染色发现,在干旱条件下花后15 d胚乳细胞即开始发生PCD直到籽粒成熟,这与Young[1]和Fan等[23]的研究结果一致;对花后干旱胁迫的小麦穗部喷施硝酸钴发现,同一时期细胞活力有所提高。Young[1]和李 睿等[2]研究发现,对小麦穗部喷施外源乙烯能够加速胚乳PCD,使DNA片段化程度加深。本研究结果显示,喷施硝酸钴小麦胚乳细胞DNA片段化程度有所减弱,且达到片段化峰值时间推后,这与Young[1]和李 睿等[2]的研究结果一致。说明在灌浆期间对小麦穗部喷施乙烯合成抑制剂可以提高胚乳细胞活力,推迟和减弱DNA片段化,延缓胚乳PCD进程。
本研究通过对花后各发育时期的小麦胚乳细胞核染色和细胞核超微结构观察发现,胚乳PCD过程伴随着细胞核的衰退和解体。在成熟胚乳细胞中,细胞核残体仍然可见,这与韦存虚等[24]在大麦和Chen等[25]在小麦中的研究结果一致。但水稻胚乳PCD过程中,胚乳细胞首先完成去核化(花后12 d),且细胞核衰退和解体的同时也是灌浆速率最大化的时期,胚乳细胞完成去核化后灌浆速率显著下降[21]。本研究结果显示,小麦胚乳PCD快速发生期是千粒重增加的高峰时期,说明延长胚乳细胞核衰退和解体时间可以延长籽粒灌浆期。通过对小麦穗部喷施硝酸钴发现,胚乳细胞细胞核的衰退速度有所下降,且最大胚乳细胞数目明显增加。喷施硝酸钴能够明显降低胚乳细胞中核酸水解酶活性,进而延缓细胞核衰退的时间。说明喷施硝酸钴可降低籽粒中乙烯含量,进而降低了核酸水解酶活性使DNA片段化推迟,增加了后期胚乳发育所需要的基因转录,使得淀粉合成和蛋白积累增多,进而使籽粒粒重增加。
Rantong等[14]研究发现,乙烯和乙烯受体水平是影响细胞PCD的关键因素。乙烯受体是调节乙烯通路的负调节子,与乙烯结合后就会失去活性[26]。当任意一个乙烯受体发生突变,植物对乙烯的反应不会发生很大变化,说明这五个受体虽然结构不同,但功能相似、可以相互替代;而当5个受体基因全部突变后,植物会组成性地表现对乙烯的反应[27]。本研究结果显示,在籽粒灌浆中期(花后15~25 d),乙烯受体的整体表达量下降,暗示造成胚乳细胞PCD所需要的乙烯的阈值下降,而此时正是胚乳PCD快速发生时期; 这表明低表达量的乙烯受体是导致胚乳发生PCD的重要因素。喷施硝酸钴后,灌浆中后期乙烯受体表达量明显上调,推测喷施硝酸钴不仅可以抑制乙烯生成,还可以增加胚乳PCD发生所需要的乙烯阈值水平。
本研究结果表明,在花后干旱胁迫下,对小麦穗部喷施硝酸钴(乙烯合成抑制剂)可以降低小麦胚乳细胞中核酸水解酶活性,增加胚乳细胞数量,延缓胚乳PCD进程,进而延长灌浆时间,增加粒重。这为探索小麦灌浆期通过栽培措施调节小麦籽粒中内源激素水平,以应对花后干旱环境对小麦籽粒灌浆带来的危害,从而为小麦的增产稳产和品质改良提供理论依据。
[1] YOUNG T E,GALLIE D R.Analysis of programmed cell death in wheat endosperm reveals differences in endosperm development between cereals [J].PlantMolecularBiology,1999,39(5):915.
[2] 李 睿,兰盛银,徐珍秀.外源激素对小麦胚乳程序性细胞死亡和子粒灌浆的影响 [J].湖北农业科学,2004(5):26.
LI R ,LAN S Y,XU X Z.The effect of exogenous hormones on the programmed cell death of endosperm and the grain filling in wheat [J].HubeiAgriculturalSciences,2004(5):26.
[3] YANG J,ZHANG J,LIU K,etal.Abscisic acid and ethylene interact in wheat grains in response to soil drying during grain filling [J].NewPhytologist,2006,171(2):293.
[4] LI C,LI C Y,ZHANG R Q,etal.Effects of drought on the morphological and physicochemical characteristics of starch granules in different elite wheat varieties [J].JournalofCerealScience,2015,66:66
[5] MUOZ M,CALDERINI D F.Volume,water content,epidermal cell area,and XTH5 expression in growing grains of wheat across ploidy levels [J].FieldCropsResearch,2015,173:30.
[6] 周竹青,朱旭彤.小麦籽粒胚乳细胞增殖动态及其与粒重和体积的关系 [J].麦类作物学报,2003,23(2):57.
ZHOU Z Q,ZHU X D.Dynamic of endosperm cell proliferation and relation to grain weight and grain volume of wheat [J].JournalofTriticeaeCrops,2003,23(2):57.
[7] WANG M,OPPEDIJK B J,CASPERS M P M,etal.Spatial and temporal regulation of DNA fragmentation in the aleurone of germinating barley [J].JournalofExperimentalBotany,1998,49(325):1293.
[8] OLSEN O A,BECRAFT P W.Endosperm development [J].PlantCell,1998,10(4):485.
[9] YOUNG T E,GALLIE D R.Programmed cell death during endosperm development [M]// Programmed cell death in higher plants.Springer Netherlands,2000:41.
[10] WOLTERS H,J RGENS G.Survival of the flexible:Hormonal growth control and adaptation in plant development [J].NatureReviewsGenetics,2009,10(5):305.
[11] 董庆坤,刘慧丽.植物激素调控籽粒大小的研究进展[J].华南师范大学学报(自然科学版),2015,47(6):74.
DONG Q K,LIU H L.Progress on the plant hormone regulation related to seed development [J].JournalofSouthChinaNormalUniversity(NaturalScienceEdition),2015,47(6):74.
[12] 熊国胜,李家洋,王永红.植物激素调控研究进展 [J].科学通报,2009(18):2718.
XIONG G S,LI J Y,WANG Y H.Advances in the regulation and crosstalks of phytohomones [J].ChineseScienceBulletin,2009(18):2718.
[13] YOUNG T E,GALLIE D R,DEMASON D A.Ethylene-mediated programmed cell death during maize endosperm development of wild-type and shrunken2 genotypes [J].PlantPhysiology,1997,115(2):737.
[14] RANTONG G,EVANS R,GUNAWARDENA A H.Lace plant ethylene receptors,AmERS1a and AmERS1c,regulate ethylene-induced programmed cell death during leaf morphogenesis [J].PlantMolecularBiology,2015,89(3):216.
[15] GALLIE D R,YOUNG T E.The ethylene biosynthetic and perception machinery is differentially expressed during endosperm and embryo development in maize [J].MolecularGenetics&Genomics,2004,271(271):267.
[16] 安丽华,尤瑞麟.一种用于DAPI染色的方法-Steedman’s wax包埋切片法[J].西北植物学报,2004,24(8):1368.
AN L H,YOU R L.Steedman’s wax,a low melting point embedding medium for DAPI staining [J].ActaBotanicaBoreali-OccidentaliaSinica,2004,24(8):1368.
[17] SINGH B K,JENNER C F.A modified method for the determination of cell number in wheat endosperm [J].PlantScienceLetters,1982,26(2-3):274.
[18] 杨 莉,郭蔼光,汪沛洪.小麦返白系叶片核酸含量及核酸酶活性研究 [J].西北农业学报,2001,10(2):33.
YANG L,GUO A G,WANG P H.Research on the nucleic acid contents and nuclease activitated for leaves of wheat albescent line during the albescent period [J].ActaAgriculturaeBoreali-occidentalisSinica,2001,10(2):33.
[19] 朱广廉.植物生理学实验 [M].北京:北京大学出版社,1990:76.
ZHU G L.Plant physiology experiments [M].Beijing:Beijing University Press,1990:76.
[20] 李和平.植物显微技术 [M].北京:科学出版社,2009:78.
LI H P.Plant microtechniques [M]. Beijing:Science Press,2009:78.
[21] 兰盛银,钟方旭,杨泽敏,等.水稻淀粉胚乳程序性细胞死亡中的去核化 [J].实验生物学报,2004,37:42.
LAN S Y,ZHONG F X,YANG Z M,etal.The starchy endosperm denucleation by a process of programmed cell death during rice grain development [J].ActaBiologiaeExperimentalisSinica,2004,37:42.
[22] 王 忠,顾蕴洁,李卫芳,等.小麦胚乳发育及其养分输入的途径 [J].作物学报,1998,24(5):536.
WANG Z,GU W J,LI W F,etal.The development of endosperm and the pathway of nutrient transport in wheat [J].ActaAgronomicaSinica,1998,24(5):536.
[23] FAN H Y,ZHOU Z Q,YANG C N,etal.Effects of waterlogging on amyloplasts and programmed cell death in endosperm cells ofTriticumaestivumL.[J].Protoplasma,2013,250(5):1096.
[24] 韦存虚,张 军,谢佩松,等.大麦淀粉胚乳发育期间程序性细胞死亡的研究 [J].中国农业科学,2009,42(3):831.
WEI C X,ZHANG J,XIE P S,etal.Studies on the programmed cell death in barley during starchy endosperm development [J].ScientiaAgriculturaSinica,2009,42(3):831.
[25] CHEN Y,ZHANG J,XIE P,etal.Programmed cell death in wheat starchy endosperm during kernel development [J].AfricanJournalofAgriculturalResearch,2012,7(49):6537.
[26] HALL B P,SHAKEEL S N,SCHALLER G E.Ethylene receptors:Ethylene perception and signal transduction [J].JournalofPlantGrowthRegulation,2007,26(2):119.
[27] LI H,GUO H.Molecular basis of the ethylene signaling and response pathway in arabidopsis [J].JournalofPlantGrowthRegulation,2007,26(2):108.
