多重易位小麦新品种(系)的选育及细胞学鉴定
2018-03-28杨漫宇杨足君杨武云杨恩年
杨漫宇,杨足君,杨武云,杨恩年
(1.四川省农业科学院作物研究所,四川成都 610066; 2.电子科技大学生命科学与技术学院,四川成都 611731)
小麦是世界上重要的粮食作物之一,小麦生产的安全性对经济发展和社会稳定均具有重要意义。而小麦-外源染色体易位新种质的创制对于培育突破性新品种具有举足轻重的作用。有关染色体易位的研究,主要涉及小麦与其近缘种属间的染色体易位,如黑麦属[1-3]、簇毛麦属[4-5]、偃麦草属[6]等。由于大部分小麦-外源易位系都是非同源染色体间易位,补偿性差,基因组重复或缺失,导致其农艺性状差,很难直接用于小麦品种改良[7]。在利用异源染色体易位培育新品种方面,以小麦-黑麦1RS·1BL、小麦-簇毛麦6VS·6AL以及小偃6号中的小麦-长穗偃麦草易位这3个易位系的应用最为成功。目前,利用1RS·1BL和6VS·6AL易位培育出的小麦新品种,在世界上数十个国家中推广应用[8-9]。在我国,以小麦-黑麦1RS·1BL易位系为亲本,育成了丰抗号、矮孟牛系列、鲁麦8 号、鲁麦11 号等一系列抗逆、抗病、高产小麦品种[10];以小麦-簇毛麦6VS·6AL易位系为亲本,育成了南农9918、石麦14、扬麦18、内麦系列等一批小麦品种[9,11];以小偃6号为亲本育成并大面积推广的品种已知有49个[12]。然而,在利用小麦-异源易位染色体的同时,还应关注小麦染色体之间的易位。例如,欧洲培育的小麦品种大多含有5BS·7BS和5BL·7BL易位染色体,推测这对相互易位染色体可能更适应欧洲气候条件[13-14]。大量的研究表明[15-20],双重或多重易位系具有良好的抗病性或优异的农艺性状特性,能够用于小麦育种改良。如小麦-黑麦-簇毛麦纯合双重易位系(1RS·1BL,6VS·6AL)和小麦-黑麦-簇毛麦纯合三重易位系(1RS·7DS,1BL·7DL,6VS·6AL)具有良好的农艺性状和白粉病抗性[15-17];小麦-簇毛麦-小伞山羊草双重易位系(6VS·6AL,6AL·6AS-6US)育性优良且抗白粉病[18];小麦-黑麦-长穗偃麦草双重易位系(1RS·1BL,7DL-7Ai)抗病性好、耐旱、产量高[19];小麦-黑麦三重易位(5BS·7BS,5BL·7BL, 4BL·5RL )对铜元素具有高效利用率[20]。亓增军等[17]认为,将不同类型的小麦易位系聚合到同一遗传背景,培育多重易位系,不仅能提高品种的抗性,还能拓宽品种的遗传基础,对小麦的品种改良和种质创新都具有一定的理论意义和应用价值。Belan等[19]报道,小麦-黑麦-长穗偃麦草双重易位系Lutescens 242/97-2-10在俄罗斯登记命名为春小麦品种Omskaya 41且已进入品种试验。然而,利用小麦染色体间的多重易位培育小麦品种(系)的报道还较少。鉴于此,本研究利用分子细胞遗传学方法对四川省农业科学院作物研究所育成的小麦品种及高代品系进行分析鉴定,以期筛选出多重易位品种(系),为小麦染色体间多重易位染色体在小麦育种中的应用提供证据和新的思路。
1 材料与方法
1.1 供试材料
供试材料为小麦品种川麦62以及两个高代品系16EW381和16EW458,均由四川省农业科学院作物研究所创制。四川省农业科学院植物保护研究所鉴定川麦62高抗条锈病、高感白粉病。16EW381和16EW458选自于杂交组合内麦8号/2*川麦62,其中,内麦8号是6VS·6AL易位系[9]。
1.2 试验方法
1.2.1 根尖中期细胞染色体制片
将待鉴定的种子置于垫有湿润滤纸的培养皿中发芽(22~24 ℃),待根尖长至1~2 cm时取根,冰水处理22~24 h后,用卡诺氏固定液固定7 d,70%的酒精保存。酶解制片方法参照Han等[21]描述的方法:根尖放入酶液37 ℃水浴50~60 min;用70%酒精洗净酶液,捣碎根尖;低速离心,倒掉酒精;适量冰醋酸重悬浮细胞;滴片,晾干;镜检观察。
1.2.2 FISH鉴定
利用寡核苷酸探针Oligo-pSc119.2-1和Oligo-pTa535-1[22]对川麦62及其高代品系16EW381和16EW458的根尖中期染色体进行非变性FISH(ND-FISH)分析。寡核苷酸探针按照Tang等[22]描述的方法在序列5′末端加上6-羧基荧光素(6-carboxyfluorescein, 6-FAM)或6-羧基四甲基若丹明(6-carboxytetramethylrhodamine, Tamra)标记成绿色或红色,由上海英骏生物技术有限公司合成。寡核苷酸探针序列详见表1。原位杂交程序参照Fu等[23]描述的方法:将适量的探针加入2×SSC/1×TE Buffer中充分混匀备用,每张玻片加10 μL的杂交液后置于42 ℃恒温箱中杂交1 h,杂交好的玻片于2×SSC溶液中洗脱(室温),晾干后加10 μL含PI或DAPI的抗褪色剂进行染色,几分钟后使用OLYMPUS BX51荧光显微镜观察并照相。
1.2.3 产量比较与抗病性鉴定
产量比较试验:试验采用随机区组设计,3次重复,小区计产面积为13 m2,每个小区8行,行长6.5 m,行距25 cm,播种量以180万株·hm-2为标准。以川麦62为对照。
条锈病抗性鉴定:采用条锈病生理小种条中30号、条中31号、条中32号及水源11的混合菌种接种诱发材料川育12,菌种由甘肃省农科院植物保护研究所贾秋珍提供。待供试材料充分发病时进行观察并记载反应型(infection type,IT),按0、0;、1、2、3、4六级标准记载,其中,0、0;、1、2为抗病反应型,3和4为感病反应型[24]。白粉病抗性鉴定:采用田间自然发病法,待供试材料充分发病时采用0~9级的分级标准进行记载,其中,0为免疫,0;为近免疫,1~2为高抗,3~4为中抗,5~6为中感,7~9为高感[25]。
2 结果与分析
2.1 小麦品种川麦62的细胞学分析结果
随机选取10粒川麦62种子进行根尖有丝分裂中期染色体的ND-FISH分析,结果发现,10粒种子的染色体数目均为2n=42。以Tang等[22]利用寡核苷酸探针建立的中国春和绵阳11的标准核型作参考,分析发现,川麦62含一对5BS·7BS易位染色体以及一对5BL·7BL易位染色体(图1),而且10粒种子都含有这两对相互易位染色体。
2.2 高代品系16EW381和16EW458的产量及抗病性
为了利用高抗白粉病的6VS·6AL易位系品种内麦8号改良川麦62高感白粉病的缺点,本课题组用川麦62与内麦8号杂交、回交,选育出了高代稳定品系16EW381和16EW458。2017年度品种比较试验结果(表2)表明,16EW381和16EW458的产量分别为5 365.50和5 160.30kg·hm-2,两者产量在0.05水平上均显著高于亲本川麦62的产量(4 468.95 kg·hm-2)。抗病性鉴定结果(表2)表明,16EW381高抗条锈病和白粉病,16EW458中抗条锈病和高抗白粉病,川麦62高抗条锈病和高感白粉病。说明16EW381和16EW458比亲本川麦62在产量和抗病性方面都得到了显著改善。

表1 寡核苷酸探针序列Table 1 Sequences of oligonucleotide probes
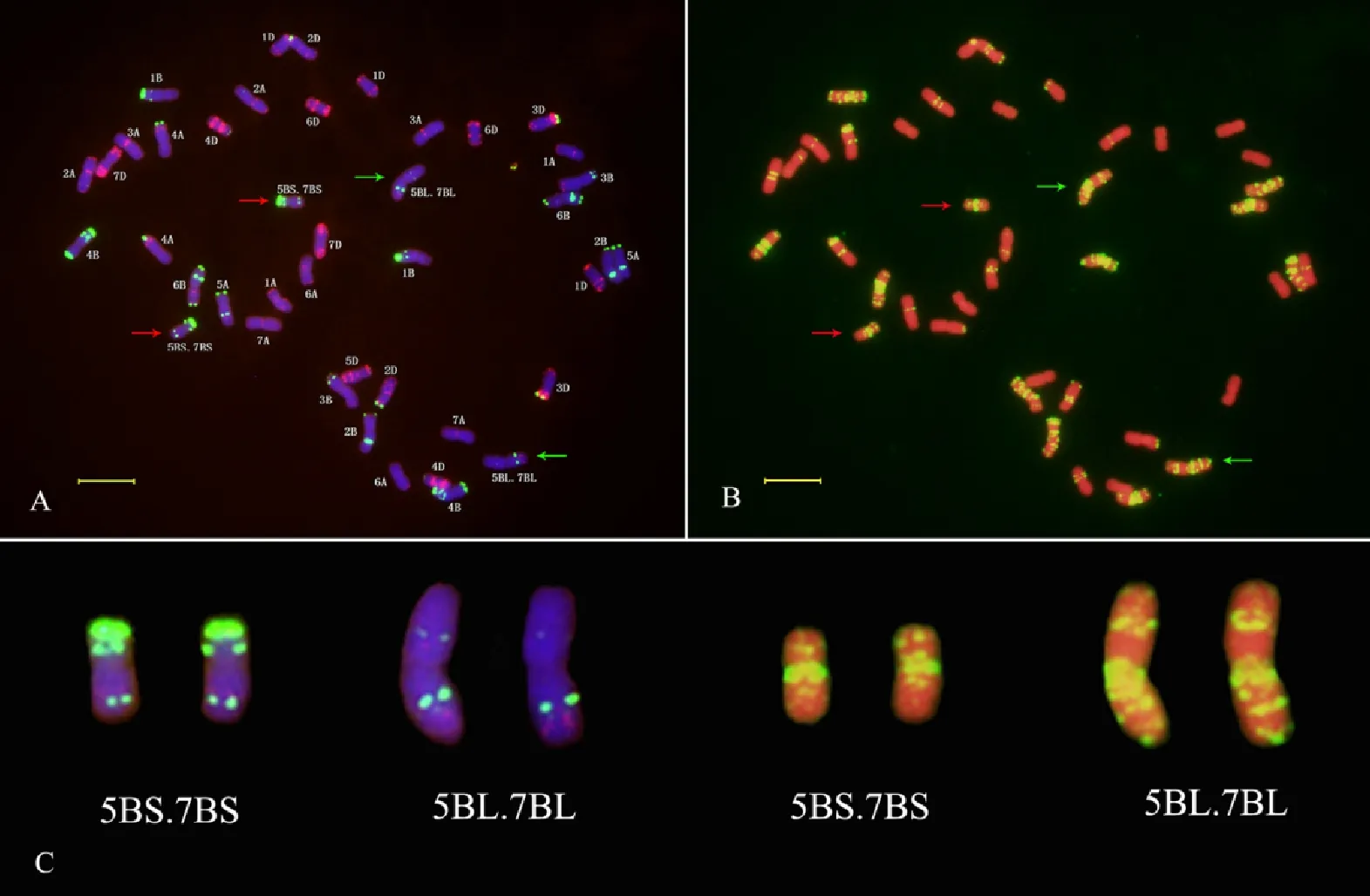
图A中,以Oligo-pTa535(红色信号)和Oligo-pSc119.2(绿色信号)作探针,染色体被DAPI染为蓝色;图B中,以Oligo-(GAA)7(黄色信号)作探针,染色体被PI染为红色;红色箭头示5BS·7BS易位染色体,绿色箭头示5BL·7BL易位染色体;图C中,易位染色体来源于图A和图B;标尺为10 μm。
In Fig.A,the Oligo-pTa535(red) and Oligo-pSc119.2(green) were used as ND-FISH probes,and chromosomes were counterstained with DAPI(blue);In Fig.B,the Oligo-(GAA)7(yellow) were used as ND-FISH probes,and chromosomes were counterstained with PI(red);Red arrows indicate 5BS·7BS translocation chromosomes;Green arrows indicate 5BL·7BL translocation chromosomes;Translocation chromosomes in Fig.C were from Fig.A and Fig.B;Bar indicates 10 μm.
图1川麦62根尖中期染色体的ND-FISH分析
Fig.1ND-FISHanalysisofmetaphasechromosomesinroot-tipofChuanmai62
2.3 高代品系16EW381和16EW458的细胞学分析结果
为了进一步明确16EW381和16EW458的染色体组成,随机从这两个品系及内麦8号中各选取10粒种子进行根尖中期染色体的ND-FISH分析,结果发现,16EW381和16EW458染色体数目均为2n=42(图3);16EW458含有来自于亲本内麦8号的一对6VS·6AL易位染色体及来自于亲本川麦62的一对5BS·7BS易位染色体和一对5BL·7BL易位染色体(图1、图2和图3A~3C);16EW381除了含有来自双亲的6VS·6AL易位染色体、5BS·7BS易位染色体和5BL·7BL易位染色体以外,还发现有3B和5A染色体间发生的相互易位染色体,即3BS·5AS易位染色体和3BL·5AL易位染色体(图1、图2和图3D~3F)。说明16EW381和16EW458的遗传背景中都成功地转入了6VS·6AL易位染色体,其中,16EW458是含有6VS·6AL、5BS·7BS和5BL·7BL易位染色体的三重易位系;16EW381是含有6VS·6AL、5BS·7BS、5BL·7BL、3BS·5AS和3BL·5AL易位染色体的五重易位系。

表2 产量比较和抗病性鉴定结果Table 2 Results of yield comparison and identification of resistance to stripe rust and powdery mildew
同列数据后不同字母表示差异在0.05水平显著;HR:高抗;MR:中抗;HS:高感。
Different letters following the data indicated the difference was significant at 0.05 level;HR:High resistance;MR:Moderate resistance;HS:High susceptibility.
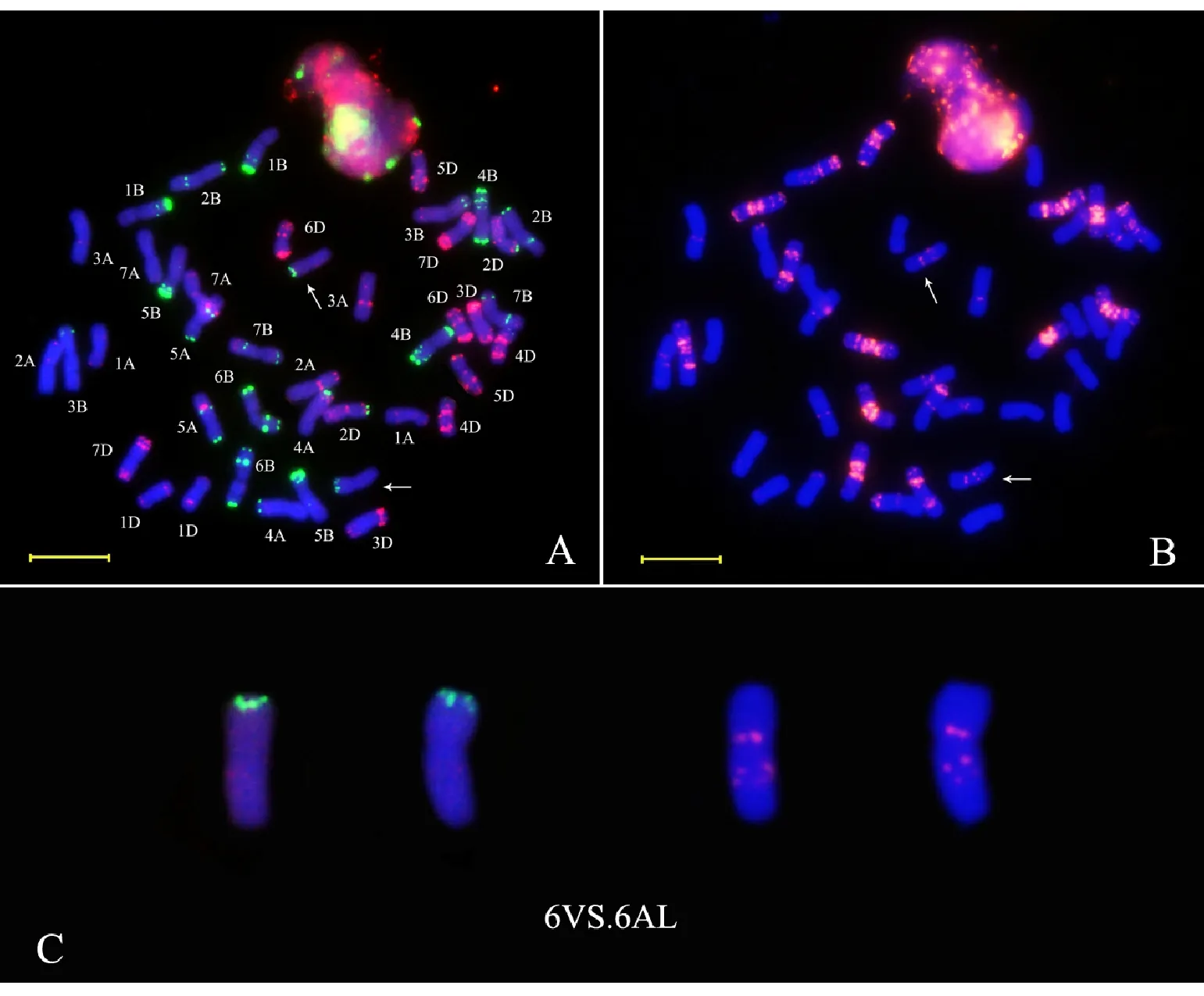
图A中,以Oligo-pTa535(红色信号)和Oligo-pSc119.2(绿色信号)作探针,染色体被DAPI染为蓝色;图B中,以Oligo-(GAA)7(红色信号)作探针,染色体被DAPI染为蓝色;箭头示6VS·6AL易位染色体;图C中,易位染色体来源于图A和图B;标尺长度为10 μm。
In Fig.A,the Oligo-pTa535(red) and Oligo-pSc119.2(green) were used as ND-FISH probes,and chromosomes were counterstained with DAPI(blue);In Fig.B,the Oligo-(GAA)7(red) were used as ND-FISH probes,and chromosomes were counterstained with DAPI(blue);Arrows indicate 6VS·6AL translocation chromosomes;Translocation chromosomes in Fig.C were from Fig.A and Fig.B;Bar indicates 10 μm.
图2内麦8号根尖中期染色体的ND-FISH分析
Fig.2ND-FISHanalysisofmetaphasechromosomesinroot-tipofNeimai8
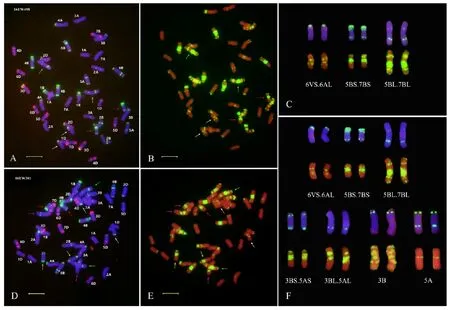
图A和D中,以Oligo-pTa535(红色信号)和Oligo-pSc119.2(绿色信号)作探针,染色体被DAPI染为蓝色;图B和E中,以Oligo-(GAA)7(红色信号)作探针,染色体被PI染为红色;白色箭头指示6VS·6AL易位染色体;红色箭头指示5BS·7BS易位染色体;绿色箭头指示5BL·7BL易位染色体;黄色箭头指示3BS·5AS易位染色体;紫色箭头指示3BL·5AL易位染色体;图C中,易位染色体来源于图A和图B;图F中,易位染色体来源于图D和图E,3B和5A染色体分别来源于图1A和图1B;标尺长度为10 μm。
In Fig.A and D,the Oligo-pTa535(red) and Oligo-pSc119.2(green) were used as ND-FISH probes,and chromosomes were counterstained with DAPI(blue);In Fig.B and E,the Oligo-(GAA)7(yellow) were used as ND-FISH probes,and chromosomes were counterstained with PI(red);White arrows indicate 6VS·6AL translocation chromosomes;Red arrows indicate 5BS·7BS translocation chromosomes;Green arrows indicate 5BL·7BL translocation chromosomes;Yellow arrows indicate 3BS·5AS translocation chromosomes;Purple arrows indicate 3BL·5AL translocation chromosomes;Translocation chromosomes in Fig.C were from Fig.A and Fig.B;In Fig.F, translocation chromosomes were from Fig.D and Fig.E,and chromosomes 3B and 5A were from Fig.1A and Fig.1B,respectively;Bar indicates 10 μm.
图316EW458(A、B和C)和16EW381(D、E和F)根尖中期染色体的ND-FISH分析
Fig.3ND-FISHanalysisofmetaphasechromosomesinroot-tipof16EW458(A,BandC)and16EW381(D,EandF)
3 讨 论
3.1 荧光原位杂交技术快速鉴定小麦多重易位系辅助育种选择
通过染色体易位将外源优异基因导入小麦是小麦品种改良的重要途径之一,而外源遗传物质及小麦基因组本生状态的准确鉴定对育种工作者显得十分重要。以重复序列作探针的FISH技术作为识别小麦染色体的一个强有力工具被广泛应用。利用重复序列pSc119.2和Afa 家族进行FISH分析, Kubalakova等[26]和Sepsi等[27]成功地识别了小麦所有染色体。Komuro等[28]利用重复序列pSc119.2、pTa-535以及简单重复序列GAA对小麦A、B、D染色体组进行了准确鉴定。Tang 等[22]利用寡核苷酸探针Oligo-pSc119.2和Oligo-pTa535分别建立了小麦品种中国春和绵阳11的标准核型图。本研究采用FISH技术对材料进行分析,准确鉴定出每个材料的染色体组成:川麦62含有5BS·7BS和5BL·7BL易位染色体; 16EW458含有6VS·6AL、5BS·7BS和5BL·7BL易位染色体;16EW381含有6VS·6AL、5BS·7BS、5BL·7BL、3BS·5AS和3BL·5AL易位染色体。因此,在小麦多重易位染色体的聚合过程中,利用FISH技术辅助育种选择,确认被鉴定个体的染色体组成与结构变异, 可以实现早期定向选择,加快小麦多重易位系选育及新品种(系)培育进程。
3.2 多重易位系的应用价值
在小麦品种改良中,除了利用与其近缘种属的种间染色体易位外,小麦种内染色体相互易位的应用也较为成功,如5BS·7BS和5BL·7BL。研究发现,该双重易位的5BS染色体臂上含有条锈病成株抗性基因[13,29],Law等[13]认为,正是由于该抗性基因使得5BS·7BS和5BL·7BL易位染色体广泛存在于许多欧洲冬小麦品种中,如法国冬小麦品种Cappelle-Desprez。本研究的细胞学鉴定结果表明,川麦62是5BS·7BS和5BL·7BL双重易位系。根据来源,川麦62的选育杂交组合为Fr3/2*SW1862,其中,母本Fr3是引进的法国强冬性高抗条锈病优质材料,父本SW1862来源于自育选系。经细胞学鉴定结果表明,Fr3含有5BS·7BS和5BL·7BL易位染色体,而SW1862不含有该易位染色体,这说明川麦62中双重易位染色体来自于法国材料Fr3。因此,我们推测川麦62的条锈病抗性可能来自于5BS上的成株抗性基因。
由于簇毛麦6VS上携带有白粉病抗性基因 Pm21,自1995年以来, 6VS·6AL易位系在中国及其他23个国家中对已知的白粉病生理小种均表现免疫,在世界范围内广受小麦育种家的关注[30]。在中国,由于优良的白粉病抗性,6VS·6AL易位系作为亲本被广泛应用于小麦育种工程。据报道,6VS·6AL易位系品种在国内的种植面积已超过340万hm2[30]。本研究中,为了改良小麦品种川麦62高感白粉病的特性,利用川麦62与6VS·6AL易位系品种内麦8号杂交并回交,成功选育出了产量高于亲本川麦62且抗条锈病和白粉病的高代品系16EW381和16EW458。FISH分析发现,两个高代品系为多重易位系,不仅成功地引进了6VS·6AL易位染色体,使川麦62的白粉病抗性得到改良,同时也聚合了川麦62的5BS·7BS和5BL·7BL易位染色体。在高代品系16EW381中,还发现了3BS·5AS和3BL·5AL新易位染色体,我们认为该新易位的产生可能是6VS·6AL、5BS·7BS和5BL·7BL易位染色体聚合过程中诱导产生的,但诱导易位形成的机制有待于进一步研究。此外,3BS·5AS和3BL·5AL易位是否在抗性或农艺性状方面存在利用价值,能否如5BS·7BS和5BL·7BL易位一样被广泛应用也有待于进一步研究。
综上所述,多重易位系将不同类型的小麦易位染色体聚合到同一遗传背景培育,使优异基因得到累加和聚合,提高品种的抗性、增进小麦遗传变异是切实可行的,本研究将为今后的小麦育种及种质创新提供一个新的方向。
[1] BELAN I A,ROSSEEVA L P,TRUBACHEEVA N V,etal.Important agronomic traits of Omskaya 37 lines of spring wheat cultivar carrying wheat-rye translocation 1RS.1BL [J].RussianJournalofGenetics:AppliedResearch,2011,1(3):241.
[2] AN D G,ZHENG Q,ZHOU Y L,etal.Molecular cytogenetic characterization of a new wheat-rye 4R chromosome translocation line resistant to powdery mildew [J].ChromosomeResearch,2013,21(4):419.
[3] FU S L,REN Z L,CHEN X M,etal.New wheat-rye 5DS-4RS·4RL and 4RS-5DS·5DL translocation lines with powdery mildew resistance [J].JournalofPlantResearch,2014,127(6):743.
[4] ZHANG R Q,CAO Y P,WANG X E,etal.Development and characterization of aTriticumaestivum-H.villosaT5VS·5DL translocation line with soft grain texture [J].JournalofCerealScience,2010,51(2):220.
[5] ZHANG R Q,HOU F,FENG Y G,etal.Characterization of aTriticumaestivum-DasypyrumvillosumT2VS·2DL translocation line expressing a longer spike and more kernels traits [J].TheoreticalandAppliedGenetics,2015,128(12):2415.
[6] ZHAN H X,ZHANG X J,LI G R,etal.Molecular characterization of a new wheat-Thinopyrumintermediumtranslocation line with resistance to powdery mildew and stripe rust [J].InternationalJournalofMolecularSciences,2015,16(1):2162.
[7] 任正隆,张怀琼.小麦-黑麦染色体小片段易位的诱导[J].中国科学:C辑,1997,27(3):258.
REN Z L,ZHANG H Q.Induction of small-segment-translocation between wheat and rye chromosomes [J].ScienceinChina(SeriesC),1997,27(3):258.
[8] RABINOVICH S V.Importance of wheat-rye translocations for breeding modern cultivar ofTriticumaestivumL.[J].Euphytica,1998,100(1-3):323.
[9] 李桂萍,陈佩度,张守忠,等.小麦-簇毛麦6VS/6AL易位染色体对小麦农艺性状的影响[J].植物遗传资源学报,2011,12(5):744.
LI G P,CHEN P D,ZHANG S Z,etal.Effects of the 6VS/6AL translocation chromosome on agronomic characteristics of wheat [J].JournalofPlantGeneticResources,2011,12(5):744.
[10] 苏亚蕊,李玉阁,李锁平.小麦-黑麦1BL/1RS易位系在小麦育种中的应用及改良[J].河南农业科学,2006,35(3):12.
SU Y R,LI Y G,LI S P.Application and improvement of wheat-rye 1BL/1RS translocation line in wheat breeding [J].JournalofHenanAgriculturalSciences,2006,35(3):12.
[11] 何中虎,夏先春,陈新民,等.中国小麦育种进展与展望[J].作物学报,2011,37(2):202.
HE Z H,XIA X C,CHEN X M,etal.Progress of wheat breeding in China and the future perspective [J].ActaAgronomicaSinica,2011,37(2):202.
[12] 李 琼,王长有,刘新伦,等.小偃6号及其衍生品种(系)遗传多样性的SSR分析[J].麦类作物学报,2008,28(6):950.
LI Q,WANG C Y,LIU X L,etal.Genetic diversity of Xiaoyan 6 and its deritives by SSR [J].JournalofTriticeaeCrops,2008,28(6):950.
[13] LAW C N,WORLAND A J.The control of adult-plant resistance to yellow rust by the translocated chromosome 5BS-7BS of bread wheat [J].PlantBreeding,1997,116(1):59.
[14] BADAEVA E D,DEDKOVA O S,GAY G,etal.Chromosomal rearrangements in wheat:their types and distribution [J].Genome,2007,50(10):907.
[15] 亓增军.冬小麦种质“矮孟牛”的分子细胞遗传学研究[D].南京:南京农业大学,2000:2.
QI Z J.Molecular cytogenetic analysis of winter wheat germplasm Aimenniu [D].Nanjing:Nanjing Agricultural University,2010:2.
[16] 亓增军,刘大钧,陈佩度,等.冬小麦种质 “矮孟牛” 的分子细胞遗传学研究[J].植物学报(英文版),2001,43(5):469.
QI Z J,LIU D J,CHEN P D,etal.Molecular cytogenetic analysis of winter wheat germplasm Aimenniu [J].ActaBotanicaSinica(EnglishEdition),2001,43(5):469.
[17] 亓增军,刘大钧.利用染色体C-分带和双色荧光原位杂交技术鉴定普通小麦-黑麦-簇毛麦双重易位系1RS·1BL,6VS·6AL [J].遗传学报,2001,28(3):267.
QI Z J,LIU D J.Development and identification ofT.aestivum-S.cereal-H.villosadouble translocation line 1RS·1BL,6VS·6AL via chromosome C-banding and dual color FISH [J].ActaGeneticaSinica,2001,28(3):267.
[18] 王苏玲.普通小麦-簇毛麦-小伞山羊草双重易位系的筛选[D].南京:南京农业大学,2006:1.
WANG S L.Development and identifying ofT.aestivum-H.villosa-Ae.umbellulatadouble translocation line 6AL·6VS,6BS·6BL-6US [D].Nanjing:Nanjing Agricultural University,2006:1.
[19] BELAN I A,ROSSEEVA L P,ROSSEEV V M,etal.Study of adaptive and agronomic characters in lines of common wheat Omskaya 37 carrying 1RS·1BL and 7DL-7Ai translocations [J].RussianJournalofGenetics:AppliedResearch,2015,5(1):41.
[20] SHLEGEL R,WERNER T,HLGENHOF E.Confirmation of a 4BL/5RL wheat-rye chromosome translocation line in the wheat cultivar 'Viking' showing high copper efficiency [J].PlantBreeding,1991,107(3):226.
[21] HAN F P,LAMB J C,BIRCHLER J A.High frequency of centromere inactivation resulting in stable dicentric chromosomes of maize [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2006,103(9):3238.
[22] TANG Z X,YANG Z J,FU S L.Oligonucleotides replacing the roles of repetitive sequences pAs1,pSc119.2,pTa-535,pTa71,CCS1,and pAWRC.1 for FISH analysis [J].JournalofAppliedGenetics,2014,55(3):313.
[23] FU S L,CHEN L,WANG Y Y,etal.Oligonucleotide probes for ND-FISH analysis to identify rye and wheat chromosomes [J].ScientificReports,2015,5:10552.
[24] 任 勇,李生荣,周 强,等.134份四川小麦品种(系) 的条锈病抗性评价[J].麦类作物学报,2014,34(6):847.
REN Y,LI S R,ZHOU Q,etal.Evalution of resistance to stripe rust of 134 wheat cultivars and lines from Sichuan province [J].JournalofTriticeaeCrops,2014,34(6):847.
[25] 李艳丽,张 军,鲁 敏,等.67 份引进美国小麦种质材料的农艺性状调查和抗病性鉴定[J].麦类作物学报,2013,33(4):777.
LI Y L,ZHANG J,LU M,etal.Evaluation of agronomical characteristics and disease resistance in wheat germplasm introduced from American [J].JournalofTriticeaeCrops,2013,33(4):777.
[27] SEPSI A,MOLNR I,SZALAY D,etal.Characterization of a leaf rust-resistant wheat-Thinopyrumponticumpartial amphiploid BE-1,using sequential multicolor GISH and FISH [J].TheoreticalandAppliedGenetics,2008,116(6):825.
[28] KOMURO S,ENDO R,SHIKATA K,etal.Genomic and chromosomal distribution patterns of various repeated DNA sequences in wheat revealed by a fluorescenceinsituhybridization procedure [J].Genome,2013,56(3):131.
[29] AGENBAG G M,PRETORIUS Z A,BOYD L A,etal.Identification of adult plant resistance to stripe rust in the wheat cultivar Cappelle-Desprez [J].TheoreticalandAppliedGenetics,2012,125(1):109.
[30] CAO A Z,XING L P,WANG X Y,etal.Serine/threonine kinase geneStpk-V,a key member of powdery mildew resistance gene Pm21,confers powdery mildew resistance in wheat [J].ProceedingsoftheNationalAcademyofSciences,2011,108(19):7727.
