低温胁迫对不同类型茄子叶片耐寒性生理指标的影响
2018-03-28郭守鹏杨君娇徐佳宁王文军
郭守鹏,杨君娇,马 村,徐佳宁,王文军*
(1济南市农业科学研究院,山东济南 250316;2山东农业大学;3济南市农业开发服务总公司)
茄子(Solanum melongena L.)是一种喜温性的蔬菜,在我国各地广泛栽培,其生长发育适温为22~30℃,气温低于7℃,茎叶易受到伤害[1]。茄子冷害最明显的症状是生长速度变慢,叶片萎蔫、变褐、干枯,果皮变色,甚至整株死亡。在我国,冷害主要发生在早春和晚秋季节,严重时会造成茄子大幅减产,严重影响生产效益。目前,节能型日光温室和塑料大棚在北方地区已成为冬春反季节蔬菜生产的主要方式。然而,由于棚室结构一般比较简单,缺少加温设施,在冬春严寒季节,低温仍然是影响茄子生长、产量和品质的主要因素[2]。因此,对耐低温保护地茄子专用品种的需求越来越强烈。同时,茄子对低温胁迫的响应机制机理研究也日益受到科研工作者的重视。本试验主要通过对比分析不同类型茄子资源在不同低温胁迫条件下叶片中部分生理生化指标变化情况,筛选出较耐低温的茄子品种资源,为茄子低温反季节栽培及日光温室专用品种选育提供支持。
1 材料与方法
1.1 试验材料
本试验从已有茄子资源中选取6个不同类型的种质资源(详见表1),采用营养钵基质栽培,在苗龄6叶1心时转入光照培养箱进行低温胁迫处理。

表1 试验材料
1.2 试验设计
1.2.1光照设置:光照周期为 12 h/d,光照强度22000Lx[3]。
1.2.2 温度设置:对照为25℃处理24h,低温胁迫为4℃处理 2h、4h、6h 和 12h。
1.2.3 样品采集:每个处理随机选取长势一致的幼苗3株,每株取第4节位叶片,每个生理指标的测定重复3次。
1.3 测定项目及方法
本试验主要测定的生理指标与方法是:可溶性蛋白采用考马斯亮蓝法测定[3],可溶性还原糖采用蒽酮法测定[5],丙二醛(MDA)采用硫代巴比妥酸(TBA)比色法测定[4],超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光化还原法测定[3]。
1.4 数据处理
试验数据采用Microsoft Excel和IBM spss软件进行统计分析和作图。
2 结果与分析
2.1 低温胁迫对可溶性蛋白含量的影响
在自然界,蛋白质是一切生命活动的物质基础。植物在逆境条件下,由于可溶性蛋白质是一种亲水性较强的分子,能够使细胞束缚更多水分来阻止原生质的结冰,从而能够增强植物的抗寒能力[6]。由图1可知,正常温度下,不同茄子品种可溶性蛋白含量就存在较大差异;在低温 4℃处理时,原本含量高的品种(1、5、6)都出现了大幅下降,而原本含量低的(2、3、4)则都表现出增加;4℃处理2h时,各品种可溶性蛋白含量均下降,随着低温处理时间的延长,除6号外其他品种都表现为再增加又减少的变化趋势;3号和5号4h时可溶性蛋白含量达到顶峰;4号与2号茄子在6h时达到峰值,并高于对照数值。总体来看:2号、3号、4号对低温胁迫表现出更高的敏感性,其通过相关基因的表达,加快可溶性蛋白的合成,从而抵御低温对植株带来的不利影响;而1号、5号和6号茄子在低温胁迫时可溶性蛋白的合成受到抑制。

图1 低温胁迫对叶片中可溶性蛋白含量的影响
2.2 低温胁迫对SOD活性的影响
植物的抗寒性与活性氧代谢密切相关。低温胁迫下植物体内产生大量的活性氧自由基[7],而自由基的产生和消除又被细胞中的保护酶系统所控制,SOD作为重要的保护酶之一,能够清除逆境胁迫下产生的超氧自由基,生成歧化物,使植物表现出一定的抗逆性[8]。由图2可知,随着低温胁迫时间的延长,1号茄子SOD活性在不断缓慢增大,2号和5号先减小再增大又减小,3号、4号和6号则是先增大又减小又增大;各品种的峰值出现时间亦不同,1号和4号在低温处理12h时SOD活性表现为最大,2号和6号在6h时达到顶峰,5号SOD活性最大值出现在4h,3号则是2h。总体来看,在低温胁迫过程中,不同茄子品种叶片中SOD活性没有表现出一致的变化趋势,反而是不同类型的品种SOD活性变化差异较大;除2号以外,其余品种在4℃低温胁迫时SOD活性都在一定时间段高于对照,说明保护酶系统被激活。
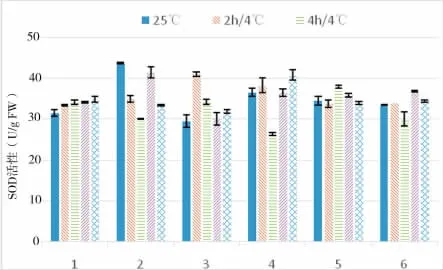
图2 低温胁迫对超氧化物歧化酶(SOD)活性的影响
2.3 低温胁迫对MDA含量的影响
在低温胁迫下,植物体内膜脂过氧化作用加强,导致膜的损伤和破坏[9]。丙二醛(MDA)是膜脂过氧化反应最重要的产物之一,细胞中MDA含量的高低反映了细胞氧化损伤的程度,其含量与植物耐寒性呈负相关。由图3可以看出:在低温处理下,1号、2号、4号和6号MDA含量先增加后减少再增加,3号是先减少再增加又减少,5号则是先减少又增加;除5号以外,其余品种MDA含量峰值都明显高于25℃对照,以3号4℃处理6h含量最高,其次为4号4℃处理6h;1号、5号和6号品种的整体MDA含量较少。不同类型的茄子品种在低温胁迫下MDA的含量同样没有表现出一致的规律性。

图3 低温胁迫对丙二醛(MDA)影响
2.4 低温胁迫对可溶性糖含量的影响
在植物体内,可溶性糖是植物抗冻的主要保护性物质。可溶性糖具有提高细胞液浓度,调节细胞渗透压,增强植物耐寒性的作用[10]。在低温胁迫下,植物体内水解作用增强,一些多糖、蛋白质等大分子物质降解生成可溶性糖、氨基酸等物质,使得细胞液浓度增大、冰点下降[11]。由图4可知:在4℃低温胁迫下,不同类型的茄子品种可溶性糖含量变化表现出较高的规律性。随着低温处理时间的延长,基本都表现出先增加又减少的趋势。大部分品种都在6h时达到峰值,12h时为底值。只有个别品种表现出差异性,如1号2h时可溶性糖含量略高于6h,2号2h和4h出现了下降,3号12h时仍高于对照。从平均水平来看,4号可溶性糖含量最高,2号最低。从变化幅度来看,4号最大,6号最小。这说明:大部分茄子品种会在短时间内通过快速增加可溶性糖含量来抵御低温胁迫,从而降低低温对植株造成的不利影响;在低温胁迫达到一定时间后,或者因为新陈代谢的降低,或者因为植株对低温的适应,又恢复到或低于原来的含量水平。
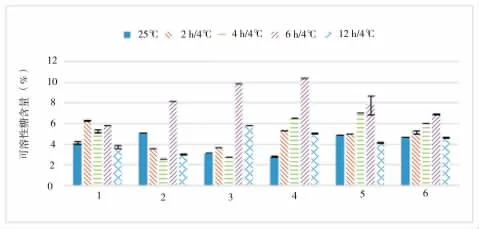
图4 低温胁迫对可溶性糖含量的影响
3 讨论与结论
可溶性蛋白、可溶性糖、超氧化物歧化酶(SOD)和丙二醛(MDA)等物质的含量和活性是判定植物耐寒性强弱的重要生理生化指标。其中,前三者主要是起保护作用,使植物组织免受低温伤害;MDA则是反应植株受冻害严重程度的重要标志物。本试验结果显示:在遭遇低温的情况下,茄子叶片中的可溶性蛋白含量和SOD活性增加幅度很低,甚至大幅下降;而可溶性糖的含量则是大幅上升。从中可见,可溶性蛋白、可溶性糖和SOD对茄子耐寒性的贡献率是不同的,可溶性糖贡献率最高,可溶性蛋白和SOD贡献率较低。这一现象也说明:在茄子对抗低温胁迫的生理生化调控中,不同的调控机制和调控物质并没有同时被激活,有些调控机制还被抑制;有些调控机制则被快速激活,相关基因大量表达,相应的活性物质被大量释放。
由试验结果还发现:不同类型的茄子品种抗逆调控物质并没有表现出相同的变化趋势,反而是有很大的差异。1号尖头紫茄子和6号灯泡绿茄子可溶性蛋白含量大幅下降,SOD活性则略微上升,可溶性糖增加幅度不大,MDA的含量同样具有很大的相似性,说明这两个类型的茄子品种抗低温调控机制相似;3号紫长茄和4号紫圆茄可溶性蛋白和可溶性糖含量及SOD活性变化趋势一致,MDA含量2h和6h分别高于4h和12h,说明这两个类型的茄子具有相似的抗低温调控机制;2号棒状紫茄子和5号绿萼紫茄子又分别表现出不同的调控机理。
不同类型的茄子对低温胁迫的调控机制不同,外在表现就是不同的品种抗寒性不同。在生产实践中,国外进口的绿萼紫茄品种具有较强的耐低温弱光能力。因此,目前我国北方日光温室茄子生产主要使用的品种即为绿萼紫长茄类型,紫萼长茄和紫圆茄尚没有选育出优势品种,不过在早春和秋延迟中也有种植;尖头茄和绿茄属于特种茄子,市场小,栽培面积小,主要分布于露地和现代农业园区;紫线茄主要在南方栽培。综合分析4个生理指标,我们得出:本试验中的茄子品种以3号耐寒性最差,主要表现在可溶性蛋白和SOD酶活都处于较低水平、可溶性糖和MDA含量迅速升高,说明其对低温反应缓慢、组织和细胞受到破坏;5号耐寒性最好,其可溶性糖处于中等水平,酶活较高,MDA变化不大且含量较低,说明其本身耐寒性较好,并且防御机制反应迅速;2号和4号耐寒性高于1号和6号、低于5号。按照类型排序为:绿萼紫茄>紫长茄=紫圆茄>尖头紫茄=绿茄>紫线茄。
本研究得出的结论与生产实践基本一致,说明可溶性蛋白、可溶性糖、超氧化物歧化酶(SOD)和丙二醛(MDA)可以作为评判茄子耐寒性强弱的检测指标。这对今后茄子低温反季节种植的品种选择和抗逆育种提供了重要的手段和理论依据。
[1]李建设,耿广东,程智慧.低温胁迫对茄子幼苗抗寒性生理生化指标的影响[J].西北农林科技大学学报(自然科学版),2003,31(1):90-96.
[2]张素勤,程智慧,耿广东.低温胁迫对茄子幼苗生理特性的影响[J].湖南农业大学学报,2006,32(4):393-396.
[3]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[4]郝再斌,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:115-116.
[5]李合生.植物生理生化实验原理及技术[M].北京:高等教育出版社,2000.
[6]CAO X Q.The effect of membrane-lipid peroxidation on cell and body[J].ProgBiochemBiophys,1986(2):17-23.
[7]沙伟,刘焕婷,谭大海,等.低温胁迫对扎龙芦苇SOD、POD活性和可溶性蛋白含量的影响[J].齐齐哈尔大学学报,2008,24(2):1-4.
[8]王建华,刘鸿先,徐同.超氧物歧化酶(SOD)在植物逆境和衰老生理中的作用[J].植物生理学通讯,1989(1):1-7.
[9]zlemA,zdemirN,GünenY.Effect on grafting on watermelon plant growth,yield and quality[J].Agronomy,2007(6):362-365.
[10]金光,孙玉宏,师瑞红,等.10℃低温对西瓜幼苗耐性生理指标的影响[J].安徽农学通报,2006,12(10):42-45.
[11]利容千,王建波.植物逆境细胞及生理学[M].武汉:武汉大学出版社,2002.
