小黑麦不同品种劣变种子的胚培养效果研究
2018-03-27田新会杜文华
李 雪,田新会,杜文华
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
小黑麦(Triticalewittmack)为禾本科一年生草本植物,由小麦(Triticum)和黑麦(Secale)经属间有性杂交和杂种染色体加倍而成的新物种,不仅表现了小麦的丰产性和籽粒的优良品质,又保持了黑麦抗逆性强和赖氨酸含量高的特点,是一种很有前途的粮饲兼用型作物[1-3]。
种子的劣变是指因种子生存能力降低、导致种子丧失生活力和萌发力的不可逆转变化,是伴随着种子贮藏时间延长而发生的、不可避免的过程[4]。在劣变过程中种子内部发生一系列生理生化变化,种子的各种功能和结构受到损害[5-7],其损害程度随时间延长而逐渐加剧,从而导致种子质量下降,种子活力下降,甚至丧失生活力[8-9]。这主要是因为,虽然胚具有活力,但胚乳丧失了为胚萌发提供营养物质的能力,从而使胚由于缺乏营养而失去活力[10]。
植物胚是一个具有全能性的多细胞结构,通常能够正常发育成熟,而且可以直接播种形成完整植株。通过离体胚培养,使可能败育或退化的胚获得再生植株,在植物育种中具有十分重要的理论与实践意义[11-12]。
胚培养可以追溯到18 世纪,Charles Bonnet分离并培养了菜豆和荞麦的胚并获得了植株[13-14]。较为系统的胚挽救技术开始于20 世纪初,目前胚挽救技术已被广泛地应用于小麦[15]、大麦[16-17]、水稻[18]、茄子[19]、油菜[20]、百合[21]、以及众多果树如桃[22]、葡萄[23-24]、樱桃[25]、苹果[26]、柿[27]、李[28]、柑橘[29-30]等。Sirkka等最早进行小黑麦胚挽救技术研究[31]。目前国内外对小黑麦劣变种子胚挽救技术研究较少。为提高劣变种子的利用率和挽救种质资源,试验以10份澳大利亚小黑麦品种的劣变种子为试材,在体外进行胚培养,以比较各品种的胚发育率、胚萌发率和成苗率,为小黑麦种质资源挽救提供技术支持。
1 材料与方法
1.1 供试材料
供试材料为引自澳大利亚10个小黑麦品种(Cherokee,While M96-3182-1,33rd ITSN,DH265,AT315,Rhino,AT574,AT528,32rd ITSN,2090White)的劣变程度相同的种子。对照为甘肃农业大学草业学院培育的小黑麦新品系C24(CK1)和C31(CK2),在室温条件下保存一年的种子。
1.2 培养基
1/2MS+2%蔗糖+0.1%麦芽糖+0.5%琼脂, pH 5.8,于121℃高压灭菌20 min。
1.3 种子消毒及接种
先将参试材料的种子冲洗干净,用次氯酸钠消毒5~10 min,再用蒸馏水冲洗干净。将冲洗干净的种子浸泡在蒸馏水中,放置4℃冰箱24 h。
将浸泡的种子在无菌操作台用次氯酸钠消毒5~10 min,无菌水冲洗干净并用无菌滤纸将种子干燥。用镊子将种皮剥除,然后将胚从胚和胚乳连接处切出,完整的胚盾片向上接种到培养基中。
1.4 培养及转接
将接种好的胚放置于17℃、光照16 h、黑暗8 h的培养箱中进行培养。当胚发芽至3片叶时,转移到花盆。
1.5 试验设计
将引自澳大利亚10个劣变小黑麦品种(Cherokee,While M96-3182-1,33rd ITSN,DH265,AT315,Rhino,AT574,AT528,32rd ITSN,2090White)和对照材料经种子消毒及接种后在培养箱中培养,每个处理设3次重复,每天定时进行观察,每隔5 d统计小黑麦的胚发育率、成苗率,直至小黑麦的胚发育率、成苗率不在变化。
1.6 测定指标及方法
接种的胚长出绿芽或须根时为胚发育,胚发育率为发育胚数占接种胚珠数的百分率[32]。
胚发育率(%)=胚发育数/接种胚数×100%
成苗率为正常苗数占接种胚珠数的百分率。正常苗为具有正常的根、茎和叶等器官的植株[32]。
成苗率(%)=成苗数/接种胚数×100%
1.7 数据分析
用SPSS19.0软件中二因素随机区组试验设计的统计方法,分别分析不同小黑麦材料间、培养时间间和品种×培养时间交互作用间胚发育率、胚萌发率和成苗率方差的差异显著性,进行方差分析时将胚发育率和成苗率进行数据转換(反正弦转換)。如果差异显著,用Duncan法进行多重比较。对小黑麦的胚发育率和成苗率进行相关性分析。用Excel进行数据整理和作图。
2 结果与分析
小黑麦材料间,诱导培养天数间以及小黑麦材料间×诱导培养天数交互间的胚发育率和成苗率存在极显著差异(P<0.01),需进行多重比较(表1)。
2.1 胚发育率
2.1.1 小黑麦材料间胚发育率的差异 参试的12份小黑麦材料中,2个对照的胚发育率相近,显著高于其余材料;Cherokee和DH265的胚发育率显著高于其余参试材料;小黑麦材料2090White、AT528、While M96-3182-1、AT574和AT315的胚发育率依次降低,且有显著差异;33rd ITSN和、32rd ITSN和Rhino的胚发育率为0(表2)。
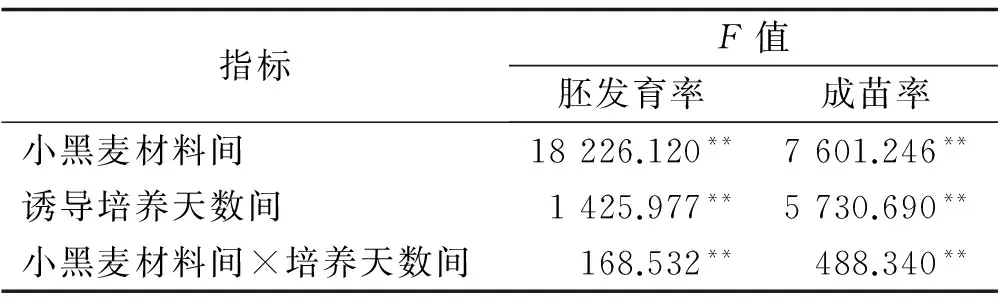
表1 小黑麦胚发育率和出苗率的方差结果分析
注:**达到极显著水平(P<0.01),下同

表2 小黑麦材料间胚发育率和成苗率的差异
注:同列不同小写字母表示差异显著(P<0.05),下同
2.1.2 培养天数间胚发育率的差异 由于小黑麦品种33rd ITSN、32rd ITSN和Rhino的胚发育率为0,所以从培养天数间胚发育率差异的影响中去除。随着培养天数增加,小黑麦胚的发育率逐渐增加(表3)。0~7 d时,小黑麦材料的胚发育率显著低于其他培养天数;7~12 d时,胚发育率增加较快,增加率为25.4%;随着诱导培养时间的继续延长,胚发育率增加幅度减缓,27 d和32 d时,胚发育率无显著差异。

表3 诱导培养天数间胚发育率和成苗率的差异
2.1.3 小黑麦材料×培养天数交互作用间胚发育率的差异 CK1和CK2的胚发育率在诱导培养12 d时已经完全发育,显著高于其余小黑麦材料。随着诱导培养天数增加,各参试小黑麦材料胚发育率的变化有差异,Cherokee诱导培养7 d的胚发育率较低,为57.65%,随着诱导天数增加,胚发育率逐渐增加,27、32 d时胚发育率显著增加;DH265诱导培养7 d的胚发育率较高(83.33%),胚发育率随着诱导天数的增加而缓慢增加,22 d时胚发育率显著增加,27,32 d时胚发育率还在增加,但无显著差异;2090White诱导培养7 d时,胚发育率较低(31.18%),12、17、22 d时胚发育率增加速度较快,差异显著(P<0.05),27、32 d的增加缓慢,无显著差异(P>0.05);AT528的胚发育率在诱导培养7 d时胚发育率为56.67%,12 d时胚发育率显著增加,诱导培养12、17、22、27 d胚发育率增加缓慢,无显著差异。AT315在诱导培养7 d时,胚发育率较低(5%),12,17 d胚发育率显著增加,17 d较12 d高118.95%,27,32 d胚发育率显著增加;While M96-3182-1诱导培养7 d时胚发育为11.76%,12、17、22、27 d胚发育率增加,均差异显著,27 d和35 d胚发育率无显著差异。AT574诱导培养7 d时胚发育率为0,诱导培养12 d胚发育率为25.56%,诱导培养17,22和27 d胚发育率显著增加,诱导培养35 d胚发育率增加缓慢,无显著差异(图1)。

图1 小黑麦材料×培养天数交互作用下的胚发育率Fig.1 Triticale materials×days of inducting culture of difference embryo development rate between interaction注:柱形图间不同字母表示差异显著(P<0.05)。下同
2.2 成苗率
2.2.1 小黑麦材料间成苗率的差异 对照材料的成苗率显著(P<0.05)高于其余材料。参试小黑麦材料劣变种子的成苗率为8.23%~57.16%,Cherokee的成苗率最高,为57.16%,显著高于其余参试小黑麦材料;DH265次之,其成苗率显著高于除CK1、CK2和Cherokee之外的其他材料;2090White和AT528的胚成苗率相近,居第3位;其余材料的胚成苗率较低(表2)。
2.2.2 诱导培养天数间成苗率的差异 诱导培养7 d时,小黑麦材料的成苗率为0。随着诱导培养天数增加,成苗率逐渐增加,除27 d和32 d间小黑麦材料的成苗率无显著差异外,其余天数间的胚成苗率均有显著差异(P<0.05)。诱导培养17 d时,小黑麦成苗率比12 d高67.18%,22 d的成苗率比17 d高18.90%,27 d的成苗率比22 d高7.65%;诱导培养时间27 d后,随着培养时间延长,成苗率增加缓慢(表3)。
2.2.3 小黑麦材料×培养天数交互作用间成苗率的差异 CK1和CK2在诱导培养12 d时已经全部成苗,其成苗率显著(P<0.05)高于其余小黑麦材料。参试的小黑麦材料在诱导培养7 d时成苗率均为0。Cherokee诱导培养12 d时成苗率较低(6.47%),诱导培养17 d时成苗率显著增加,但诱导培养22,27和32 d增加缓慢,差异不显著;DH265在诱导培养12 d时成苗率为0,诱导培养17、22 d成苗率显著增加,27、35 d成苗率增加缓慢,无显著差异;2090White的成苗率在诱导培养12,17和22 d成苗率显著增加,27、35 d成苗率增加缓慢,差异不显著;AT528诱导培养12 d的成苗率较高(40.67%),17 d成苗率显著增加,22,27和35 d的成苗率增加缓慢,差异不显著;AT315在诱导培养12 d时成苗率为0,17、22 d成苗率显著增加,27、35 d成苗率无差异显著性;While M96-3182-1诱导培养12 d时成苗率为6.62%,诱导培养17 d成苗率显著增加,高于241.24%,22 d时成苗率显著增加,27、35 d成苗率增加差异不显著;AT574诱导培养12 d、17 d成苗率为0,诱导培养22,27和35 d成苗率增加,但无差异显著(图2)。

图2 小黑麦材料×培养天数交互作用的成苗率Fig.2 Triticale materials×days of inducting culture of difference seedling rate among interaction
2.3 胚发育率和成苗率的相关性分析
小黑麦材料的胚发育率和成苗率相关性分析(表4)表明,小黑麦的胚发育率和成苗率呈极显著正相关(R=0.97)。

表4 胚发育率和成苗率的相关性分析
2.4 再生苗移栽的幼苗成活率、株高和叶片数
对照CK1和CK2的成活率最高,显著高于其他参试小黑麦材料。劣变的种子胚成活率为9.55%~69.42%,且不同品种差异显著,其中Cherokee成活率最高,其次为DH265,AT315的成活率最低(表5)。
对照CK1和CK2的平均株高最高,显著高于其余参试小黑麦材料。AT528平均株高较高,为16.40 cm,和CK2无显著差异,其次为Cherokee,While和M96-3182-1,AT574的平均株高最低。
小黑麦品种AT528的平均叶片数最高,显著高于其余参试小黑麦材料;其次为CK1、Cherokee和AT315,3品种的平均叶片数无显著差异;AT574的平均叶片数最少,除与2090White无显著差异外,显著低于其余参试小黑麦。
3 讨论
贮藏时间对种子的萌发具有较大的影响。张东晖等[33]研究表明,随贮藏时间延长,种子劣变加剧,但有一定的安全贮藏期。贮藏14年丧失活力,贮藏7~8年失去种用价值,贮藏6年活力骤然下降,不宜作为播种用,贮藏4年保持较高的活力,适当可作播种用,也可作为种质资源保存期延长至6年,贮藏2~3年活力表现最强,说明其种用价值最佳。试验选用不同程度劣变种子进行研究,表明正常的种子胚的发育率和成苗率较高,并且由于劣变种子的劣变程度不同,其发育率和成苗率各异,发育率由高到低依次为:CK2>CK1>DH265>Cherokee>2090White>AT528>WhileM96-3182-1> AT754>AT315,成苗率依次为:CK2>CK1>Cherokee>DH265>2090White>AT528>WhileM96-3182-1> AT754>AT315。从而说明DH265和Cherokee的劣变程度较轻,2090White和AT528居中,其余3个材料种子的劣变程度较重,而33rd ITSN,32rd ITSN和Rhino小黑麦种子已经丧失了活力。和张东晖等[33]的研究结果类似。不同植物种类或品种胚培养存在较大差异。傅雪琳等[34]研究发现,成熟稻材料间胚愈伤组织诱导率、质地结构和绿苗再生率有显著差异。王丹菲等[35]用不同百合品种杂交获得的幼胚为外植体,进行离体胚培养发现,不同杂交组合的胚发育率差异较大。试验材料DH265和Cherokee的劣变程度较轻,但2个材料间的胚发育率和成苗率还有显著差异。由于成苗率和胚发育率极显著正相关,所以对其差异原因没有单独列出。
胚培养时间对胚挽救具有重要作用,张月琴等[36]研究表明,小麦成熟胚培养12 d就可以达到理想的分化效果,唐冬梅等[37]研究表明,无核葡萄不同基因型的胚培养时间不同。试验结果表明,随着诱导天数增加,参试小黑麦材料的胚发育率逐渐增加。诱导培养7~12 d时胚发育率和成苗率增加幅度较大,诱导培养27 d和32 d时小黑麦材料的胚发育率和成苗率无显著差异,说明小黑麦胚培养的适宜诱导培养时间为27 d。
由小黑麦材料×诱导培养天数间的胚发育率和成苗率差异可知,CK1和CK2的胚发育率和成苗率在诱导培养12 d时,均达100%,但劣变小黑麦材料种子在诱导培养27 d时,胚发育率仍没有达到100%,表明种子劣变对胚萌发有很大影响。参试的每种小黑麦材料的胚发育率和成苗率随着时间的增加而增加,但增加的速度不同。材料Cherokee的胚发育率在7~12 d时增加较快,而2090White在17~22 d增加快,AT315和WhileM96-3182-1随着时间的增加呈阶梯式增加,其余材料的胚发育率显著增加,但幅度不大。小黑麦材料2090White和AT528的成苗率在7-12 d时增加幅度较大,Cherokee和DH265在12-17d时增加快,其余材料增加匀速增加。赵占军等[38]研究胚龄对小麦幼胚组织培养效果中表明,幼胚组织培养最适宜的胚龄为14~16 d。孙苏阳等[39]研究表明,小麦胚龄为16 d 时,其萌发率和成苗率较高,是较为合适的幼胚培养时期。材料33rd ITSN,32rd ITSN,Rhino随着诱导培养时间的增加而无变化,可能由于其种子劣变时间较长,而失去活力。
4 结论
小黑麦材料间胚发育率由高到低依次为:CK2>CK1>DH265>Cherokee>2090White>AT528> WhileM96-3182-1>AT754>AT315,成苗率的顺序为:CK2>CK1>Cherokee>DH265>2090White>AT528> WhileM96-3182-1>AT754>AT315;小黑麦品种33rd ITSN、32rd ITSN和Rhino的胚发育率和成苗率均为0,完全失活;对劣变小黑麦的种子没丧失活力的胚进行培养,最适宜的时间为27 d。
[1] 杨蕊菊.小黑麦抗旱生态适应性研究[D].兰州:甘肃农业大学,2003.
[2] 张微,李春艳,曹连莆,等.春性小黑麦材料抗旱性的比较研究[J].石河子大学学报(自然科学版),2009(5):529-535.
[3] 李冬梅,田新会,杜文华.饲草型小黑麦新品系在甘肃临洮灌区的生产性能研究[J].草原与草坪,2016(5):76-81.
[4] Anderson J D.Metabolic changes as sociated with senscence[J].Seed Science and Technology,1973,1:401-416.
[5] 董新红,宋明.种子劣变的原因及其防止与修复[J].中国种业,2002(1):39-40.
[6] 王彦荣,刘友良,沈益新.种子劣变的生理学研究进展综述[J].草地学报,2001(3):159-164.
[7] 李青丰,易津,房丽宁,等.种子的劣变及劣变原因的研究[J].内蒙古农牧学院学报,1996(2):59-65.
[8] 韩建国,浦心春,毛培胜.高羊茅种子老化过程中酶活性的变化[J].草地学报,1998(2):84-89.
[9] 陈润政,周晓强,傅家瑞.不同贮藏湿度对红麻种子活力一些生理生化变化的影响[J].种子,1989(3):5-7.
[10] Bhaltacharrya S,Hazra A K,Sen Mandi S.Accelerated aging of seeds in hot water:germination characteristic-ccs of aged wheat seeds[J].Seed science and technology,1985,13(3):683-690.
[11] Gray D J,Fisher L C,Mortensen J A.Comparison of methodologies for inovule embryo rescue of seedless grapes[J].Hort Science,1987,22(6):1334-1335.
[12] Gray D J,Mortensen J A,Betten C.Ovule culture to obtain progeny fromhybrid seedless bunch grapes[J].J Amer Soc Hort Sci,1990,115(6):1019-1024.
[13] 陈香波,曹孜义.离体葡萄未成熟胚成苗途径研究[J].果树科学,2000(4):261-264.
[14] 董晓玲.无核葡萄杨格尔的胚发育及胚珠培养[C]∥葡萄研究论文选集,2003(3):39-41.
[15] 邓光兵,马欣荣,张小萍,等.Phlb基因在普通小麦与簇毛麦杂种F1中的作用[J].应用与环境生物学报,1998(3):211-215.
[16] 李璋,刘翠云,阎正录,等.普通小麦×栽培大麦杂种植株及其回交后代的产生和鉴定[J].遗传学报,1987(3):188-192.
[17] Xia G M,Xiang F N,Zhou A F.Asymmetric somatic hybridizationbetween wheat (TriticumaestivumL.)andAgropyronelongatum(Host)Nevishi[J].Theor Appl Genet,2003,107:299-305 .
[18] 迟全勃,Prapa Sripichitt,许红春.通过胚胎拯救将野生稻耐旱特性转移到栽培稻进行远缘杂交初探[J].中国农学通报,2005(10):368-372.
[19] Buitendijk J H,Pinsonneaux N .Embryo rescue by half -ovule culturefor the production of interspecific hybrids in Alstroemeria[J].Scientia Horti culrurae,1995,64:65-75 .
[20] 王爱云,李栒,胡大有.生物技术在油菜种质创新中的应用[J].生命科学研究,2006(1):18-23.
[21] 杨利平,丁冰.百合种间远缘杂交种的育成[J].河北林果研究,1998(3):16-20.
[22] 庄恩及,姚强,吴钰良,等.早熟和特早熟桃胚珠培养研究[J].园艺学报,1991(4):303-308.
[23] 潘春云,亓桂梅,汤小宁,等.葡萄三倍体育种初报[J].山东农业大学学报,1998(3):25-28.
[24] 徐海英,阎爱玲,张国军.葡萄二倍体与四倍体材料间杂交胚珠的离体培养[J].果树学报,2001(6):317-320.
[25] Mu S K,Lena G.Rescue of hybrid embryos of Actinidia species[J].ScientiaHorticulturae,1990,44:97 -10 .
[26] Ramming D W.The use of embryos culture in fruit bre-eding[J].Hort-Science,1990,25(4):393-398 .
[27] 谷晓峰,唐仙英,罗正荣.罗田甜柿幼胚培养条件的研究[J].果树学报,2001(2):80-83.
[28] 刘用生,殷桂琴,汪涛.GA、6-BA、IBA与活性炭对李胚萌发及幼苗生长影响[J].植物生理学通讯,1993(1):32-34.
[29] 裘文达.园艺植物组织培养[M].上海:上海科技出版社,1986:195-197.
[30] 伊华林,邓秀新.培养三倍体柑桔植株的研究[J].果树科学,1998(3):212-216.
[31] Fan Chuanzhu,Ma Yuansheng.Rescue and Characterization of Aged Seeds by Embryocultur-e[J].Biotechnology in Agriculture,1993(15):296-299.
[32] 王爱玲,王跃进,唐冬梅,等.提高无核葡萄胚挽救中幼胚成苗率的研究[J].中国农业科学,2010(20):4238-4245.
[33] 张东晖,云锦凤,石凤敏,等.不同贮藏时间披碱草种子劣变及活力测定[J].草业科学,2008(4):116-118.
[34] 傅雪琳,卢永根,刘向东,等.几个水稻粳型亲籼系成熟胚离体培养研究初报[J].上海交通大学学报(农业科学版),2006(3):230-234.
[35] 王丹菲,代汉萍,雷家军.百合种间杂种胚离体培养研究[J].北方园艺,2006(4):157-159.
[36] 张月琴,陈耀锋,王丽,等.小麦成熟胚培养条件的优化及高效基因型筛选[J].干旱地区农业研究,2014(5):100-105.
[37] 唐冬梅,蔡军社,骆强伟,等.用于无核葡萄选育的胚挽救技术研究[J].果树学报,2008(3):316-321.
[38] 赵占军,陈茂盛,王贵娟.胚龄和激素对小麦幼胚组织培养的影响[J].生物技术,2003(5):7-8.
[39] 孙苏阳,王永军,李海军,等.胚龄、激素对小麦单倍体萌发率及成苗率的影响[J].江苏农业学报,2013(3):679-681.
