不同盐浓度下AM真菌和禾草内生真菌对多年生黑麦草生长的影响
2018-03-27闫智臣李应德程维佳郭艳娥段廷玉
闫智臣,李应德,程维佳,高 萍,郭艳娥,段廷玉
(草地农业生态系统国家重点实验室,农业部草牧业创新重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
多年生黑麦草(Loliumperenne)是禾本科黑麦草属多年生植物,属于冷季型禾本科牧草,原产欧洲、亚洲温带和北非,因其营养丰富,生物产量高,可消化性高,适口性好,并具有良好的抗寒能力、不易倒伏、发芽快、再生迅速的特性而被广泛种植,为我国最重要的冷季牧草之一,亦是主要的草坪草种,是牛、羊、兔、鹅等草食畜禽的优质青饲料,还可用作猪、鱼等的青饲料[1],是人工栽培草地和天然草地改良的重要草种。
土壤盐碱化是世界性的难题,全球盐渍化土壤约有8.31亿hm2,我国盐渍土地总面积近1亿hm2[2]。草地盐渍化是由于不合理利用使得草地土壤发生次生盐渍化,导致草地退化[3],土壤中过量的盐分对植物造成离子毒害和渗透胁迫等危害[4],从而降低种子发芽率,抑制幼苗生长[5],影响农业生产和生态环境。不论是天然草地还是栽培草地都遭受着盐渍化带来的威胁和挑战,如何开发利用盐渍化土地具有重要的现实意义。
真菌和植物的共生体在自然界中普遍存在,并且大多数禾草体内存在多种共生真菌。禾草内生真菌(grass endophyte)和丛枝菌根(arbuscular mycorrhiza,AM)真菌是两类重要的草地植物共生真菌[6]。禾草内生真菌是指在禾草中渡过全部或大部分生命周期,而禾草不显示外部症状的一大类真菌[7],主要为香柱菌属(Epichloe)的真菌。禾草内生真菌普遍存在并具有多样性,在天然草地和人工草地的禾草中均有广泛分布[8]。已经在很多冷季型禾草中发现禾草内生真菌,这些内生真菌赋予了宿主植物很强的竞争能力,提高了寄主植物对各种生物胁迫和非生物胁迫的耐受性[9]。AM真菌是一类可侵染植物的根系,与宿主植物根部形成互惠共生结构的菌根真菌,是最主要的植物土壤根系微生物之一,在生态系统中发挥着重要的作用[10]。它可以增加宿主植物对土壤中营养元素特别是氮、磷的吸收,还可以促进水分吸收利用、碳水化合物代谢,提高光合速率,且可提高茶树[11]、棉花[12]等植物的耐盐性。
近年来,有关AM真菌和禾草内生真菌对植株耐盐性影响的研究时有报道,2016年刘洪光[13]对AM真菌提高枸杞耐盐性的机制进行了研究,结果表明,在盐胁迫条件下接种AM真菌能显著提高枸杞的光合速率、蒸腾速率、实际光化学效率、光化学猝灭系数及非光化学猝灭系数,有效保护枸杞叶细胞结构,显著改善枸杞叶的营养成分;同年张义飞[14]发现在高盐胁迫下,AM真菌既促进羊草对营养元素的吸收,又减少了离子毒害,显著降低了盐胁迫效应,提高了羊草生物量,菌根效应明显;2017年贾婷婷[15]研究了盐胁迫下AM真菌对沙枣苗木光合与叶绿素荧光特性的影响,发现AM真菌能够通过改善沙枣的光合特性和叶绿素荧光特性缓解盐胁迫对其的伤害,有利于其在盐胁迫下生长。宋梅玲[16]在2015年研究了野大麦内生真菌共生体耐盐性的生理机制,结果表明内生真菌显著提高了盐胁迫下野大麦的发芽率、发芽指数以及根苗长,促进了SOD、POD和CAT抗氧化酶的活性;陈水红等[17]也在2017年对内生真菌提高禾草抗盐碱性研究进展进行了系统评述。但有关AM真菌和禾草内生真菌对牧草耐盐性的影响的研究却相对较少,尤其是两类共生微生物互作对植物耐盐性的影响更少,鉴于此,在温室条件下,研究了土壤接种AM真菌摩西球囊霉(Glomusmosseae),禾草内生真菌与AM真菌对多年生黑麦草生长和耐盐性的影响,为进一步利用两类共生微生物提高植物耐盐性,促进植物生长提供理论依据。
1 材料和方法
1.1 供试材料
1.1.1 供试植物和菌种 供试草种为带有禾草内生真菌(E+)和不带禾草内生真菌(E-)的多年生黑麦草种子,由新西兰国家草地研究所(AgResearch)提供。
供试AM真菌菌剂:摩西球囊霉。购买于北京市农林科学研究院植物营养与资源研究所,中国丛枝菌根真菌菌种资源保藏中心,经白三叶(Trifoliumrepens)扩繁所得,扩繁时将140 g含接种物(包括自然干燥的菌根菌侵染的植物根段丛枝菌根菌的孢子和菌丝体)的土壤和1 260 g灭菌的土壤-沙子混合。每盆移栽5株白三叶幼苗,生长2周后,每盆每星期加10 mL Long Asthton营养液(Long Ashton营养液组成及含量:2 mmol/L K2SO4,1.5 mmol/L MgSO4·7H2O,3 mmol/L CaCl2·2H2O,0.1 mmol/L FeEDTA,4 mmol/L (NH4)2SO4,8 mmol/L NaNO3)。当孢子数达到100个/g土壤时,停止浇水和营养液,置于温室干燥3~4星期,存于实验室待用。
1.1.2 供试土壤 试验用土由3部分组成,黄土,取自兰州大学榆中校区田间试验地,黑土和沙土购自兰州花市。所有组分过2 mm筛后,于121℃高压灭菌2次,每次灭菌1 h,间隔24 h。再将黑土∶黄土∶沙土以1∶1∶2混合。混合土壤基质pH 6.87。
1.2 试验设计
AM真菌处理:24盆接种上述扩繁的摩西球囊霉,接种量为每盆20 g摩西球囊霉菌剂,接种菌剂为含有孢子、菌丝的土壤及其寄主植物的根段混合物(AM处理);另24盆加入20 g灭菌的土壤基质作为对照(NM处理)。菌根接种剂以层播的方法接种,每盆先加入1 000 g土壤基质,后准确称取20 g菌剂均匀平铺于土壤上,之后再加入180 g土壤基质覆盖在菌剂上面,每盆共1 200 g,NM处理则用土壤基质代替菌剂即可。
禾草内生真菌处理:上述AM、NM处理土壤,各12盆移栽催芽处理的E+、E-种子,每盆移栽6株,出苗7 d后,选长势一致的植株保留4株。
催芽方法如下,将黑麦草种子用10%(质量分数)的H2O2浸泡10 min,而后用无菌水(高压72灭菌锅121℃下灭菌20 min)清洗3遍,将种子摆放于含有湿滤纸的培养皿内(直径9 cm),100粒/皿,置于25℃恒温培养箱培养48 h。
盐处理:植物出苗后20 d实施盐胁迫,盐分浓度用NaCl溶液(质量分数)设置,包括0%的NaCl溶液、0.2%的NaCl溶液以及0.5%NaCl溶液。即:(1)土壤本底水平即无盐胁迫(0%);(2)轻度盐胁迫(0.2%);(3)重度盐胁迫(0.5%);每隔4 d,向不同处理的植株花盆中施加对应浓度的NaCl溶液70 mL。
1.3 试验管理
生长期间,每隔2 d浇1次水;株高在植株收获前测定1次,测定时,用直尺测量植株根茎分节点到植株顶端的长度。
1.4 收获
地上生物量:将植株茎叶分别取下,在分析天平上称量其鲜重;然后于105℃烘箱杀青30 min后置于70℃烘箱处理48 h,称干重,即为地上生物量。地下部分分为两份,一份用于测定菌根侵染率,其余在70℃烘箱处理48 h,称干重,算出地下生物量。
AM真菌菌根侵染率:参照Phillips and Hayman的方法,将收获的植株的根用清水洗净后浸入10%KOH溶液中30 min,然后用60℃水浴锅处理1~2 h,待处理过的根样冷却后,在1 mol/L的HCl中处理30 s,用蒸馏水洗3次,在解剖镜下检查是否除干净植物色素。若色素基本去除,则用0.05%Trypan Blue(TB,乳酸∶甘油∶水=1∶1∶1)进行染色。在60℃水浴锅内进行染色处理,时间为5~10 min。检查染色成功后,倾去染色剂,用蒸馏水冲洗3次,保存于5%的白醋溶液中,在解剖镜下检测菌根菌侵染率[18]。
根冠比:以地下干重/地上干重计算得出。
N、P含量:参照文献[19]的方法,准确称取0.200 g干燥并研磨过的植物干样,加入到消化管中。每一消化管内加入3.3 g催化剂(硫酸铜∶硫酸钾=1∶10),用移液枪加10 mL浓硫酸。然后将消化管放置于已经加热到420℃的消煮炉中进行消化至溶液呈暗蓝绿色。冷却后将消煮好的液体样倒入100 mL的容量瓶中定容,并充分摇匀。然后用流动注射分析仪(FIAstar 5000,瑞典FOSS公司),测植物体内氮、磷含量。
1.5 统计分析
采用Microsoft Excel 2010进行数据处理;采用SPSS 24.0软件对所测数据统计分析,用平均值和标准误表示测定结果。
2 结果与分析
2.1 株高
以未接种AM真菌、不含禾草内生真菌处理(NME-)为对照,盐分处理显著降低了黑麦草株高,在不同盐浓度的环境中,AM真菌和禾草内生真菌单独或混合处理都对黑麦草的生长有促进作用(图1)。在轻度盐胁迫和重度盐胁迫下分别接种两种真菌对株高都有所促进,但两真菌协同作用促进最大,两菌混合处理组较对照分别提高14.79%和17.06%,表明在盐胁迫环境下,AM真菌和禾草内生真菌对黑麦草株高有明显的促进作用,差异显著,两菌协同作用明显。

图1 不同盐浓度处理下黑麦草株高Fig.1 Height of perennial ryegrass under different salt treatments注:不同小写字母表示不同盐分、AM真菌和禾草内生真菌处理间差异显著(P<0.05),NME表示不含菌;NME+表示含有禾草内生真菌;AME-表示接种丛枝菌根真菌;AME+表示同时含有禾草内生真菌和丛枝菌根真菌。下同
2.2 地上和地下生物量
盐分处理显著降低了黑麦草地下生物量,地上生物量虽有差异,但差异不显著(图2,3)。在不同盐浓度处理下,地上生物量差异不显著,而地下生物量显著降低。在0.2%NaCl和0.5%NaCl处理下,禾草内生真菌处理组(NME+)的地下生物量较对照(NME-)分别提高17.76%和12.83%,但AM真菌处理组(AME-)的地下生物量却降低较明显,表明禾草内生真菌提高了黑麦草根部的耐盐性,促进根部生长,而AM真菌对黑麦草地下部分有机物的合成造成一定的
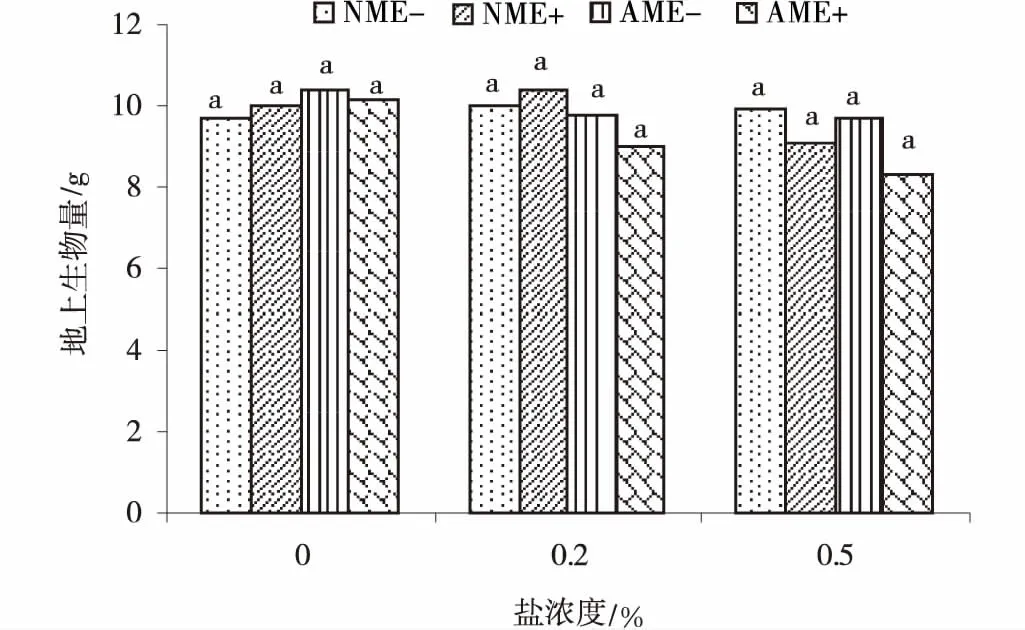
图2 不同盐浓度处理下黑麦草地上生物量Fig.2 Shoot biomass of perennial ryegrass under different salt treatments

图3 不同盐浓度处理下黑麦草地下生物量Fig.3 Root biomass of perennial ryegrass under different salt treatments
影响,对根部生长形成了胁迫,抑制生长。两菌互作(AME+)下地下生物量有所降低,但差异不显著。
2.3 根冠比
盐分处理显著降低了黑麦草根冠比(图4)。随着盐浓度的增加,黑麦草根冠比明显减小,表明盐胁迫在一定程度上对黑麦草地上部分生长的抑制能力低于对黑麦草地下部分生长的抑制能力,这与上述盐分对黑麦草地上地下生物量的影响得出的结果相一致。与对照相比,在盐胁迫下单独接种禾草内生真菌,黑麦草根冠比有所提高,而AM真菌及两菌互作下的根冠比有所降低,二者差异皆不显著。表明在试验条件下,禾草内生真菌在一定程度上缓解了盐胁迫对黑麦草生长的影响,促进了黑麦草的生长, AM真菌在一定程度上对黑麦草生长造成了抑制,两菌互作根冠比也有所降低,但差异不显著。

图4 不同盐浓度处理下黑麦草根冠比Fig.4 Root-shoot ratio of perennial ryegrass under different salt treatments
2.4 AM真菌侵染率
未接种AM真菌的黑麦草未检测到丛枝菌根真菌。接种处理均形成了菌根结构,侵染率为5%~20%;重度盐胁迫下AM真菌侵染率显著降低;两菌互作下菌根侵染率高于单菌处理,表明禾草内生真菌可促进丛枝菌根真菌侵染,在无盐胁迫下促进最明显,AM真菌侵染率提高5.53%(图5)。在轻度盐胁迫和重度盐胁迫下禾草内生真菌对AM真菌的侵染促进作用呈下降趋势。

图5 不同盐浓度处理下黑麦草菌根侵染率Fig.5 AM colonization of perennial ryegrass under different salt treatments
2.5 P含量
盐分处理下黑麦草叶部的P含量有所降低,但随着盐浓度的增加,黑麦草根系的P含量却有所增加,两者差异不显著(图6,7)。

图6 不同盐浓度处理下黑麦草地上部分含P量Fig.6 P content in shoot of perennial ryegrass under different salt treatments
AM真菌单独接种,或与禾草内生真菌互作,在无盐胁迫及轻盐胁迫环境下对黑麦草叶P含量均有显著提高,在0.2%NaCl处理下,AM真菌单独处理或与禾草内生真菌互作处理黑麦草,其叶P含量分别提高25.24%和23.3%;在0.5%NaCl处理下,黑麦草叶P含量有所提高,但差异不显著。而禾草内生真菌单独接种处理下的黑麦草叶P含量与对照组无显著差异。

图7 不同盐浓度处理下黑麦草地下部分含P量Fig.7 P content in root of perennial ryegrass under different salt treatments
随着盐浓度的提高,不同处理下的根系P含量皆有所提高。盐胁迫下,AM真菌处理组及两菌互作组的根P含量皆明显高于对照,差异显著;禾草内生真菌单独作用差异不显著。表明,在盐胁迫环境下,AM真菌及两菌互作对黑麦草根部P的吸收有显著促进作用,而禾草内生真菌促进作用不明显。
AM真菌单独处理可提高黑麦草含P量,差异显著;禾草内生真菌单独处理的黑麦草含P量相比对照差异不显著,与AM真菌互作相比对照促进作用明显,差异显著。两菌互组与两菌单独作用相比差异不显著。
2.6 N含量
随着盐浓度的增加,未处理组(NME-)叶N含量也随之增加(图8,9),但对未处理组根N含量无较大影响。轻度盐胁迫下AM真菌、两菌互作处理较对照组其叶N含量有所提高,但无显著差异,重度盐胁迫下3种处理的叶N含量皆高于对照,且差异显著。轻度盐胁迫、重度盐胁迫下AM真菌处理(AME-)对根部N吸收影响较对照差异最大,分别提高32.04%、66.7%;两菌互作较对照虽有所提高,但相较AM真菌处理差异不大;禾草内生真菌单独处理对黑麦草叶、根的N含量有所影响,但差异不显著。

图8 不同盐浓度处理下黑麦草地上部分含N量Fig.8 N content in shoot of perennial ryegrass under different salt treatments

图9 不同盐浓度处理下黑麦草地下部分含N量Fig.9 N content in shoot of perennial ryegrass underdifferent salt treatments
3 讨论
在温室条件下,研究AM真菌和禾草内生真菌对重要牧草中的草坪草种黑麦草耐盐性的影响,对利用共生菌提高禾草耐盐性,促进草牧业发展具有重要的意义。
3.1 不同盐浓度胁迫下AM真菌对宿主植物的影响
AM 真菌能与很多种植物共生,通过根外菌丝的伸展扩大植物根系的吸收范围,使植物吸收更多的矿质元素和水分,从而促进植物在胁迫条件下的生长[20]。也有报道表明AM真菌对植物的生物量影响并不一致,如R.irregularis和F.mosseae未能提高Violatricolor的生物量;还有文献表明AM真菌对植物不同部位生物量的促进作用存在差异,相对根部,AM真菌更能促进植物地上部分生长,降低植物的根冠比[21]。试验结果表明,在盐胁迫环境下,AM真菌对黑麦草的株高有促进作用,但对植株的地上、地下生物量、根冠比并无明显提高,反而有不同程度的降低。但本试验并无此情况,导致这一现象的原因之一是由于AM种类和不同植株宿主引起,由于试验的土壤性质影响[22],还有可能是因为逆境中的胁迫强度加大时,不仅植物生长受到抑制,同时还阻碍了AM真菌的孢子萌发和菌丝生长[23]。在重度盐胁迫下,AM真菌的孢子萌发和菌丝生长受到抑制,这不仅降低了AM真菌对黑麦草根系的侵染力,而且有可能导致 AM真菌和黑麦草为争夺有限资源而形成相互抑制的竞争关系。内生真菌和AM真菌都能对植物体内代谢的活动造成影响,提高宿主植物对各种营养元素的吸收利用能力。Gupta和Rautaray[24]发现,在NaCl胁迫下接种AM真菌但不施磷的玉米植株生物量,与不接种而施磷的植株的生物量相当。Mohammad等[25]发现,在无外加P源条件下,接种AM真菌的植物组织中比未接AM真菌的P元素含量要高。Rabie[26]发现在盐胁迫条件下,接种真菌的宿主植物体内N、P、Mg、K的吸收量及含量均高于未接种处理。试验发现,AM真菌会显著提高黑麦草的P、N含量,缓解了盐胁迫对黑麦草生长的不利影响,这与许多学者的研究结论相一致,这是由AM真菌的特性决定,在有效氮、磷含量不足的土壤,AM真菌菌丝能够延生到距根表数厘米外的土体中获得植物根系原本无法吸收的氮、磷,提高植物的氮、磷量并促进植物生长[27]。冯固等[28]对盐胁迫下无芒雀麦体内的矿质元素进行测定,发现接种真菌后可以显著提高植株的氮磷钾含量,提高了无芒雀麦(Bromusinermis)的耐盐性。AM真菌提高了黑麦草的N、P含量,但植株的生物量却有所降低,表明,在试验环境中,AM真菌促进了黑麦草对N、P元素的吸收,但却更多的用于自身消耗,并未能对植株起到促进生长的作用,此时AM真菌并非有益共生真菌。
3.2 不同盐浓度胁迫下禾草内生真菌对宿主植物的影响
Sabzalian等[29]以高羊茅(Festucaarundinacea)的两个基因型Fa75、Fa83和草地羊茅的一个基因型Fp60为实验材料,在0,75和170 mmol/L NaCl水平下研宄内生真菌对宿主植物抗盐性的影响。结果表明,在170 mmol/L NaCl水平下感染内生真菌的Fa83和Fp60的地下生物量显著高于未感染内生真菌的对照处理,内生真菌提高了宿主植物的抗盐性。而试验中,在盐胁迫下,禾草内生真菌处理下黑麦草的株高、地下生物量较对照有显著提高,而地上生物量差异不显著。据报道是由于盐胁迫时,内生真菌显著降低了黑麦草Na+含量,提高K+含量,以此来减低 Na+对宿主的离子毒害,并且高盐胁迫时内生真菌感染能够显著促进植株中Ca2+、Mg2+离子的吸收,通过调节钙离子和信号转导作用来降低重度盐胁迫下Na+的积累,缓解寄主植物盐胁迫离子毒害[30]。另外,Omacini等[31]通过对已有报道总结发现内生真菌对宿主地下生物量有一定抑制作用。任安芝等[32]的研究表明,当黑麦草受到盐胁迫时,内生真菌可以调节黑麦草地上、地下生物量格局。黑麦草受到盐胁迫后,随着盐浓度增加黑麦草根冠比明显下降,禾草内生真菌处理组根冠比有所提高,但差异不显著,造成这种现象的原因可能是在重度盐胁迫下,禾草内生真菌处理下的黑麦草也受到了盐害的伤害,但是毒害不明显。有关禾草内生真菌使植物的耐盐能力的提高与营养状况的改善也有相关文献报道,Malinowski等[33]研宄发现了高羊茅接种内生真菌有效提高了宿主植物对土壤中的氮素的吸收利用能力。Lyons等[34]以高羊茅为例,通过对比不带内生真菌高羊茅含量和比较低的土壤带内生真菌高羊茅的体内含氮量,也发现内生真菌对植物对氮素的吸收有较高的促进作用,但也有没有效果或者负面影响的报道。试验结果表明,禾草内生真菌对黑麦草N、P的吸收并无促进作用,分析其原因可能为内生真菌与宿主抗盐机制、与植物基因型、内生真菌种类、共生体适应性及环境等有密切的关系[35]。
3.3 不同盐浓度胁迫下AM真菌与禾草内生真菌互作对宿主植物的影响
AM真菌和禾草内生真菌互作,与对照相比,显著提高了黑麦草的株高及N、P含量,但对其生物量及根冠比却有所降低,差异不显著;与两菌单独作用相比,两菌互作只显著提高了株高,对于黑麦草的生物量、根冠比,及N、P却无显著提高,反而有不同程度的降低,表明两菌混合作用能在一定程度上促进植株生长,但却没有表现出预期中极明显的协同作用,相比于两菌单独作用,也无明显的促进作用,说明在2种共生微生物共生下,对植物的消耗大于帮助其吸收养分,二者的互作结果可能与土壤营养水平、内生真菌菌株类型和AM真菌类型等因素有关[36]。
4 结论
盐分处理会显著降低黑麦草的株高、生物量、根冠比,以及AM真菌的菌根侵染率。AM真菌和禾草内生真菌会减小盐胁迫对黑麦草生长的抑制作用,促进生长,两菌协同作用明显。AM真菌分别提高黑麦草N、P含量32.12%和12.5%,促进作用显著。禾草内生真菌对黑麦草株高、生物量和根冠比有一定的促进作用,同时在一定程度上促进了AM真菌的菌根侵染率。与两类共生微生物单独作用相比,两菌互作,对黑麦草生长、耐盐性有一定的提高,但差异不显著。
[1] 黄勤楼,钟珍梅,陈恩,等.施氮水平与方式对黑麦草生物学特性和硝酸盐含量的影响[J].草业学报,2010,19(1):102-112.
[2] 王遵亲.中国盐渍土[M].北京:科学出版社,1993:1-20.
[3] 王永新,赵祥,徐静,等.晋北重度盐碱化草地群落斑块的类型划分[J].草原与草坪,2012,32(2):1-6.
[4] Munns R,Tester M.Mechanisms of salinity tolerance[J].Annual Review of Plant Biology,2008,59(1):651-681.
[5] Kaya M D,Ipek A,Ozturk A.Effects of different soil salinity levels on germination and seeding growth of safflower(CarthamustinctoriusL.)[J].Turkish Journal of Agriculture and Forestry,2003,27:221-227.
[6] Carroll G.Fungal endophytes in stems and leaves:from latent pathogen to mutualistic symbiont[J].Ecology,1988,69:2-9.
[7] 南志标,李春杰.禾草内生真菌共生体在草地农业系统中的作用[J].生态学报,2004,24(3):605-616.
[8] 张兴旭,李春杰,南志标.内生真菌和保存时间互作对醉马草种子的生理影响[J].草地学报,2010,18(2):252-257.
[9] 金文进,李春杰,王正凤.禾草内生真菌的多样性及意义[J].草业学报,2015,24(1):168-175.
[10] 张峰,南志标,段廷玉,等.AM真菌在草地农业生态系统碳汇中的重要作用[J].草业学报,2015,24(4):191-200.
[11] 柳洁,肖斌,王丽霞,等.丛枝菌根真菌对茶树耐盐性的影响[J].西北农林科技大学学报(自然科学版),2014(3):220-225.
[12] 冯固,张福锁.丛枝菌根真菌对棉花耐盐性的影响研究[J].中国生态农业学报,2003,11(2):21-24.
[13] 刘洪光.AM真菌提高枸杞耐盐性的机制研究[D].杨陵:西北农林科技大学,2016.
[14] 张义飞,王平,毕琪,等.不同强度盐胁迫下AM真菌对羊草生长的影响[J].生态学报,2016,36(17):5467-5476.
[15] 贾婷婷,常伟,范晓旭,等.盐胁迫下AM真菌对沙枣苗木光合与叶绿素荧光特性的影响[J].生态学报,2018,38(4):1-12.
[16] 宋梅玲.野大麦内生真菌共生体耐盐性的生理机制研究[D].兰州:兰州大学,2015.
[17] 陈水红,曹莹,陈泰祥,等.内生真菌提高禾草抗盐碱性研究进展[J].生物技术通报,2017,33(12):1-8.
[18] Phillips J,Hayman D.Improved procedures for clearing roots and staining parasitic andvesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J].Transactions of the British mycological Society,1970,55(1):158-161.
[19] 方爱国.盐与磷胁迫条件下内生真菌和菌根菌对野大麦生长的影响[D].兰州:兰州大学,2013.
[20] 张峰峰,赵玉洁,谢凤行,等.AM真菌提高植物耐盐性研究进展和展望[J].天津农业科学,2008,14(6):66-70.
[21] 刘洪光.AM真菌提高枸杞耐盐性的机制研究[D].杨陵:西北农林科技大学,2016.
[22] Evelin H,Kapoor R,Giri B.Arbuscular mycorrhizal fungi in alleviation of salt stress:a review[J].Annals of Botany,2009,104(7):1263-1280.
[23] Juniper S,Abbott L.Vesicular-arbuscular mycorrhizas and soil salinity[J].Mycorrhiza,1993,4(2):45-57.
[24] Gupta N,Rautaray S.Growth and development of AM fungi andmaize under salt and acid stress[J].Acta Agriculture Scandinavica Section B-SOIL and Plant Sciences,2005,55(2):151-157.
[25] Mohammad M J,Malkawi H I,Shibli R.Effects of arbuscular mycorrhizal fungi and phosphorus fertilization on growth and nutrient up take of barley grown on soils with different levels of salts [J].Journal of Plant Nutrition,2003,26(1):125-137.
[26] RABIE G H.Influence of arbuscular mycorrhizal fungi andkinetinon the response of mungbean plants to irrigation with seawater[J].Mycorrhiza,2005,15(3):225-230.
[27] 李晓林,张俊伶.VA菌根与矿质营养[J].土壤学报,1994,31(增刊 ):38-45.
[28] 冯固,杨茂秋,白灯莎.盐胁迫下VA菌根真菌对无芒雀麦体内矿质元素含量及组成的影响[J].草业学报,1998(3):21-28.
[29] Sabzalian M R,Mirlohi A.Neotyphodium endophytes trigger salt resistance in tall and meadow fescues[J].Plant Nutr Soil Sci,2010,173:952-957.
[30] 陈水红,曹莹,陈泰祥,等.内生真菌提高禾草抗盐碱性研究进展[J].生物技术通报,2017,33(12):1-8.
[31] Omacini M,Semmartin M,Perez L I,etal.Grass-endophyte symbiosis:A neglected aboverground interaction with multiple belowground consequences[J].Applied Soil Ecology,2012,61:273-279.
[32] 任安芝,高玉複,章瑾,等.内生真菌感染对黑麦草抗盐性的影响[J].生态学报,2006,26(6):1750-1757.
[33] Malinowski D P,Zuo H,Belesky D P,etal.Evidence for copper binding by exrracellular root exudates of tall fescue but not perennial ryegrass infected with Neotyphodium spp.endophytes[J].Plant Soil,2004,267:1-12.
[34] Lyons P C,Evans J J,Bacon C W.Effects of the fungal endophyte Acremonium coenophialum on nitrogen accumulation and metabolism in tall fescue[J].Plant Physiology,1990,92:726-732.
[35] Rodriguez R J,Henson J,Volkenburgh E V,etal.Redman R.Stress tolerance in plants via habitat-adapted symbiosis[J].International Society for Microbial Ecology,2008,2(4):404-416.
[36] Liu Q,Parsons A J,Xue H,etal.Competition between foliar Neotyphodium lolii endo-phytes and mycorrhizalGlomusspp. fungi in Lolium perenne depends on resource supply and host carbohydrate content[J].Functional E-cology,2011,25(4):910-920.
