二斑栗实象COI序列多态性分析
2018-03-27熊忠平吴培福潘涌智
熊忠平 吴培福 徐 磊 潘涌智
(1. 西南林业大学云南省森林灾害预警与控制重点实验室,云南 昆明 650224; 2. 西藏自治区林业调查规划研究院,西藏 拉萨 850000)
板栗 (Castaneamollissima) 在我国具有悠久的栽培历史,其种实以淀粉及糖类为主,并含有较为丰富的蛋白质、脂肪、维生素c、Ca、K、P、Mg、Fe、Zn等营养物质;具有补肾健脾、强身健体、益胃平肝等功效;即可生食也可熟食,并且香、甜、糯的口感特性深受广大群众喜欢。二斑栗实象 (Curculiobimaculatus) 属鞘翅目 (Coleoptera) 象甲科 (Curculionidae)[1-2],是危害板栗种实的害虫之一。成虫产卵于即将成熟的种实内,幼虫孵化后在种实内蛀道、取食、发育、直至老熟,期间不仅啃食板栗种实,而且排泄粪便等,造成板栗种实霉烂变质,失去商业价值。近年来随着板栗种植经营方式、气候变化等因素,二斑栗实象危害日趋严重,被害率可高达88.4%[3-5],现已成为影响板栗产业发展的首要害虫和最难解决的制约因素。
COI(细胞色素C氧化酶亚基I) 基因,现已被广泛用于动植物的系统发育研究中,而且在昆虫地理种群和遗传多样性研究中亦得到了广泛应用和认可[6-16]。本研究以COI基因序列为依据,对来自于云南9个地理种群的二斑栗实象进行了种群间分子变异、单倍型、遗传多样性、遗传分化程度和基因流的分析和研究,探讨其种群扩散与遗传变化之间的关系,为控制其扩散危害提供参考。
1 材料与方法
1.1 材料来源
二斑栗实象样品于2012—2013年采自于云南省峨山、富民、福贡、贡山、贡山丙中洛、鹤庆、会泽、弥勒、丘北9个地区 (表1),共计79个样本。样品浸泡于95%乙醇中,并在-20 ℃保存备用。

表1 二斑栗实象不同地理种群的采集信息Table 1 Collecting data of geographic population of C.bimaculatus
1.2 总DNA提取
DNA的获取按照基因组DNA提取试剂盒 (Qiagen,德国)操作进行,单个虫体提取基因组DNA。采用1%琼脂糖凝胶,检测获取DNA的质量和完整性,DNA模板置于-20 ℃冰箱中保存备用。
1.3 PCR扩增和序列测定
参考GenBank数据库中鞘翅目昆虫的报道序列,设计扩增二斑栗实象线粒体COI基因的引物,并由铂尚生物技术 (上海) 有限公司合成。引物序列分别为COI-F (5′-GCTCATCATATATTTACAGTAGGAATAGA-3′) 和COI-R (5′-TTTGTCGTATTGATGATATT CTTTCTCA-3′)。
PCR反应总体系为50 μL,其中2 × Power Taq PCR Master Mix (BioTeke,内含Taq酶、Pfu酶 ) 25 μL,DNA模板2 μL,20 nmol/L上下游引物各1 μL,灭菌水21 μL。PCR扩增条件为:94 ℃预变性4 min;94 ℃变性45 s,50 ℃退火45 s,68 ℃延伸45 s,30个循环;最后72 ℃总延伸6 min。1%琼脂糖凝胶检测PCR扩增产物。采用BioTeke专用回收试剂盒回收PCR产物,然后送交北京百泰克生物技术有限公司进行双向测序,如存在结果不一致的序列,进行重新测序[17]。
1.4 分析方法
通过NCBI BLAST程序中的Nucleotide blast和DNAMAN V 6.0对所测序列进行比对分析[6,8],运用Lasergene软件MegAlign程序中的Clustal W方法来比对和推导核苷酸序列。利用MEGA (V6.0) 程序来分析碱基转换颠换比、碱基组成等[12],利用Mrbayes-3.1.2软件来构建聚类树,运用DNAsp 5.0来进行单倍型的检测[6],利用Network 5.0进行单倍型网络图构建,利用Arlequin 3.5软件来计算遗传变异相关指数和分子方差分析[11]。
2 结果与分析
2.1 碱基组成及突变分析
本研究所测COI基因的大小均为693 bp。核苷酸碱基组成分析表明:所测COI基因中碱基A占32.70%;碱基T占34.91%;碱基G占16.20%;碱基C占16.19%;A + T含量为67.61%,G + C含量为32.39%,A + T含量约为G + C含量的2倍左右,完全吻合昆虫线粒体核苷酸的组成特征。AT斜率为-0.032 8,GC斜率为0.000 2,说明云南二斑栗实象的COI基因A碱基的含量低于T碱基的含量,G碱基的含量高于C碱基的含量。
在9个地理种群79个样本中共检测到多态性位点32个,其中单一多态性位点13个,简约信息位点19个。二斑栗实象79个样本的转换频率为21.03,颠换频率为1.98,因为转换频率大于颠换频率说明9个地域的结构差异变化不大即其遗传多样性变化不大。
2.2 单倍型分析
本研究共发现34个单倍型,标记为H1~H34,单倍型的比率为43.04%。其中H4出现的频率最高 (23/79),为所有种群的共享单倍型,占所有个体的29.11%。部分种群共享的单倍型有H1、H5、H12、H13、H14、H16,剩余的均为各地理种群各自所有的特有单倍型。由单倍型网络图 (图1) 和热点图 (图2) 可以直观表明,各单倍型在地理种群间的分布及演化关系。

一个圆圈表示一个单倍型,圆圈大小与出现次数呈正比。
图1二斑栗实象线粒体DNACOI的基因单倍型网络
Fig.1 Median-Joining haplotype network ofC.bimaculatusbased onCOIgene of mtDNA
2.3 单倍型系统进化分析
二斑栗实象地理种群组间进化距离最高为0.009,偏差为0.03;最低为0.003,偏差为0.001;整体平均进化的距离为0.006,平均偏差为0.002。
Mrbayes聚类分析 (图3) 表明,不同地理种群的个体分散于不同的分支上,并未按各自所属地理相应归类。同样,单倍型系统树 (图3) 也印证了聚类分析结果。由图2可以看出峨山种群 (EX) 的特有单倍型数量最多,为6个;其次为会泽种群 (HZ),为5个;贡山丙中洛种群 (GS) 无特有单倍型。从热点图颜色变化可直观地看出:不同地理种群所含的单倍型种类有所差别,各单倍型在不同种群内所占的个体数也存在明显不同。富民 (FC)、弥勒 (ML) 和丘北 (QB) 种群内Hap4包含的个体数最多,分别为5个;贡山 (G) 种群内Hap13包含的个体数最多,为5个。

图2单倍型热点图
Fig.2 The heatmap ofCOIhaplotypes of differentC.bimaculatuspopulations
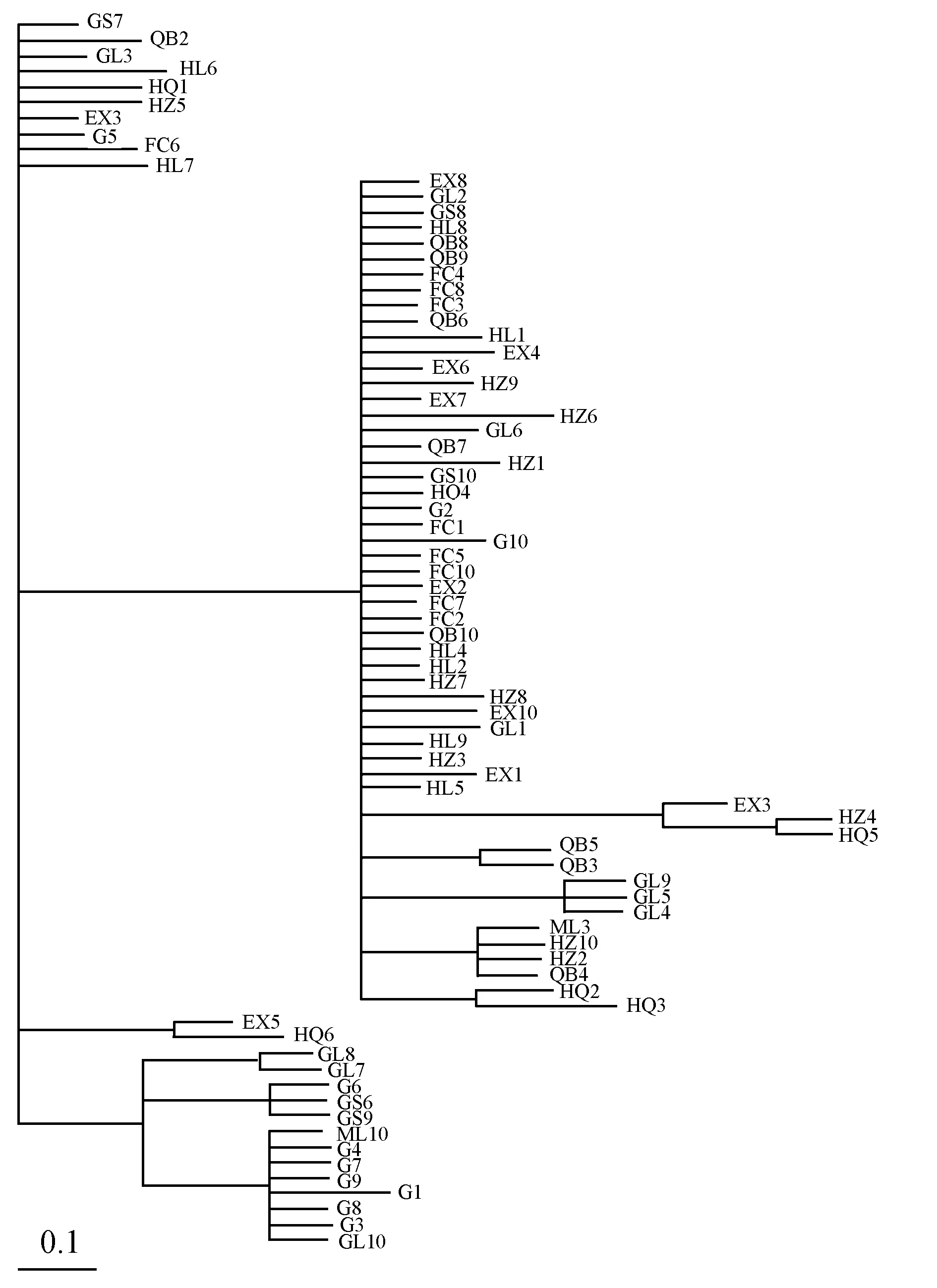
图3利用贝叶斯法构建的二斑栗实象COI聚类树
Fig.3 Mrbayes inference phylogenetic tree of differentC.bimaculatuspopulations inferred fromCOIsequences
2.4 遗传多样性
总群体单倍型多样度Hd为0.901 01,核苷酸多样度Pi为0.006 41,核苷酸平均差异数K为4.423 56 (见表2)。不同种群间核苷酸多样度的变化范围为0.003 46~0.008 79,单倍型多样度的范围是0.063 889~1.000 00。

表2 不同地理种群二斑栗实象COI单倍型、核苷酸多样性和Tajima′s D中性检验结果Table 2 COI haplotype diversity, nucleotide diversity and Tajima′s D neutrality test in different geographic populations of C.bimaculatus
应用DNAsp 5.0软件计算 (见表3,4),各地理种群总Gst为0.052 55,总Fst为0.132 82,总基因流Nm为9.01。各地理种群间核苷酸差异数Kxy平均值为4.55,变化范围为2.111 1~6.550 0。核苷酸歧义度Dxy平均值为0.005 1,变化范围为0.003 1~0.009 5。遗传分化系数Gst平均值为0.029 3,变化范围为-0.021 8~0.142 0。固定系数Fst平均值为0.091 1,变化范围为-0.085 8~0.559 2。因此,贡山 (G) 种群与其他种群的遗传分化程度较大 (表4),其余种群间分化程度低,但是总体变异都不大,说明个种群间存在频繁基因交流[7,18]。
2.5 遗传分化分析
AMOVA分子变异分析表明 (表5):二斑栗实象9个地理种群间的遗传变异为15.18%,远小于种群内的遗传变异84.82%,说明二斑栗实象的遗传变异主要影响来自于种群内部。
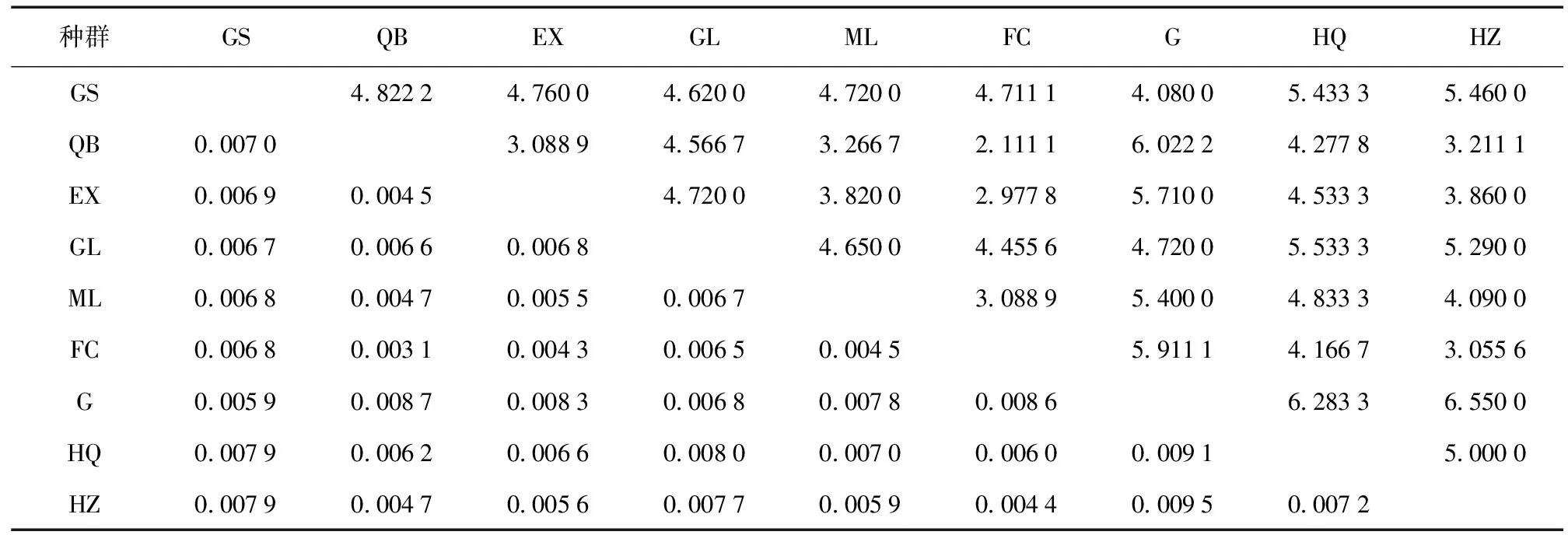
表3 二斑栗实象各种群间核苷酸平均差异数Kxy (上三角) 与核苷酸歧义度Dxy (下三角)Table 3 Pairwise average number of nucleotide differences (Kxy) (above the diagona) and nucleotide divergenece (Dxy) (below the diagona) between different geographic of C.bimaculatus

表4 二斑栗实象各种群间遗传分化系数Gst(上三角)与固定系数Fst (下三角)Table 4 Pairwise Gst (above the diagona) and Fst (below the diagona) between different geographic of C.bimaculatus

表5 二斑栗实象9个地理种群的分子异 (AMOVA) 分析Table 5 Analysis of molecular variance (AMOVA) among 9 populations of C.bimaculatus
基于COI基因序列,利用Kimura-2-Parameter模型计算二斑栗实象各地理种群间的遗传距离。由表6可知,不同地理种群间遗传距离为0.003 1~0.009 6。
利用用Mantel相关性检验来检测各地理种群间的遗传分化程度与地理隔离关系的结果表明:不同种群的遗传距离矩阵与相应采集地点地理距离的自然对数矩阵之间呈现一定的相关性 (R=0.469 054,P=0.002 < 0.05),但是相关系数较小,即地理隔离与种群间遗传距离有一定的关联,这可能由于云南省高山、河谷交错,在较短的距离内气候和生态因子变化强烈,引起地理种群间的遗传变异。

表6 二斑栗实象不同地理种群间的地理距离 (km) 自然对数值 (上三角) 与遗传距离 (下三角)Table 6 The nature logarithm of geographical distance (km) (above the diagonal) and pairwise genetic distance (below the diagonal) among C.bimaculatus populations
3 结论与讨论
本研究基于COI基因对采自于云南省9个不同地理种群的二斑栗实象进行了序列扩增和相关分析,结果表明:获得79条不同序列,共检测出34个单倍型,其中单倍型H4是各个地理种群共享的单倍型。
通过单倍型网络图、贝叶斯聚类树、单倍型热点图的分析得到:不同地理种群的个体分散于不同的分支上,并未按各自所属地理相应归类。说明各地理种群间既保持有频繁的基因交流,也存在一定程度的遗传分化[19]。同时,Tajima′sD检验显示[10,20],二斑栗实象总群体和各地理种群均不显著,表明该虫近期未经历群体扩张及持续增长,保持相对稳定的群体规模。另外,二斑栗实象总基因流Nm=9.01>4,说明二斑栗实象种群间的基因交流频繁,遗传分化程度较低[7-9,21-22];固定系数Fst、遗传分化系数Gst数值均较低,分子变异分析结果进一步证实这个结果。
象甲科昆虫的飞行能力不强,不能长距离迁徙。二斑栗实象作为象甲科昆虫种类之一,同样亦存在类似情况。然而,本研究表明二斑栗实象种群间存在频繁的基因交流,这可能与其寄主长距离运输有密切关系。板栗是被人为种植最早、最成熟的经济树种之一,栽培历史悠久,为了获得更高的经济价值,各地间的品种交流非常频繁,因此促进了二斑栗实象种群间的基因交流。
[1] Faust J K M. Beschreibung neuer Russelkafer aus China[J]. Deutsche Entomologische Zeitschrift, 1890, 2: 257-263.
[2] Pelsue F W, Zhang R. A review of the genus CURCULIOL from China with descriptions of new taxa. Part I (Coleoptera: Curculionidae: Curculioninae: Curculionini) [J]. The Coleopterists Bulletin, 2000, 54(2): 125-142.
[3] 罗佑珍, 卢美榕, 杨本立, 等. 云南板栗新害虫二斑栗象的研究[J]. 云南农业大学学报, 1991, 6(2): 93-97.
[4] 卢美榕, 孙跃先, 许若清, 等. 云南板二斑栗实象研究[J]. 西南林学院学报, 1995, 15(2): 42-44.
[5] 侯清敏, 韩春梅, 白九维. 河北省栗实象虫的种类与分布[J]. 河北农业大学学报, 1993, 16(2): 23-26.
[6] 朱彦彬, 马继芳, 董立, 等. 基于线粒体COI基因序列的中国二点委夜蛾遗传多态性分析[J]. 昆虫学报, 2012, 55(4): 457-465.
[7] 张利娟,沈登荣, 孙跃先, 等. 基于mtDNACOI基因序列的云南榕母管蓟马不同地理种群的遗传分化分析[J]. 昆虫学报, 2012, 55(2): 199-207.
[8] 孙嵬, 张柱亭, 董辉, 等. 基于线粒体COI基因序列的黄胫小车蝗不同地理种群的遗传分化及基因流分析[J]. 昆虫学报, 2013, 56(8): 907-916.
[9] 王兴亚, 许国庆. 中国甜菜夜蛾地理种群的遗传分化与基因流[J]. 昆虫学报, 2014, 57(9): 1061-1074.
[10] 周宁宁, 王梦馨, 崔林, 等. 基于COI基因全长序列的假眼小绿叶蝉地理种群遗传分化研究[J]. 生态学报, 2014 , 23(4): 6879-6889.
[11] 王红, 徐忠新, 韩岚岚, 等. 基于线粒体COI基因序列的大豆食心虫中国东北地理种群遗传多样性分析[J]. 昆虫学报, 2014, 57(9): 1051-1060.
[12] 王蒙, 徐浪, 张润杰, 等. 基于线粒体COI基因的桔小实蝇种群遗传分化研究[J]. 昆虫学报, 2014, 57(12): 1424-1438.
[13] 阴环, 李晓晨. 基于线粒体DNA序列的秦岭地区淡足青步甲种群遗传结构分析[J]. 生态学报, 2015, 35(9): 3052-3059.
[14] Acs Z, Challis R J, Bihari P, et al. Phylogeny and DNA barcoding of inquiline oak gallWasps (Hymenoptera: Cynipidae) of the Western Palaearctic[J]. Molecular Phylogenetics and Evolution, 2010, 55(1): 210-225.
[15] Sun W, Dong H, Gao Y B, et al. Genetic variation and geographic differentiation among populations of the nonmigratory agricultural pestOedaleusinfernalis[J]. Journal of Insect Science, 2015, 15(1): 150.
[16] 张鹏飞, 周晓榕, 庞保平, 等. 基于线粒体COI基因序列的内蒙古沙葱萤叶甲种群遗传多样性及遗传分化[J]. 环境昆虫学报, 2017, 39(2): 332-341.
[17] 吴培福, 佟友贵, 王琳, 等. 2种豆象线粒体COX1和12SrRNA基因序列的克隆分析[J]. 西南林业大学学报, 2014, 34(2): 44-48.
[18] Weight S. Evolution and the Genetics of Population: Vol 4. Variability Within and Among Natural Population[M]. Chicago: The University of Chicago Press, 1978: 10-15.
[19] Hughes A R, Inouye B D, Johnson M J, et al. Ecological consequences of genetic diversity[J]. Ecology Letters, 2008, 11(6): 609-623.
[20] Tajima F. The effect of change in population size on DNA polymorphism[J].Genetics,1989,123(3):597-601.
[21] Rousset F. Genetic differentiation and estimation of gene flow fromF-statistics under isolation by distance[J]. Genetics, 1997, 145(4): 1219-128.
[22] Whitlock M C, McCauley D E. Indirect measures of gene flow and migration:FSTnot equal to 1/(4Nm+1) [J]. Heredity, 1999, 82(2): 117-125.
