不同菌株培养顺序对添加黏土矿物白浆土腐殖质组成的影响
2018-03-27徐俊平范嘉妍李芳慧
王 帅, 徐俊平, 王 楠, 窦 森, 刘 兰, 范嘉妍, 李芳慧
(1. 吉林农业科技学院 农学院, 吉林 吉林 132101; 2. 吉林农业大学 资源与环境学院, 长春 130118)
木质素等有机分子的腐殖化是土壤自然肥力形成的物质基础, 农业固体废弃物中含有大量的木质纤维成分, 由于木质素的缠绕保护作用, 使得纤维成分不易降解, 因此, 加速木质素向腐殖质(HS)转化已成为促进堆肥快速腐解的关键[1]. 在土壤腐殖化进程中, 木质素及其酚型、 醌型和脂肪族化合物等降解产物均可成为HS形成的重要前体物质[2]. 木质素完全降解是真菌、 细菌及其微生物群落共同作用的结果, 由于木质素分解是一个氧化过程[3], 因此真菌驱动的氧化反应在次生代谢阶段占主导地位; 细菌降解木质素在初级代谢阶段主要对其结构进行改性, 使其增加水溶性, 并产生一种被修饰的、 水溶的、 酸可沉淀的多聚木质素. 多聚木质素中的酚羟基、 羧基与HS含氧官能团结构相似, 可作为HS形成的前体物质[4].
在原始土壤形成过程中, 矿物质参与HS的合成反应, 既充当微生物生存所附着的黏附界面, 又可充当氧化剂成为胞外呼吸的电子受体[5], 对木质素分解及HS形成起非生物催化作用. 此外, 矿物也可加速酚类化合物的非生物聚合作用[6]. 目前关于微生物利用木质素形成HS以及微生物不同接种顺序对HS的影响研究较多: 李艳等[7]研究表明, 微生物能促进混有玉米秸秆暗棕壤的腐殖化程度, 其中细菌作用最小; Huang等[8]将黄孢原毛平革菌(Phanerochaetechrysosporium)和栗褐链霉菌(Streptomycesbadius)接种于稻草秸杆, 研究了其对稻草秸秆的生物脱木质化作用; Yanagi等[9]通过接种金色链霉菌(Streptomycesaureus)、 鲑贝革盖菌(CoriolusconsorsImaz)、 毛云芝菌(Coriolushirsutus)和桦革褶菌(Lenzitesbetulina)等研究了各菌株对5种来源胡敏酸(HA)脱色降解的差异, 揭示了HA化学结构以及对微生物脱色反应的抵制特性与微生物种类有关; Xi等[10]利用多阶段接种微生物菌剂的方法明显提高生活废弃物堆肥腐熟阶段的细菌群落多样性, 进而加快堆肥的腐熟进程; Filip等[11]研究表明, 黏土矿物能缩短暗色物质的形成时间, 对碱提取腐殖酸类聚合物的形成有促进作用; Fukuchi等[12]研究表明, 沸石有利于类HA中氮含量和分子量的提高, 对醌、 酮等羰基碳含量有促进作用; Duarte等[13]研究表明, 矿物表面明显抑制土壤HA分子中非晶形亚甲基结构的形成, 但可促进HA的芳香度. 对微生物驱动下木质素向HS转化以及矿物参与腐殖化进程的研究较多, 但不同菌株培养顺序以及不同黏土矿物添加对HS组成的差异影响尚未见文献报道.
K矿物和M矿物均为土壤中常见的、 数量较大的、 1∶1型和2∶1型层状硅酸盐黏土矿物的典型代表, 二者在比表面积、 层间作用力、 膨胀性和可塑性等物理性状上存在差异[14], 通过静电引力和疏水作用力对土壤微生物学特性产生差异影响, 进而在微生物利用底物、 硝化与呼吸作用以及生长繁衍等方面有促进或抑制作用, 最终影响微生物驱动下木质素向HS的转化进程[15]. 本文在室内培养条件下, 以混有木质素的白浆土为供试对象, 通过设置黑曲霉(Aspergillusniger)、 巨大芽孢杆菌(Bacillusmegaterium)和灰色链霉菌(Streptomycesgriseus)的6种培养顺序, 以SiO2为对照, 研究K矿物和M矿物对白浆土腐殖质组成的差异影响, 并分析黏土矿物参与腐殖质形成机理以及不同菌株培养顺序对腐殖质组成的影响规律.
1 材料与方法
1.1 材 料
白浆土取自吉林农业科技学院北大地玉米实验田(E 126°28′48.66″, N 43°57′34.85″), 经风干、 粉碎后过0.25 mm筛; 木质素购于日本东京化成工业株式会社, CAS No.[9005-53-2]; 高岭土(石)(Al2O3·2SiO2·2H2O, CAS No.[1332-58-7])和蒙脱土(石)(K10, CAS No.[1318-93-0])购于国药集团化学试剂有限公司; SiO2购于天津科密欧化学试剂有限公司.
1.2 实 验
采用室内培养法. 准确称取18.5 g白浆土于100 mL三角瓶中, 添加0.5 g木质素与1.0 g矿物质粉末, 混匀后用蒸馏水将混料含水量调至田间持水量的80%, 塞紧防菌棉塞, 用报纸包扎后进行高压蒸汽灭菌(121 ℃, 20 min), 待灭菌彻底后, 在无菌条件下自然冷却.
供试矿物为高岭土(石)(kaolinite, K)和蒙脱土(石)(montmorillonite, M), 以SiO2(silicon dioxide, Sd)为对照. 3种菌株均从白浆土中筛选, 经16sRNA鉴定, 分别归属于细菌类芽孢菌属中的巨大芽孢杆菌(B.megaterium)、 放线菌类链霉菌属中的灰色链霉菌(S.griseus)及真菌类曲霉属中的黑曲霉(A.niger). 将B.megaterium用牛肉膏-蛋白胨培养基扩培,S.griseus用高氏一号培养基扩培,A.niger用马铃薯-葡萄糖琼脂培养基扩培. 3种菌株悬液的制备方法如下: 用少量无菌生理盐水清洗已扩培的单一菌株(或孢子), 倒入装有无菌生理盐水的锥形瓶中, 28 ℃摇瓶培养30 min制成单一菌株悬液. 用稀释平板法计算B.megaterium和S.griseus的菌落数分别为5.9×106,6.0×109个/mL, 用血球计数板计数A.niger的孢子数量为68 个/mL. 将3种单一菌株悬液按不同排列组合及Ⅰ期培养菌株→Ⅱ期培养菌株→Ⅲ期培养菌株方式可产生6种培养顺序, 即A.niger→B.megaterium→S.griseus(ABS);A.niger→S.griseus→B.megaterium(ASB);B.megaterium→S.griseus→A.niger(BSA);B.megaterium→A.niger→S.griseus(BAS);S.griseus→B.megaterium→A.niger(SBA);S.griseus→A.niger→B.megaterium(SAB). 基于每种矿物的菌株培养顺序均重复3次.
在无菌操作条件下, 先向灭菌后的培养料中接种单一菌株悬液(Ⅰ), 塞紧防菌棉塞, 用报纸包扎, 置于28 ℃恒温培养箱中培养15 d后, 取出样品接种菌株悬液(Ⅱ), 重复上述过程, 再接种菌株悬液(Ⅲ), 培养15 d后, 在28 ℃恒温培养箱中继续培养65 d, 共培养110 d. 菌悬液接种量以每100 mL锥形瓶中注入5 mL进行, 待110 d培养结束后取样, 迅速转入鼓风干燥箱(45 ℃, 48 h)中终止微生物活动, 研磨土样并过0.01 mm筛, 将样品保存于玻璃干燥器中, 用于腐殖质组成分析.
1.3 测试方法
采用腐殖质组成修改法对动态收集、 培养后的土样进行分析, 过程如下: 称取过0.01 mm筛的土样5.00 g于100 mL塑料离心管中, 添加30 mL蒸馏水, 搅拌均匀后在恒温水浴振荡器中于70 ℃提取1 h, 在3 500 r/min离心15 min, 将上清液过滤至50 mL容量瓶中, 在带有残渣的离心管中加水20 mL, 搅拌均匀, 再离心, 合并上清液, 用蒸馏水定容, 该溶液即为水溶性物质(water soluble substance, WSS). 将蒸馏水换为0.1 mol/L NaOH和0.1 mol/L Na2P2O7混合液对残渣进行提取, 将收集的溶液定容至50 mL后即为可提取腐殖酸(humic-extracted acid, HE). 离心管中残渣经蒸馏水洗涤至洗液接近中性, 将其转入鼓风干燥箱于55 ℃烘干至恒质量, 该沉淀即为胡敏素(humin, Hu).
取上述HE溶液30 mL, 用0.5 mol/L的H2SO4调至pH=1.3后, 置于70 ℃水浴锅中保温1.5 h, 静置过夜, 过滤溶液, 定容至50 mL容量瓶中, 该溶液即为富里酸(fulvic acid, FA). 滤纸上的残渣先用0.05 mol/L H2SO4洗涤, 再用0.05 mol/L温热的NaOH将其溶解于50 mL容量瓶中, 定容, 该溶液即为胡敏酸(humic acid, HA)的碱溶液, 腐殖质各组分有机碳质量比分别用wC(WSS),wC(FA),wC(HA)和wC(Hu)表示, 采用K2Cr2O7氧化法测定, 用北京普析通用仪器有限责任公司生产的TU-1901型紫外可见分光光度计测定HA碱溶液在400,600 nm处的吸光值(E400和E600), 并计算其色调系数ΔlogK=logE400-logE600.
1.4 数据处理方法
采用EXCEL 2003和SPSS 18.0(PASW Statistics 18)软件对数据进行整理并分析差异显著性.
2 结果与讨论
2.1 菌株培养顺序对添加不同矿物中混有木质素白浆土wC(HA)/wC(FA)的影响

a,b,c表示添加不同矿物、 相同菌株培养顺序在p<0.05水平上的差异显著性; A,B,C,D,E表示添加相同矿物、 不同菌株培养顺序在p<0.05水平上的差异显著性.图1 菌株培养顺序对添加不同矿物中混有木质素白浆土wC(HA)/wC(FA)的影响Fig.1 Effects of microbial culture sequences on wC(HA)/wC(FA) extracted from albic soils amended with different minerals
HA是带有负电荷的胶体物质, 呈微酸性, 溶于碱, 是土壤HS中最活跃的组分, 对土壤肥力形成及表达较重要; FA是一类分子量小、 生理活性大、 氧化程度较高、 既溶于酸又溶于碱的HS组分, 对HA的积累和更新起关键作用, 并可促进矿物分解和养分释放[16]. 胡富比wC(HA)/wC(FA)用于表征C(HA)与C(FA)间的相互转化关系, 该比值越大, 腐殖质品质越好. 图1为菌株培养顺序对添加不同矿物中混有木质素白浆土wC(HA)/wC(FA)的影响. 由图1可见: 基于ABS,ASB和BAS的培养顺序, K矿物添加使混有木质素白浆土的wC(HA)/wC(FA)显著高于M矿物; 在SBA和SAB的影响下, K矿物添加使白浆土的wC(HA)/wC(FA)显著低于M矿物; 在BSA的影响下, K和M矿物添加白浆土的wC(HA)/wC(FA)差异不显著, 但均显著高于Sd处理. 当以A.niger为Ⅰ期培养菌株, 或以B.megaterium为Ⅰ期培养菌株、A.niger为Ⅱ期培养菌株时, K矿物对混有木质素白浆土wC(HA)/wC(FA)的促进作用大于M矿物, 从而提升腐殖质品质. 这是由于K矿物有利于促进土壤中细菌和放线菌的数量[17]所致. 当真菌A.niger在初期培养后, K矿物并未促进其数量增长, 使得A.niger在消耗完较易利用的碳源后, 自身活性减弱而以菌体的形式进入土壤, 矿化作用被极大削弱, 之后接种的细菌和放线菌得到K矿物的促进使其数量扩增, 但因碳源的耗竭而使菌株不易获取能量, 此时真菌A.niger的死亡菌体历经缩合, 使FA向HA转化. 当以B.megaterium为Ⅰ期培养菌株时, 其数量得到扩增, 仅消耗了部分碳源, 接种的真菌因有部分碳源可利用, 因此发挥了部分降解作用, 为之后缩合提供了较多的菌体物质, 从而提升了腐殖酸中HA的比例, 使wC(HA)/wC(FA)增加. 当以S.griseus为Ⅰ期培养菌株时, M矿物比K矿物更利于增加白浆土的wC(HA)/wC(FA), M矿物层间距较大,S.griseus易进入层间而被固定, 使其活性降低, 菌体嵌入更易形成稳定的有机碳成分, M矿物因具有较好的亲和性, 通过配体交换使更多HA吸持在M矿物表面[18], 通过吸附80%以上的微生物可改变其代谢活性, 进而影响微生物驱动下的腐殖化进程[19], 最终使白浆土的wC(HA)/wC(FA)获得较大提升. 在B.megaterium→S.griseus→A.niger的培养顺序下, 其菌体未经缩合, 因此添加K矿物或M矿物对混有木质素白浆土wC(HA)/wC(FA)差异的影响均较小, 但仍高于对照处理. 因此, 与SiO2相比, K矿物和M矿物具有促进缩合、 使HA所占比例增加的作用. 在添加K矿物和M矿物后, 不同菌株培养顺序下白浆土的wC(HA)/wC(FA)规律分别为: ASB≈BAS>ABS>BSA>SBA>SAB和SBA≈SAB>ABS≈BSA>BAS>ASB.可见, 在混有木质素白浆土中添加K矿物,A.niger或B.megaterium为Ⅰ期培养菌株更利于增加白浆土的wC(HA)/wC(FA); 当添加矿物为M矿物时, Ⅰ期培养菌株为S.griseus更利于C(FA)向C(HA)转化.
2.2 菌株培养顺序对添加不同矿物中混有木质素白浆土HA的Δlog K影响
HA色调系数(ΔlogK)是考察HA分子结构的定性指标, 其值越高, HA数均分子量越小, 分子结构越简单[20]. 图2为菌株培养顺序对添加不同矿物中混有木质素白浆土HA的ΔlogK影响. 由图2可见: 基于ABS,ASB,SBA和SAB处理条件, 向混有木质素白浆土中添加K矿物可使HA的ΔlogK显著低于添加M矿物的值(K
2.3 菌株培养顺序对添加不同矿物中混有木质素白浆土wC(Hu)的影响
Hu是与矿物质紧密结合的HS, 是土壤中的惰性物质, 对于土壤结构稳定、 养分保持、 碳截获以及生物地球化学循环等均具有重要意义[16]. 图3为菌株培养顺序对添加不同矿物中混有木质素白浆土wC(Hu)的影响.

a,b,c表示添加不同矿物、 相同菌株培养顺序在p<0.05水平上的差异显著性; A,B,C,D表示添加相同矿物、不同菌株培养顺序在p<0.05水平上的差异显著性.图2 菌株培养顺序对添加不同矿物中混有木质素白浆土HA的Δlog K影响Fig.2 Effects of microbial culture sequences on Δlog K value of HA extracted from albic soils amended with different minerals

a.b.c表示添加不同矿物、 相同菌株培养顺序在p<0.05水平上的差异显著性; A,B,C,D表示添加相同矿物、不同菌株培养顺序在p<0.05水平上的差异显著性.图3 菌株培养顺序对添加不同矿物中混有木质素白浆土wC(Hu)的影响Fig.3 Effects of microbial culture sequences on wC(Hu) extracted from albic soils amended with different minerals
由图3可见, 在添加K矿物条件下, 与Sd相比, 除SBA处理能使白浆土wC(Hu)与对照持平外, 其他5种菌株培养顺序均有利于wC(Hu)的累积, 其中SAB的优势最大, 使wC(Hu)增加119.1%. 当K矿物参与微生物对木质素降解时, 除S.griseus→B.megaterium→A.niger外, 其他菌株培养顺序均有利于木质素降解成分与K矿物的结合, 形成更多的Hu组分. 当M矿物参与微生物对木质素降解时, 与Sd相比, 除ASB处理可显著增加wC(Hu)外, ABS,BAS和SAB的培养顺序均未对wC(Hu)产生显著影响, BSA和SBA处理使wC(Hu)分别降低38.9%和50.0%. 当以A.niger为Ⅲ期培养菌株时,B.megaterium与S.griseus的培养顺序不影响对白浆土C(Hu)的矿化分解, 这是因为S.griseus和B.megaterium在培养Ⅰ、 Ⅱ期已对木质素进行改性, 失活的菌体又会给A.niger的降解作用提供能源, 因此可增加A.niger对C(Hu)的矿化作用.
2.4 不同菌株培养顺序对混有木质素白浆土TOC,wC(WSS),wC(HE)的影响
表1列出了在不同矿物添加条件下, 菌株培养顺序对混有木质素白浆土TOC,wC(WSS)和wC(HE)的影响. 由表1可见: 基于BAS和SAB的培养顺序, 添加M矿物使混有木质素白浆土TOC的矿化程度大于K矿物, 在其他4种培养顺序下, K与M矿物对TOC的影响差异不显著; 当添加矿物为K或M时, SAB的培养顺序均使TOC积累量在供试6种菌株培养顺序中最大; 在BAS和SAB两种培养顺序下, M矿物对Ⅱ期培养菌株为A.niger的白浆土TOC的矿化有较好促进作用, 即通过提供微生物活动场所, 扩增其数量, 进而增强白浆土TOC的矿化; 在其他4种菌株培养顺序下, 添加K和M矿物并未对矿化作用产生差异影响;S.griseus→A.niger→B.megaterium对白浆土TOC的矿化能力最弱.
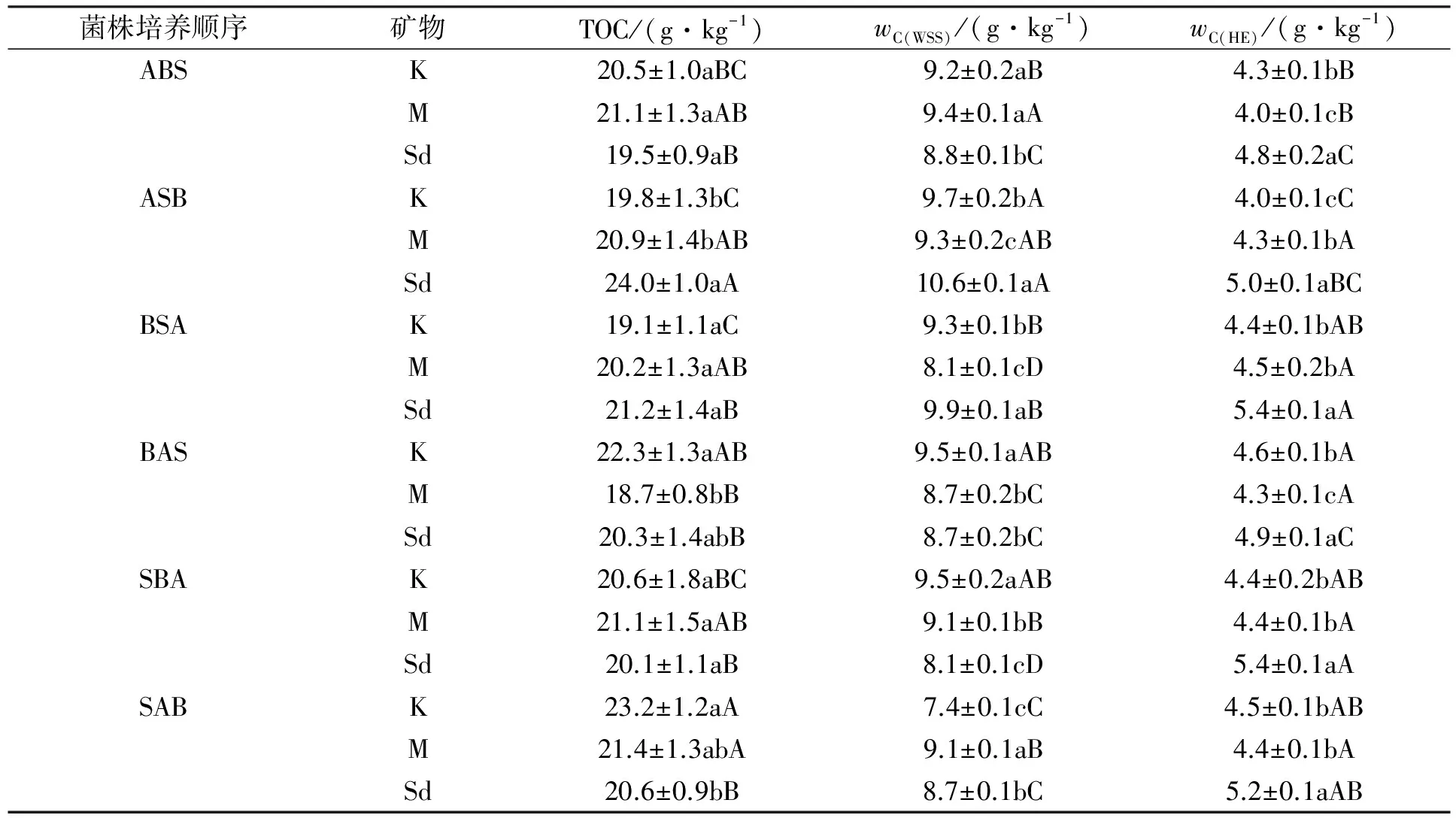
表1 菌株培养顺序对添加不同矿物中混有木质素白浆土TOC,wC(WSS),wC(HE)的影响*
*a,b,c表示相同菌株培养顺序、 不同矿物在p<0.05水平上的差异显著性; A,B,C,D表示相同矿物、 不同菌株培养顺序在p<0.05水平上的差异显著性.
基于ASB,BSA,BAS和SBA的培养顺序, 添加K矿物使得白浆土的wC(WSS)显著高于M矿物, 在SAB影响下, 结果相反, 在ABS影响下, 两种矿物之间差异不显著. 在S.griseus→A.niger→B.megaterium培养顺序下, K矿物比M矿物更易促进微生物对白浆土C(WSS)的消耗, 在A.niger→B.megaterium→S.griseus影响下, 添加K矿物和M矿物未对C(WSS)产生差异影响, 在其他4种培养顺序下, M矿物更易促进微生物对白浆土C(WSS)的消耗. 黏土矿物与可溶性有机物作用将改变矿物表面特性和反应活性[18], M矿物可优先吸附天然有机质的小分子部分[24], 使C(WSS)及微生物在M矿物颗粒表面接触的几率增加, 增大微生物对C(WSS)的消耗. 此外, 与对照相比, 添加M和K矿物均可使ABS和SBA两种培养顺序下白浆土的C(WSS)增多, ASB和BSA的培养顺序更有利于微生物对C(WSS)的消耗. 在K矿物影响下, ASB在6种菌株培养顺序中对白浆土C(WSS)的促进作用最大(9.7 g/kg), 在M矿物影响下, ABS更利于白浆土C(WSS)的积蓄.
在ABS和BAS培养顺序下, K矿物可使白浆土的wC(HE)高于M矿物, 在ASB影响下, 结果相反, 在其他3种培养顺序下, K与M矿物之间差异不显著. 与对照相比, 在6种培养顺序下, 添加K和M矿物均有利于混有木质素白浆土C(HE)的消耗. 由于C(HE)的两个组分C(FA)和C(HA)无法全部进入M矿物土层间[25], 因此被微生物降解. 在A.niger→S.griseus→B.megaterium影响下, 培养前期缺乏B.megaterium对木质素的改性,A.niger的降解作用受限, 由于M矿物层间吸纳了接种的S.griseus和B.megaterium, 因此更利于C(HE)的合成. 在6种菌株培养顺序下, 与SiO2相比, 添加K和M矿物均有利于微生物对混有木质素白浆土C(HE)的消耗. 木质素的分解产物(脂类、 酚类和醌类化合物)可与氨基酸等物质发生聚合而形成HS, 在聚合期间, K和M矿物表面吸附的铁、 铝氧化物可促进木质素的氧化降解, 因此, 比SiO2更易促进C(HE)的分解消耗.
3 结 论
1) 当以A.niger为Ⅰ期培养菌株, 或以B.megaterium为Ⅰ期培养菌株、A.niger为Ⅱ期培养菌株时, K矿物对混有木质素白浆土wC(HA)/wC(FA)的促进作用大于M矿物, M矿物更利于HA分子结构的复杂化; 当以S.griseus为Ⅰ期培养菌株时, M矿物比K矿物更利于增加白浆土的wC(HA)/wC(FA). 在B.megaterium→S.griseus→A.niger培养顺序下, 与SiO2相比, 两类矿物均有利于wC(HA)/wC(FA)的增加, 使HA分子结构趋于简单, 但两类矿物间差异不显著.
2) 除S.griseus→B.megaterium→A.niger外, 在其他5种接种顺序下, K矿物更利于木质素降解成分与其结合, 形成更大数量的C(Hu).
3) 与K矿物相比, M矿物对Ⅱ期培养菌株为A.niger的白浆土TOC的矿化有较好促进作用.S.griseus→A.niger→B.megaterium培养顺序对白浆土TOC的矿化能力最弱, 且K矿物比M矿物更易促进微生物对白浆土C(WSS)的消耗. 在A.niger→B.megaterium→S.griseus培养顺序下, K矿物和M矿物未对C(WSS)产生差异影响, 在其他4种培养顺序下, M矿物比K矿物更易促进微生物对白浆土C(WSS)的消耗.
4) 基于A.niger→B.megaterium→S.griseus和B.megaterium→A.niger→S.griseus培养顺序, K矿物比M矿物更易促进C(HE)的形成. 在6种菌株培养顺序下, 与SiO2相比, 添加K矿物和M矿物均有利于微生物对混有木质素白浆土C(HE)的消耗.
[1] 黄红丽, 曾光明, 黄国和, 等. 堆肥中木质素降解微生物对腐殖质形成的作用 [J]. 中国生物工程杂志, 2004, 24(8): 29-31. (HUANG Hongli, ZENG Guangming, HUANG Guohe, et al. Current Study on the Effect of Lignolytic Organisms on Humus Formation in Composting [J]. China Biotecnology, 2004, 24(8): 29-31.)
[2] Tuomela M, Oivanenl P, Hatakka A. Degradation of Synthetic14C-Lignin by Various White-Rot Fungi in Soil [J]. Soil Biology & Biochemistry, 2002, 34: 1613-1620.
[3] 席北斗, 刘鸿亮, 白庆中, 等. 堆肥中纤维素和木质素的生物降解研究现状 [J]. 环境污染治理技术与设备, 2002, 3(3): 19-23. (XI Beidou, LIU Hongliang, BAI Qingzhong, et al. Study on Current Status of Lignin and Cellulose Biodegradation in Composting Process [J]. Techniques and Equipment for Environmental Pollution Control, 2002, 3(3): 19-23.)
[4] Crawford D L, Pometto A L, Crawford R L. Lignin Degradation byStreptomycesviridosporus: Isolation and Characterization of a New Polymeric Lignin Degradation Intermediate [J]. Applied and Environmental Microbiology, 1983, 45(3): 898-904.
[5] 吴云当, 李芳柏, 刘同旭, 等. 土壤微生物-腐殖质-矿物间的胞外电子传递机制研究进展 [J]. 土壤学报, 2016, 53(2): 277-291. (WU Yundang, LI Fangbai, LIU Tongxu, et al. Mechanism of Extracellular Electron Transfer among Microbe-Humus-Mineral in Soil: A Review [J]. Acta Pedologica Sinica, 2016, 53(2): 277-291.)
[6] HUANG Panming, WANG Mingkuang, CHIU Chihyu, et al. Soil Mineral-Organic Matter-Microbe Interactions: Impacts on Biogeochemical Processes and Biodiversity in Soils [J]. Pedobiologia, 2005, 49(6): 609-635.
[7] 李艳, 窦森, 刘艳丽, 等. 微生物对暗棕壤添加玉米秸秆腐殖化进程的影响 [J]. 农业环境科学学报, 2016, 35(5): 931-939. (LI Yan, DOU Sen, LIU Yanli, et al. Effects of Different Microorganisms on Humification of Corn Stover Incorporated in Dark Brown Soil [J]. Journal of Agro-Environment Science, 2016, 35(5): 931-939.)
[8] HUANG Hongli, ZENG Guangming, TANG Lin, et al. Effect of Biodelignification of Rice Straw on Humification and Humus Quality byPhanerochaetechrysosporiumandStreptomycesbadius[J]. International Biodeterioration & Biodegradation, 2008, 61(4): 331-336.
[9] Yanagi Y, Tamaki H, Otsuka H, et al. Comparison of Decolorization by Microorganisms of Humic Acids with Different13C NMR Properties [J]. Soil Biology & Biochemistry, 2002, 34(5): 729-731.
[10] XI Beidou, HE Xiaosong, DANG Qiuling, et al. Effect of Multi-stage Inoculation on the Bacterial and Fungal Community Structure during Organic Municipal Solid Wastes Composting [J]. Bioresource Technology, 2015, 196: 399-405.
[11] Filip Z, Haider K, Martin J P. Influence of Clay Minerals on the Formation of Humic Substances byEpicoccumnigrumandStachybotryschartarum[J]. Soil Biology & Biochemistry, 1972, 4(2): 147-154.
[12] Fukuchi S, Miura A, Okabe R, et al. Spectroscopic Investigations of Humic-Like Acids Formed via Polycondensation Reactions between Glycine, Catechol and Glucose in the Presence of Natural Zeolites [J]. Journal of Molecular Structure, 2010, 982(1/2/3): 181-186.
[13] Duarte R M B O, Fernndez-Getino A P, Duarte A C. Humic Acids as Proxies for Assessing Different Mediterranean Forest Soils Signatures Using Solid-State CPMAS13C NMR Spectroscopy [J]. Chemosphere, 2013, 91(11): 1556-1565.
[14] 魏世勇, 刘凡, 冯雄汉, 等. 针铁矿-高岭石二元体的微观结构与形成机制 [J]. 土壤学报, 2011, 48(2): 320-330. (WEI Shiyong, LIU Fan, FENG Xionghan, et al. Microstructure of Goethite-Kaolinite Dyad and Mechanism of Its Formation [J]. Acta Pedologica Sinica, 2011, 48(2): 320-330.)
[15] 贾春云, 李培军, 魏德洲, 等. 微生物在矿物表面吸附的研究进展 [J]. 微生物学通报, 2010, 37(4): 607-613. (JIA Chunyun, LI Peijun, WEI Dezhou, et al. Research Advances on Adsorption of Bacteria to Mineral Surface [J]. Microbiology China, 2010, 37(4): 607-613.)
[16] 刘军, 景峰, 李同花, 等. 秸秆还田对长期连作棉田土壤腐殖质组分含量的影响 [J]. 中国农业科学, 2015, 48(2): 293-302. (LIU Jun, JING Feng, LI Tonghua, et al. Effects of Returning Stalks into Field on Soil Humus Composition of Continuous Cropping Cotton Field, 2015, 48(2): 293-302.)
[17] 李仁义. 粘土矿物和铁氧化物对两种地带性土壤微生物多样性的影响 [D]. 武汉: 华中农业大学, 2011. (LI Renyi. Impact of Clay Minerals and Fe Oxides on Micbial Diversity in Two Chinese Soils [D]. Wuhan: Central China Agricultural University, 2011.)
[18] 张立超, 包先明, 余福波, 等. 富里酸和胡敏酸在蒙脱石上的吸附特性 [J]. 环境科学研究, 2013, 26(12): 1333-1339. (ZHANG Lichao, BAO Xianming, YU Fubo, et al. Studies on the Adsorption Mechanisms of Fulvic Acid and Humic Acid on Smectite [J]. Research of Environmental Sciences, 2013, 26(12): 1333-1339.)
[19] Nannipieri P, Ascher J, Ceccherini M T, et al. Microbial Diversity and Soil Functions [J]. European Journal of Soil Science, 2003, 54(4): 655-670.
[20] Traversa A, D’orazio V, Mezzapesa G N, et al. Chemical and Spectroscopic Characteristics of Humic Acids and Dissolved Organic Matter along Two Alfisol Profiles [J]. Chemosphere, 2014, 111: 184-194.
[21] Murray H H. Traditional and New Applications for Kaolin, Smectite, and Palygorskite: A General Overview [J]. Applied Clay Science, 2000, 17(5/6): 201-207.
[22] 荣兴民, 黄巧云, 陈雯莉, 等. 细菌在两种土壤矿物表面吸附的热力学分析 [J]. 土壤学报, 2011, 48(2): 331-337.(RONG Xingmin, HUANG Qiaoyun, CHEN Wenli, et al. Surface Thermodynamical Analysis of Adsorption of Bacteria on Two Soil Clay Minerals [J]. Acta Pedologica Sinica, 2011, 48(2): 331-337.)
[23] 汪玉, 司友斌. 纳米黏土矿物对阿特拉津的吸附-解吸特性研究 [J]. 农业环境科学学报, 2009, 28(1): 125-129. (WANG Yu, SI Youbin. Adsorption and Desorption of Atrazine on Nanoscale Clay Minerals [J]. Journal of Agro-Environment Science, 2009, 28(1): 125-129.)
[24] Chorover J, Amistadi I M K. Reaction of Forest Floor Organic Matter at Goethite, Birnessite and Smectite Surfaces [J]. Geochimica et Cosmochimica Acta, 2001, 65(1): 95-109.
[25] WU Pingxiao, TANG Yini, WANG Wanmu, et al. Effect of Dissolved Organic Matter from Guangzhou Landfill Leachate on Sorption of Phenanthrene by Montmorillonite [J]. Journal of Colloid and Interface Science, 2011, 361(2): 618-627.
