高效诱导子的制备方法及诱导成分研究
2018-03-27游思远樊聪静黎轶凡欧阳潇潇魏赛金
聂 丽, 游思远, 樊聪静, 黎轶凡, 欧阳潇潇, 魏赛金
(江西农业大学生物科学与工程学院/江西省农业微生物资源开发与利用工程实验室,江西南昌 330045)
诱导子是植物抗病生理过程中能够诱发植物产生植保素和引起植物过敏反应的因子,在植物与微生物的相互作用中,能快速、高度专一性地诱导特定基因的表达[1]。生物诱导子是诱导子中的一类,是植物、微生物在防御过程中为对抗其微生物侵染而产生的物质,主要包括分生孢子(conidia)[2]、降解细胞壁的酶类[3]、有机体细胞壁碎片[4]、有机体产生的代谢物[5]以及培养物滤液中的成分,如真菌菌丝体和细菌的菌体、匀浆、细胞壁成分、培养物滤液等。
目前,制备生物诱导子的方法有物理[6-7]、化学[8]方法,真菌诱导物起作用的成分主要来自菌丝体,人们普遍用的有3种制备方法:将菌丝体研磨成匀浆,匀浆液高压灭菌制得真菌诱导子;将菌丝体滤去,将滤出液灭菌作为诱导子;将菌丝体烘干后研磨成均匀的干粉制得诱导子[5,8]。
笔者所在项目组在以棉花枯萎病为靶标的农用抗生素产生菌的分离筛选中,从棉花地土壤中分离筛选到1株链霉菌702[9];进一步从其发酵产物中分离提取的抗真菌活性物质为多烯类大环内脂抗生素,命名为“农抗702”(antifungalmycin 702)[10],该组分对水稻纹枯病病菌、稻瘟病病菌、稻曲病病菌等14种植物病原真菌有明显的抑制作用[11-12],但链霉菌702合成农抗702的量很低。笔者所在项目组前期试验筛选出大肠杆菌制备物的诱导子,加入链霉菌702发酵后,农抗702的产量明显提高[13]。本试验以大肠杆菌制备诱导子为研究对象,获得菌体,探讨研磨法、冻融法、研磨法+冻融法、超声波破碎法、微波破碎法、化学渗透法、自溶法、酶溶法破碎大肠杆菌细胞获得的诱导子对链霉菌702发酵效果,以确定制备高效细菌诱导子的方法,并通过有机溶剂萃取分离法,对诱导子的主要作用成分进行初步分析。
1 材料与方法
1.1 菌种
链霉菌702(Streptomyces702)、桔青霉菌(Penicilliumcitrinum)、大肠杆菌(Escherichiacoli)均为江西农业大学生物科学与工程学院生物工程实训基地的保藏菌种。
1.2 培养基
LB培养基:10 g/L蛋白胨,5 g/L酵母膏,10 g/L氯化钠,pH值7.0。PDA培养基:200 g/L马铃薯,20 g/L蔗糖,20 g/L 琼脂,pH值自然。PDB培养基:200 g/L马铃薯,20 g/L 蔗糖,pH值自然。种子培养基:200 g/L马铃薯,20 g/L 蔗糖,pH值自然。以上培养基所用马铃薯均去皮煮沸,纱布过滤,取滤液。
发酵培养基:16.83 g/L玉米淀粉,30 g/L玉米粉,15 g/L大豆饼粉,20 g/L葡萄糖,8.64 g/L蛋白胨,0.3 g/L磷酸二氢钾,5 g/L硝酸钾,5 g/L氯化钙,10 g/L大豆油,起始(消前)pH值8.0。
1.3 方法
1.3.1 制备细菌诱导子 大肠杆菌活化后,取50 mL接入250 mL三角瓶中培养24 h后,按接种量10%装接到 2 000 mL 三角瓶中(总装液量400 mL),振荡培养3 d,离心过滤获得菌体。将菌体与蒸馏水按1 g ∶4 mL料液比混匀,获得的湿菌体,分别采用研磨法、冻融法、研磨法+冻融法、超声波破碎法、微波破碎法、化学渗透法、自溶法、酶溶法进行细胞破碎,收集处理后的细胞破碎液,分别灭菌,4 ℃保存备用。
研磨法:将湿菌体用液氮研磨,反复研磨1、2、3、4、5 次,每次研磨5 min。
反复冻融法:将湿菌体分别于-80、-20、4 ℃冷冻后,分别在45 ℃水浴、室温(30±2)℃下融解10 min,每个处理总共冻融4次,每次1 h;将6个处理按照顺序分别编号为1、2、3、4、5、6(-80 ℃冷冻+40 ℃水浴处理、-80 ℃冷冻+室温处理分别记为处理1、处理2,以此类推)。
研磨法+冻融法:将湿菌体于-20 ℃冷冻后,取出于室温融解后研磨5 min,反复进行5次。
超声波破碎法:将湿菌体在冰浴条件下用超声细胞破碎仪破碎,频率为20 kHz,每次辐射5 s,间隔5 s,10 min 1次,共5次。总辐射次数为30次。
微波破碎法:将湿菌体加入聚四氟乙烯管中,密封后放入微波炉中,以2 450 MHz的频率和630 W的最大输出功率照射3 min,考察重复次数为1、2、3、4、5次的水平,每次中间间隔冷却1 min。
化学渗透法:向湿菌体中加入不同浓度甘氨酸(1.00、1.50、2.00、2.50、3.00 mol/L)和丝氨酸(0.50、0.75、1.00、1.25、1.50 mol/L),然后将其置于恒温(45 ℃)摇床中振荡处理24 h。
自溶法:向湿菌体中分别加入不同质量分数(1%、2%、3%、4%、5%)NaCl,然后将其置于恒温(45 ℃)摇床中振荡处理24 h。
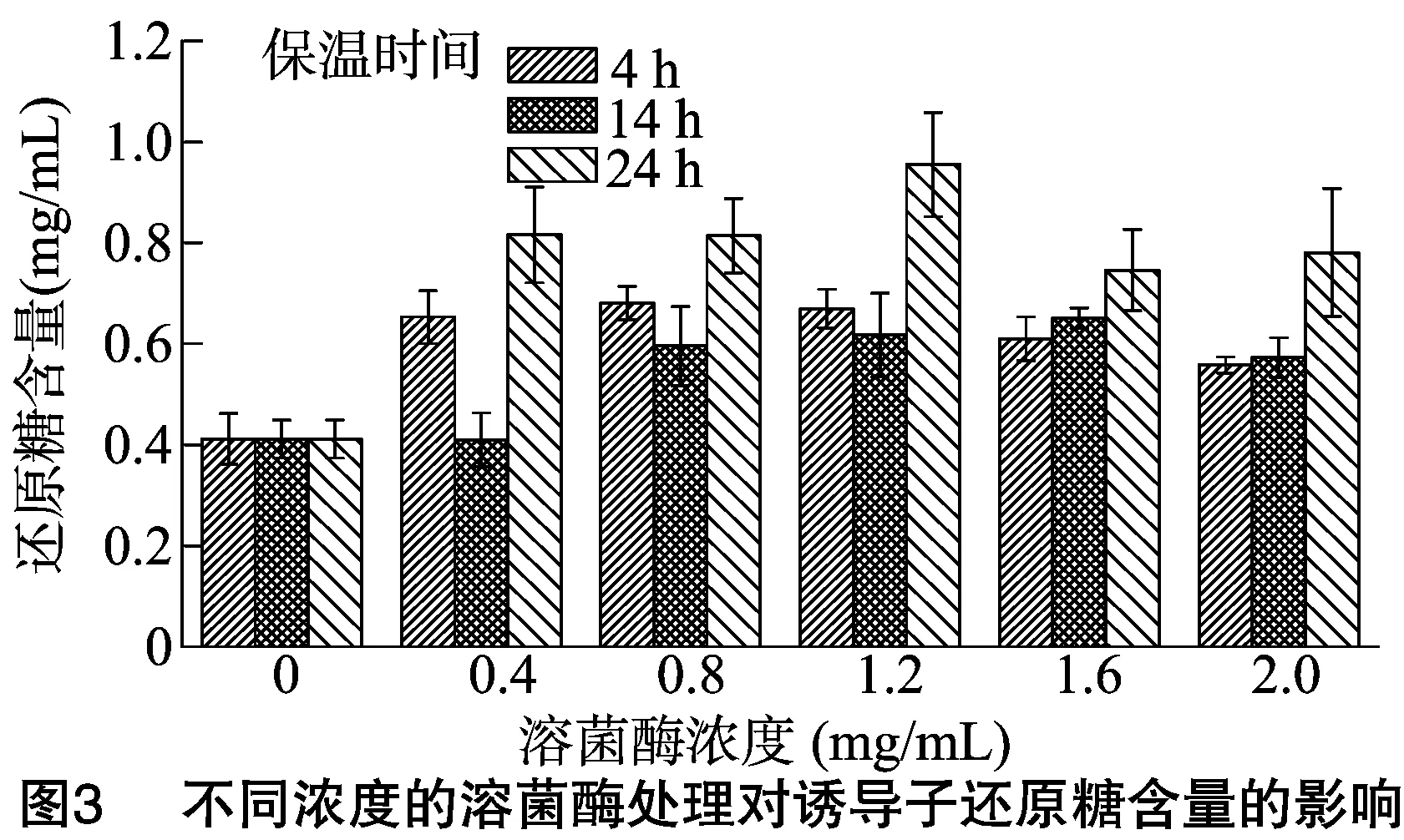
酶溶法:向湿菌体中加入不同浓度(0.4、0.8、1.2、1.6、2.0 mg/mL)的溶菌酶,然后将其置于恒温(45 ℃)摇床中振荡处理不同时间(4、14、24 h)。
1.3.2 诱导子含糖量 用二硝基水杨酸(DNS)法测定[14]各种诱导子的还原糖含量。以葡萄糖浓度(x)为横坐标,以各个浓度对应的D550 nm(y)为纵坐标,标准曲线为y=0.719 1x-0.099 0,r2=0.999 3,查标准曲线可求出还原糖的浓度。
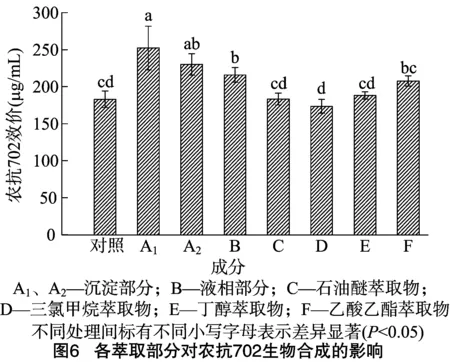
1.3.3 诱导子中主要活性成分分析 将制备好的诱导子于8 000 r/min离心20 min,得到沉淀部分(A1),用终浓度为95%的预冷乙醇处理诱导子的上清液,将混合物置于4 ℃冰箱内,12 h后于8 000 r/min离心20 min,得到沉淀部分(A2),沉淀部分的主要成分是多糖、糖蛋白,去除上清中的乙醇得到液相部分(B)[5]。液相部分(B)分别用3倍体积的石油醚、三氯甲烷、乙酸乙酯和丁醇进行萃取,每种萃取液都用旋转蒸发仪去除有机溶剂进行收集,得到石油醚萃取物(C)、三氯甲烷萃取物(D)、丁醇萃取物(E)和乙酸乙酯萃取物(F)[15]。将这些成分在链霉菌702发酵35 h时加入,分析诱导子的主要诱导成分和效应,以未添加诱导子的发酵液为空白对照。
1.3.4 链霉菌702发酵液抑菌活性的测定 将培养64 h的链霉菌702种子液,按10%接种量转接到发酵培养基中,30 ℃、180 r/min振荡培养,培养至35 h时,将还原糖浓度为 3.1 μg/mL 的大肠杆菌诱导子加入发酵液中继续培养至7 d,取样,测定发酵液的生物活性;以添加未处理过的诱导子为对照,不同处理方法的诱导子活性测定,以及诱导子中主要活性成分分析中的发酵液抑菌活性采用一剂量法测定效价[16]。发酵液效价标定以那他霉素(natamycin)作为对照抗生素,以橘青霉为指示菌测定抑菌圈,以对照抗生素的各个浓度的对数为横坐标(x),以各浓度对应的抑菌圈直径校正值为纵坐标(y),制得回归方程为y=20.301x-9.878 5,r2=0.977 5,换算出发酵液的效价。
1.4 数据分析处理
采用OriginPro9软件、DPS统计分析软件进行数据分析。
2 结果与分析
2.1 不同制备方法所得诱导子的还原糖含量及对农抗702效价的影响
2.1.1 物理法 由表1可知,冻融法与研磨法结合使用,诱导子的含糖量均比单一使用研磨法或反复冻融法的高,且处理次数为3次时,含糖量达到了最高值,为1.46 mg/mL,比CK组提高了256.10%。冻融法+研磨法的处理次数为2次时,诱导子诱导链霉菌702产农抗702的效果最佳,比CK组提高了19.85%。由图1可知,微波次数为3次,即9 min时,诱导子含糖量比CK组提高了238.11%,而诱导子诱导链霉菌702产农抗702的最佳时间为6 min。由图2可知,超声破碎总时间为30 min时,诱导子含糖量最高,比CK组提高了 193.37%,此时诱导子诱导链霉菌702产农抗702的效果最佳,比CK组提高了23.83%。

表1 机械破碎对诱导子的还原糖含量及农抗702效价的影响
注:表中数据为3次重复的“平均值±标准差”。同列数据后不同小写字母表示经Duncan氏新复极差法检验差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下表同。
2.1.2 化学渗透法 由表2可知,随着丝氨酸浓度的增加,诱导子的含糖量增加,诱导链霉菌702产农抗702的效果增强,当丝氨酸浓度为0.50 mol/L时,诱导子的含糖量、农抗702的效价达到了最大值,分别比CK提高了56.10%、37.95%;之后随着丝氨酸浓度的增加,诱导子的含糖量及诱导效果降低。甘氨酸浓度仅为1.5 mol/L时,处理的诱导子含糖量及诱导产农抗702的量高于CK,说明丝氨酸处理的效果明显高于甘氨酸处理。
2.1.3 酶溶法与自溶法 由图3、图4可知,不同保温时间及不同溶菌酶浓度处理对诱导子还原糖与农抗702效价的影响不同,整体而言,保温时间越长,诱导子含糖量越高,溶菌酶浓度为1.2 mg/mL, 保温时间为24 h时, 诱导子含糖量达到最大值,为0.95 mg/mL,比CK提高了131.96%,差异显著;在溶菌酶浓度为0.8 mg/mL,保温时间为24 h时,诱导子诱导链霉菌702产农抗702的量最高,为380.88 μg/mL,比CK提高了39.70%,差异显著。



表2 不同浓度的丝氨酸和甘氨酸处理对诱导子还原糖含量及农抗702效价的影响

由图5可知,应用自溶法处理的诱导子,随着NaCl浓度增加,诱导子的含糖量随着增加,在NaCl浓度为4%时,诱导子的含糖量达到最大值,为0.84 mg/mL,比CK提高了104.04%,差异明显,之后随着NaCl浓度的增加而降低;诱导子诱导链霉菌702产农抗702的量虽然与诱导子含糖量的变化趋势一致,当NaCl浓度为4%时,农抗702效价达到最大值,比CK提高了11.03%,差异明显,但是NaCl浓度在1%~2%间时,农抗702效价低于CK。

2.2 诱导子中主要作用成分分析
由图6可知,沉淀部分A1、A2对农抗702的合成诱导活性最好,较CK分别提高了37.91%、25.82%,差异显著;液相部分B能够提高农抗702的产量,比CK提高了18.04%;其他4 种萃取物和萃余液,除了乙酸乙酯萃取物F对农抗702的生物合成有诱导作用,较对照提高了15.52%,其他3种萃取物几乎没有诱导活性。由结果可知,细菌诱导子中起主要诱导活性的是蛋白、多糖类物质,此外,一些非蛋白、非多糖类的小分子物质对农抗702的合成具有诱导作用,并且其极性与乙酸乙酯相近。
3 小结与讨论
本研究通过5种物理破碎法处理大肠杆菌后制备成诱导子,其中冻融法与研磨法结合的处理次数为3次时,含糖量达到最高值,为1.46 mg/mL,比CK提高了256.10%,这与赵亚娥等的结果[17]相似,可能的原因是-20 ℃使大肠杆菌细胞迅速冻结后温度降至-20 ℃,后又突然回到常温融化,加上研磨,这种猝冷和常温反复交替的过程,使大肠杆菌细胞壁两侧出现很大的温差,产生热应力,引起细胞壁断裂,促使胞壁物质大量释放。而超声破碎总时间为30 min所得诱导子诱导链霉菌702产农抗702的效果最佳,比CK提高了 23.83%。这与戴佳锟等的研究结果[18]相似。即在破碎时间为30 min时,破碎率最高,且外源蛋白活性高。
通过加入丝氨酸、甘氨酸2种温和化学渗透剂处理大肠杆菌后制备成诱导子,当丝氨酸浓度为0.50 mol/L时,诱导子的含糖量以及农抗702的效价达到了最大值,分别比CK提高了56.10%、37.95%;丝氨酸处理的诱导子含糖量高于甘氨酸的处理,这与李夏兰等的研究结论[19]相反,可能的原因是化学渗透剂作用的细胞壁结构有差异,大肠杆菌是革兰氏阴性细菌,而李夏兰等研究的是酵母菌,属于真菌。且丝氨酸处理的诱导子诱导农抗702合成的量不仅比甘氨酸处理的高,还比物理处理法的高,可能的原因是丝氨酸本身对链霉菌702合成农抗702具有诱导活性,具体原因有待进一步研究。
溶菌酶通过水解肽聚糖上N-乙酰葡萄糖胺和N-乙酰胞壁酸之间的β-1,4糖苷键,进入细胞,改变细胞表面的结构和环境,使细胞内环境的平衡被打破,随后导致细胞壁溶解[20]。溶菌酶浓度为1.2 mg/mL,保温时间为24 h时,诱导子含糖量达到最大值,为0.95 mg/mL,比CK提高了 131.96%;同时在溶菌酶浓度为0.8 mg/mL,保温时间为24 h时,诱导子诱导链霉菌702产农抗702的效果最好,为 380.88 μg/mL,比CK提高了39.70%。以上结果说明,保温时间越长,诱导子的含糖量及诱导效果越好。这与贾艳萍等的结果[21]相反,虽说反应条件不同,但是溶菌酶破壁是一种温和无公害的方法,有利于诱导子诱导农抗702的积累。
自溶法主要利用细胞内外渗透压的差异进行细胞破碎,在NaCl浓度为4%时,诱导子的含糖量达到最大值,诱导效果最佳,这与单振秀等的研究结果[22]一致。细菌诱导子虽能有效地促进农抗702的生物合成,但具体的作用成分还不清楚。本试验采用有机溶剂萃取分离的方法,将细菌诱导子悬浮液进行分离,进而测定各种萃取部分对农抗702合成的诱导活性。结果表明,细菌诱导子中起主要诱导活性的是蛋白、多糖类物质,此外一些非蛋白、非多糖类的小分子物质对农抗702的合成具有诱导作用,并且其极性与乙酸乙酯相近,这与王亚洲等的研究结果[15]相反,可能的原因是真菌代谢物与细菌细胞壁的成分存在差异。
本研究通过物理、化学、生物法处理大肠杆菌菌体制备成诱导子,且进一步研究了这些诱导子对链霉菌702合成农抗702的诱导效应,为生物诱导子的制备方法体系提供了理论依据。本试验初步研究了诱导子的主要成分的诱导活性,具体是何种成分物质还有待进一步研究。
[1]Vasconsuelo A,Boland R. Molecular aspects of the early stages of elicitation of secondary metabolites in plants[J]. Plant Science,2007,172(5):861-875.
[2]姜彩鸽,贺运春,胡亚娟,等. 植物病原镰刀菌大分生孢子的诱导研究[J]. 山西农业大学学报(自然科学版),2008,28(4):432-435.
[3]袁丽峰,黄耀坚,郑忠辉,等. 诱导子对拟茎点霉139产去乙酰真菌环氧乙酯的调节作用[J]. 厦门大学学报(自然科学版),2011,50(1):101-105.
[4]赵俊云. 棉花植保素与桔梗皂甙的诱导生成研究[D]. 武汉:华中师范大学,2002:18-20.
[5]Wang D,Yuan J,Gu S,et al. Influence of fungal elicitors on biosynthesis of natamycin byStreptomycesnatalensisHW-2[J]. Applied Microbiology and Biotechnology,2013,97(12):5527-5534.
[6]卜美玲. 纳他霉素高产菌株的诱变选育及发酵工艺的优化[D]. 洛阳:河南科技大学,2012:35-36.
[7]韩建荣. 青霉PT95菌株的鉴定、菌核分化和产生类胡萝卜素的研究[D]. 太原:山西大学,2005.
[8]王剑文,郑丽屏,谭仁祥. 促进黄花蒿发根青蒿素合成的内生真菌诱导子的制备[J]. 生物工程学报,2006,22(5):829-834.
[9]黎循航,刘 姝,涂国全. 链霉菌702所产生物活性物质抑菌活性的初步研究[J]. 江西农业大学学报(自然科学版),2002,24(6):829-832.
[10]钟 敏,童孝田,孙宇辉,等. 链霉菌702所产抗细菌组分S2的化学结构鉴定[J]. 福建农林大学学报(自然科学版),2007,36(3):307-311.
[11]Xiong Z Q,Zhang Z P,Li J H,et al. Characterization ofStreptomycespadanusJAU4234,a producer of actinomycin X2,fungichromin,and a new polyene macrolide antibiotic[J]. Applied and Environmental Microbiology,2012,78(2):589-592.
[12]魏赛金,王世强,李昆太,等. 链霉菌702对水稻种子萌发、幼苗生长及土壤微生物的影响[J]. 农业环境科学学报,2014,33(5):853-861.
[13]聂 丽,魏赛金. 促进链霉菌702产生农抗702的诱导子筛选研究[J]. 浙江农业学报,2016,28(7):1177-1182.
[14]刘忠义,欧昌荣,汤海青,等. 3,5-二硝基水杨酸法测定葡萄酒中总糖含量的条件优化[J]. 核农学报,2013,27(11):1717-1723.
[15]王亚洲,古绍彬,刘胜男,等. 真菌诱导子对纳他霉素生物合成的影响[J]. 中国食品添加剂,2015(2):63-68.
[16]涂 璇,涂晓嵘,张智平,等. 链霉菌702抗药性致死突变标志微波诱变筛选研究[J]. 中国抗生素杂志,2010,35(1):16-19.
[17]赵亚娥,成 慧,寻 萌,等. 人体蠕形螨的DNA提取与随机引物PCR检测[J]. 昆虫学报,2009,52(8):929-933.
[18]戴佳锟,李 燕,马 齐,等. 从毕赤酵母中提取外源重组蛋白的超声破碎条件及优化[J]. 食品科学,2012,33(10):57-60.
[19]李夏兰,蔡婀娜,曾明荣. 温和化学渗透法破碎酵母细胞的研究[J]. 药物生物技术,2000,7(1):23-27.
[20]尹金凤. 溶菌酶对大肠杆菌的抗菌作用机制及其增效技术的研究[D]. 无锡:江南大学,2011:1-5.
[21]贾艳萍,魏 群,赵 军. 对酵母细胞酶法破壁的研究[J]. 中国酿造,2005,9(9):11-13.
[22]单振秀,江 澜,王宜林. 富硒酵母细胞壁破碎方法的比较——细胞自溶法和酸-热破碎法[J]. 西南农业大学学报,2001,23(4):365-367,373.
