蛇麻黄浸提液对苔藓结皮生长的影响
2018-03-26吉雪花王露洁庞胜群
吉雪花,王露洁,庞胜群
(石河子大学农学院,新疆 石河子832003)
地表是荒漠生态系统中脆弱的部分,其稳定性的降低将直接导致荒漠化和沙尘暴的发生。张元明等[1]和赵允格等[2]报道只要环境条件适宜,生物结皮是可以快速恢复的,这一点为人工恢复、种植生物结皮提供了理论和现实依据。苔藓(Bryumdunense)结皮是生物结皮的高级阶段,具有耐旱、抗寒,硬度高、不易破损,抗干扰力强等特点,在涵养水土、防风固沙方面的作用显著优于藻结皮和地衣结皮,是生物固沙的理想材料。多数研究围绕生物结皮对维管植物的影响开展,而关于维管植物对生物结皮影响的研究则较少。张军红等[3]对毛乌素沙地,赵洋等[4]对腾格里沙漠的油蒿(Artemisiaordosica)研究均表明灌丛对生物结皮的盖度、厚度有显著影响。张军红等[3]研究表明油蒿枯落物重量与生物结皮厚度呈显著线性相关(R2=0.348);油蒿的灌丛半径与生物结皮面积显著线性相关(R2=0.465)。大多数研究认为灌丛与生物结皮发育正相关主要是由于灌丛能够提高土壤肥力及改善小气候环境等方面[5-8],对于维管植物凋落物成分及根系分泌物和生物结皮定居关系的研究却较少。
前人研究表明麻黄属(Ephedra)植物多含有较高的麻黄碱,常对周围植物产生化感作用。如Dadkhah[9]报道木麻黄(Casuarinaequisetifolia)叶片浸提液能够显著降低杂草叶面积、株高、叶绿素。王春晴等[10]比较了木麻黄凋落物、根和根际土壤浸提液的成分和含量,结果表明,3种浸提液的化学成分有明显差别。林武星[11]研究表明木麻黄能通过根泌、叶淋、枯落叶分解等途径产生化感作用物质抑制自身生长。蛇麻黄(Ephedradistachya)是麻黄科常绿小灌木,在古尔班通古特沙漠蛇麻黄是除梭梭(Haloxylonammodendron)外的第二大灌木群落[12-13]。该沙漠苔藓结皮广泛分布在蛇麻黄灌丛下[8]。那么,蛇麻黄作为麻黄属的一种是否也存在化感作用?苔藓结皮的大量分布是否和其化感作用有关?本研究以蛇麻黄叶片、根系、和表层根际土壤浸提液为化感物质,苔藓结皮为受体,采用室内沙培方法,研究蛇麻黄对苔藓结皮生长发育的影响,探明蛇麻黄对苔藓结皮是否存在化感作用,明确蛇麻黄分泌物与苔藓结皮定居的关系,这对于深入阐明维管植物与生物结皮的关系,补充完善苔藓结皮人工培养技术,具有一定的理论和实践意义。
1 材料与方法
1.1 材料
古尔班通古特沙漠东南部苔藓结皮、蛇麻黄植株。
1.2 方法
1.2.1蛇麻黄样地设置 在沙漠东南部丘间低地选取(该区域为苔藓结皮和蛇麻黄优势发育区)30 m×30 m样方,对没有苔藓结皮分布的蛇麻黄灌丛挂牌标记,作为浸提液提取材料。2015年4月采集成型的蛇麻黄植株(株高30 cm,处于绿茎期,未现蕾开花),取3株做重复,带回实验室。
1.2.2蛇麻黄浸提液 取蛇麻黄叶片、根系、根际土壤各500 g,分别放入1.0 L蒸馏水及1.0 L 95%乙醇溶液中浸泡,24 h后将浸提液过滤,滤液为0.5 g·mL-1原液,将此液配成0.05,0.10和0.15 g·mL-1浸提液,在4 ℃下储存。
1.2.3苔藓结皮室内培养 在所选样地内取发育良好的、覆盖度高的苔藓结皮,用小铲铲取装入封口袋带回实验室。将采回的苔藓结皮去杂,浸泡漂洗去除土壤,放入30 ℃烘干48 h,剪碎;在直径9 cm的玻璃培养皿内称取60 g沙漠土,将剪碎的苔藓碎片1 g,均匀撒在培养皿中。按照实验方案,每皿加入含有不同浓度浸提液的Knop培养液15 mL,以蒸馏水加Knop营养液为对照,另设3个培养皿只装沙土,不接种苔藓碎片作为呼吸基础值。碎片撒匀湿润后,其上覆一层沙土(每培养皿5 g沙土)。每浓度3个培养皿重复,将处理好的培养皿放在15 ℃,2000 lx,光照时长每天12 h的光照培养箱中培养,开始时每培养皿加入15 mL浸提液,以后每3 d加相应浓度浸提液5 mL。50 d后逐渐升温至30 ℃(每天增温3 ℃),移至室外(日均温33~35 ℃),观察生长情况并进行指标测量。
1.2.4测量指标 密度、厚度:各培养皿随机取3个面积1 cm×1 cm的样方,在显微镜下对苔藓植株密度进行计数,随机抽取6株苔藓用游标卡尺测量高度取平均值。叶绿素:称取培养皿培养的苔藓植株0.1 g (鲜重,FW),用预冷丙酮及少量石英砂研磨提取,3000 r·min-1离心后定容至10 mL,于663和645 nm下分别测定吸光度,计算叶绿素含量。呼吸测定:培养皿内苔藓结皮的呼吸采用Li-8100测定,测定时每培养皿加入15 mL蒸馏水,使其处于水分饱和状态。测定日期分别在7月2日,7月14日,7月21日和8月6日。每次每培养皿读数2次,每次180 s,共90个数据。
1.3 数据分析
采用Origin 8.0作图。苔藓结皮呼吸速率借鉴韩海燕[14]、吴林等[15]的方法,本实验中用接种苔藓结皮培养皿呼吸值减去沙土呼吸值,计算出苔藓植物自身的CO2释放量。
2 结果与分析
2.1 蛇麻黄浸提液对苔藓结皮生长形态的影响
如图1所示,蛇麻黄叶片、根系及根际土壤浸提液对苔藓结皮的生长有较大影响。水浸提时(处理1~处理9),随着叶片浸提液浓度升高(处理1~处理3),苔藓的植株密度、结皮厚度和叶绿素含量均逐渐增加;而根系(处理4~处理6)和根际土壤(处理7~处理9)水浸提液浓度升高时,苔藓结皮的密度、厚度、叶绿素均出现先升后降的趋势;整体上根际土培养的苔藓长势优于根系,根系的大于叶片。乙醇浸提时(处理10~处理18),同样浓度下,叶片浸提液(处理10~处理12)培养的苔藓生长稀疏、缓慢;根系(处理13~处理15)培养的生长居中;根际土壤(处理16~处理18)培养的茂密、厚实。由图1可知无论是水还是乙醇,不同浓度浸提液培养的苔藓结皮长势都较对照有不同程度的下降。
由图2可知叶片、根系和根际土水浸提液培养的苔藓密度最高值分别为5.5,12.6和19.9株·cm-2,乙醇浸提液培养的分别为8.5,14.6和21.2株·cm-2。相应的水浸提液培养的苔藓结皮厚度最大值分别为2.30,2.25和3.30 mm,乙醇浸提液培养的分别为3.70,5.90和5.90 mm。3个部位水浸提液培养的苔藓叶绿素最高含量分别为0.094,0.167和0.301 mg·g-1FW,乙醇浸提液培养的分别为0.276,0.302和0.433 mg·g-1FW。无论是水浸提还是乙醇浸提,3个部位的浸提液培养的苔藓植株密度、结皮厚度和叶绿素含量均有显著差异;同一部位,整体上浓度高的浸提液培养的植株密度较大,结皮层更厚,叶绿素含量较高,并且不同浓度浸提液培养的植株密度、结皮厚度和叶绿素含量也多呈显著差异。

图2 蛇麻黄浸提液对苔藓生长指标的影响Fig.2 Effect of E. distachya extracts on moss crusts growth indicators A、B、C为水浸提液处理,D、E、F为乙醇浸提液处理。不同字母表示在5%的水平上差异显著。A,B,C are water extracts. D,E,F are ethanol extracts. Different letters indicate significant differences among patches at 5%. 下同The same below.
2.2 蛇麻黄水浸提液对苔藓结皮呼吸速率的影响
利用Li-8100土壤呼吸系统对浸提液培育的苔藓结皮进行了4次呼吸速率分析,结果见图3。由图3可知,水浸提蛇麻黄各部位时,苔藓结皮的呼吸速率在-0.94~1.59 μmol·m-2·s-1变动,其中根际土浸提液培养的苔藓结皮呼吸速率变化较大,叶片浸提液培养的呼吸速率变化较小。由图4可知叶片浸提液培养的苔藓结皮平均呼吸速率大于根系浸提液,根系平均呼吸速率大于根际土。同一部位不同浓度水浸提液培养的苔藓结皮呼吸速率也有差异。如图4所示,无论是叶片、根系还是根际土,浓度为 0.05 g·mL-1水浸提液培养的苔藓结皮平均呼吸速率均最大,而0.15 g·mL-1浓度培养的平均呼吸速率最小。不同部位浸提液均表现出随着浓度的升高,呼吸速率逐渐下降,低浓度和中高浓度平均呼吸速率差异显著。

图3 蛇麻黄水浸提液培养的苔藓结皮呼吸速率变化Fig.3 Respiration rate changes of moss crusts cultured with water extracts of E. distachya

图4 蛇麻黄水浸提液对苔藓结皮平均呼吸速率的影响Fig.4 Effect of water extracts of E. distachya on moss crusts average respiration rate
2.3 蛇麻黄乙醇浸提液对苔藓结皮呼吸速率的影响
如图5所示,以乙醇为浸提液培养苔藓结皮时,苔藓结皮的呼吸速率在-1.48~1.11 μmol·m-2·s-1变动,根际土的呼吸速率变化较剧烈。由图6可知,各浓度下,叶片浸提液培养的苔藓结皮平均呼吸速率大于根系,根系的大于根际土。同一部位不同浓度浸提液对苔藓结皮平均呼吸速率影响明显,乙醇根际土浸提液培养下,苔藓结皮呼吸速率由0.05 g·mL-1的-0.193 μmol·m-2·s-1到0.10 g·mL-1的-0.174 μmol·m-2·s-1,浓度增加到0.15 g·mL-1时,平均呼吸速率为-0.265 μmol·m-2·s-1(图6)。整体上,除叶片外根系和根际土低浓度和中高浓度浸提液培养的苔藓结皮呼吸速率变化幅度差异不显著。

图5 蛇麻黄乙醇浸提液培养的苔藓结皮呼吸速率变化Fig.5 Respiration rate changes of moss crusts cultured with ethanol extracts of E. distachya
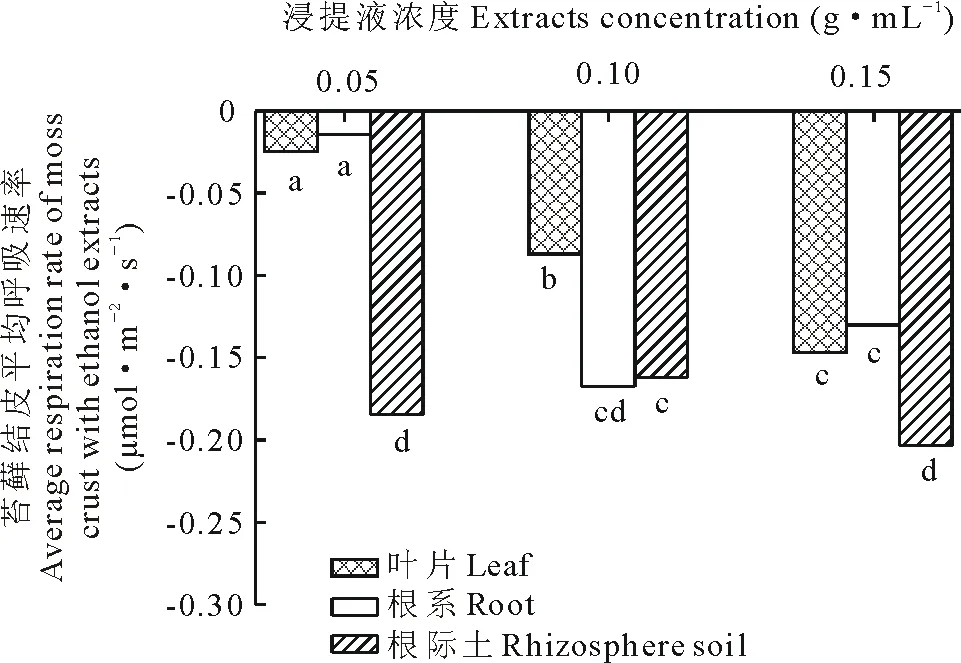
图6 蛇麻黄乙醇浸提液对苔藓结皮平均呼吸速率的影响Fig.6 Effect of ethanol extracts of E. distachya on moss crusts average respiration rate
3 结论与讨论
生物结皮的人工培养历史并不长,但室内人工培养技术已基本建成[16-18]。而野外大面积培养技术却难以突破,影响了生物结皮的恢复和大面积推广。前期关于生物结皮人工培养的研究主要集中在光照、水分和温度等非生物环境因素上,对生物因素的影响关注较少。本研究表明温度和水分一致时,蛇麻黄浸提液培养的苔藓结皮叶绿素、植株密度和结皮厚度都低于对照,说明蛇麻黄不同部位的水浸提液和乙醇浸提液对苔藓结皮的发育有明显的抑制作用。呼吸结果显示两种浸提液培养的苔藓结皮呼吸速率均高于对照,尤其是叶片和根系浸提液培养的苔藓呼吸速率高于根际土。两种浸提液培养下,苔藓结皮表现出随着浓度的升高呼吸速率下降的趋势。这一结果与苔藓结皮的形态与生长指标变化一致,叶片和根系浸提液培养的苔藓由于释放的CO2较多,因此生长缓慢。浸提液浓度较低时CO2的释放量较大,因此发育较差。由此可知苔藓结皮释放CO2的作用由于蛇麻黄成分的存在而加剧。由于释放的碳量增加,用于同化的碳减少,故而造成蛇麻黄浸提液培养的苔藓植株稀疏、矮小。研究中,根际土浸提物培养的苔藓受到的抑制程度较低,这可能与土壤中所含的有机质、微生物等有关。而叶片和根系浸提物中缺乏有机氮、速效磷等养分,因而对苔藓生长的抑制作用更强烈。
本研究结果表明蛇麻黄浸提物对苔藓结皮的定居有一定程度的抑制作用,这与该沙漠苔藓结皮广泛分布在蛇麻黄下的现实情况并不一致。研究认为这与该沙漠的气候环境有关。沙漠地区苔藓植物定居的首要条件是水分,只有湿润状态的苔藓才显现出绿色,具备光合功能,才有可能生长,而干枯状态的苔藓虽然能够存活,但不能进一步的发育、繁殖。蛇麻黄灌丛的存在减少了冠幅下的光照强度,降低了水分蒸发速度,自身又有截留雨水的功能,因此能够显著提高其下的土壤含水量[19-21],从而为苔藓的定居提供先决条件。王敬竹等[22]对该沙漠蛇麻黄灌丛下藻类多样性研究表明,灌丛内藻类的物种数和多样性指数显著低于灌丛外,这也侧面说明蛇麻黄分泌物对结皮的定居发育没有明显的促进作用。由生长和呼吸变化可知,古尔班通古特沙漠苔藓结皮的分布受到蛇麻黄叶片、根系、根际土浸提物的抑制,自然界中苔藓结皮大量分布在蛇麻黄灌丛下应该与灌丛下土壤湿度高有关。
References:
[1] Zhang Y M, Chen J, Wang X Q,etal. The distribution patterns of biological soil crust in Gurbantunggut Desert. Acta Geographica Sinica, 2005, 60(1): 53-60.
张元明, 陈晋, 王雪芹, 等. 古尔班通古特沙漠生物结皮的分布特征. 地理学报, 2005, 60(1): 53-60.
[2] Zhao Y G, Xu M X, Wang Q J,etal. Impact of biological soil crust on soil physical and chemical properties of rehabilitated grassland in Hilly loess plateau, China. Journal of Natural Resources, 2006, 21(3): 441-448.
赵允格, 许明祥, 王全九, 等. 黄土丘陵区退耕地生物结皮对土壤理化性状的影响. 自然资源学报, 2006, 21(3): 441-448.
[3] Zhang J H, Wu B, Jia Z Y,etal. Pattern of biological soil crust and its driving factors underArtemisiaordosicain Mu Us sandy land. Forest Research, 2010, 23(6): 866-871.
张军红, 吴波, 贾子毅, 等. 毛乌素沙地油蒿植冠下生物结皮分布特征及其影响因素研究. 林业科学研究, 2010, 23(6): 866-871.
[4] Zhao Y, Chen Y L, Xu B X. Effect of degradation stage ofArtemisiaordosicaon colonization and development of biological soil crusts. Journal of Desert Research, 2016, 34(4): 983-989.
赵洋, 陈永乐, 徐冰鑫. 油蒿(Artemisiaordosica)退化阶段对生物土壤结皮拓殖和发育的影响. 中国沙漠, 2016, 36(4): 983-989.
[5] Guo Y R, Zhao H L, Zuo X A,etal. Crust development and subsurface soil properties under dominant shrubs in the process of dune restoration Horqin sand land. Environmental Science, 2008, 29(4): 1027-1034.
郭轶瑞, 赵哈林, 左小安, 等. 科尔沁沙地沙丘恢复过程中典型灌丛下结皮发育特征及表层土壤特性. 环境科学, 2008, 29(4): 1027-1034.
[6] Zhao H L, Zhao X Y, Zhang T H. Restoration process and mechanism of Horqin sand desertification. Beijing: China Ocean Press, 2003.
赵哈林, 赵学勇, 张铜会. 科尔沁沙地沙漠化过程及其恢复机理. 北京: 海洋出版社, 2003.
[7] Yan D R. The effects of biological crusts on the nutrient absorption of vascular plants. Journal of Arid Land Resources and Environment, 2009, 23(10): 177-181.
闫德仁. 沙漠生物结皮对维管植物养分吸收的影响. 干旱区资源与环境, 2009, 23(10): 177-181.
[8] Zhang Y M, Pan H X, Pan B R. Distribution characteristics of biological crust on sand dune surface in Gurbantunggut desert, Xinjiang. Journal of Soil and Water Conservation, 2004, 4: 61-64.
张元明, 潘惠霞, 潘伯荣. 古尔班通古特沙漠不同地貌部位生物结皮的选择性分布. 水土保持学报, 2004, 4: 61-64.
[9] Dadkhah A. Phytotoxic effect of aqueous extract of eucalyptus, sunflower and sugar beet on seed germination, growth and photosynthesis ofAmaranthusretroflexus. Allelopathy, 2012, 29(2): 23-35.
[10] Wang C Q, Liu Q, Li L. Isolation and identification of ethylether extract fromCasuarinaequisetifolia. Forestry Science & Technology, 2011, 36(1): 30-33.
王春晴, 刘强, 李蕾. 木麻黄乙醚浸提液的分离及鉴定. 林业科技, 2011, 36(1): 30-33.
[11] Lin W X. Study on regular response ofCasuarinaself-allelopathy. Fuzhou: Fujian Agriculture and Forestry University, 2005.
林武星.木麻黄(Casuarinaequisetifolia)自身他感作用响应规律的研究. 福州: 福建农林大学, 2005.
[12] Chen C D, Zhang L Y, Hu W K. The basic characteristics of plant communities, flora and their distribution, the sand district of Gurbantunggut. Acta Phytoecology and Geobotanic Sinica, 1983, 7(2): 89-99.
陈昌笃, 张立运, 胡文康. 古尔班通古特沙漠的沙地植物群落、区系及其分布的基本特征. 植物生态学与地植物学丛刊, 1983, 7(2): 89-99.
[13] Xia Y, Zhang L Y, Yang W K,etal. The vegetation and its features in the desert grass land nature reserve of Xinjiang. Arid Zone Research, 1997, 14(3): 41-47.
夏阳, 张立运, 杨维康, 等. 新疆荒漠类草地自然保护区的植被及其特征. 干旱区研究, 1997, 14(3): 41-47.
[14] Han H Y. Biological soil crust carbon emission and its effects on soil respiration in alpine sandy land. Beijing: Chinese Academy of Forestry, 2014.
韩海燕. 高寒沙地生物结皮碳释放及其对土壤呼吸的影响. 北京: 中国林业科学研究院, 2014.
[15] Wu L, Su Y G, Zhang Y M. Effects of simulated precipitation on apparent carbon flux of biologically crusted soils in the Gurbantunggut desert in Xinjiang, Northwestern China. Acta Ecologica Sinica, 2012, 32(13): 4103-4113.
吴林, 苏延桂, 张元明. 模拟降水对古尔班通古特沙漠生物结皮表观土壤碳通量的影响. 生态学报, 2012, 32(13): 4103-4113.
[16] Yan D R, Yang J P, An X L,etal. Report of crust sand fixation by alga. Journal of Arid Land Resources and Environment, 2004, 18(5): 147-150.
闫德仁, 杨俊平, 安晓亮, 等. 荒漠藻固沙结皮试验研究初报. 干旱区资源与环境, 2004, 18(5): 147-150.
[17] Zhao J C, Huang S L, Li M,etal. Experimental studies on the characteristics of gemma development inBarbulaindica. Bulletin of Botanic Research, 2005, 25(2): 169-172.
赵建成, 黄士良, 李敏, 等. 小扭口藓(Barbulaindica)芽孢发育特征的实验研究. 植物研究, 2005, 25(2): 169-172.
[18] Nie H L, Wu N, Liang S M,etal. Effects of different sand burial depths on the growth of fragments ofTortuladesertorum. Arid Zone Research, 2006, 23(1): 66-70.
聂华丽, 吴楠, 梁少民, 等. 不同沙埋深度对刺叶墙藓植株碎片生长的影响. 干旱区研究, 2006, 23(1): 66-70.
[19] Bu C F, Yang J Z, Zhang X C. Cultivation experiment of moss plants crusts from biological soil crusts in Mu Us sandy land. Journal of Desert Research, 2011, 31(4): 937-941.
卜崇峰, 杨建振, 张兴昌. 毛乌素沙地生物结皮层藓类植物培育试验研究. 中国沙漠, 2011, 31(4): 937-941.
[20] Zuo X A, Zhao X Y, Zhao H L,etal. Effects of shrub on understory herbaceous plants and soil properties in the restoration processes of degraded vegetation in Horqin sand land. Ecology and Environmental Sciences, 2009, 18(2): 643-647.
左小安, 赵学勇, 赵哈林, 等. 沙地退化植被恢复过程中灌木发育对草本植物和土壤的影响. 生态环境学报, 2009, 18(2): 643-647.
[21] Duncan D H, Vesk P A. Biological soil crust distribution is related to patterns of fragmentation and land use in a dryland agricultural landscape of southern Australia. Landscape Ecology, 2008, 23: 1093-1105.
[22] Wang J Z, Zhang B C, Zhang Y M,etal. Effects of shrubs ofEphedradistachyaandArtemisiaarenariaon algal distribution. Arid Zone Research, 2013, 30(2): 271-275.
王敬竹, 张丙昌, 张元明, 等. 蛇麻黄和沙蒿两种典型灌丛对藻类分布的影响. 干旱区研究, 2013, 30(2): 271-275.
